宫颈高危型人乳头瘤病毒感染与阴道菌群及血清氧化应激水平关系探讨
2020-09-09张送萍尹凌凡毕艳慧
张送萍,尹凌凡,毕艳慧
北京中医药大学深圳医院(深圳518172)
人乳头瘤病毒(Human papilloma virus,HPV)是一种双链DNA型病毒,常见于女性宫颈感染中,既往研究证实其中的持续高危型HPV(High-risk HPV,HR-HPV)感染是女性宫颈癌及癌前病变的高危因素,严重威胁女性身心健康与生活质量[1-3]。女性阴道是一个重要的微生态环境,容易受到病原菌入侵而发生感染,健康状态下阴道微生态菌群处于动态平衡中,HPV感染后机体能通过自身免疫力将其清除,但也存在部分未被清除会持续感染宫颈部位,造成宫颈病变[4]。近年来关于HPV促进宫颈病变的具体过程机制成为研究热点,目前同类研究主要方向在于感染后阴道菌群及局部免疫微环境的变化,有文献指出HPV感染会造成机体高氧化应激状态,这将为HR-HPV致病机制提供一些新思路[5-6]。氧化应激是指机体在遭受炎症或感染等病理变化后氧化-抗氧化防御系统的失衡,它与各种疾病的发生均存在密切联系,是较具代表性的生物标志物[7]。为探究HPV感染对阴道菌群及血清氧化应激状态的影响,本文对112例生殖道感染女性进行宫颈阴道病原菌及血清生化物的检测,并分析其关系,现报告如下。
资料与方法
1 一般资料 选取本院2017年9月至2019年8月有生殖道感染症状患者112例作为研究对象,年龄23~65岁,平均(45.18±8.11)岁。病例纳入标准:所有患者均为已婚或有性生活史;均存在生殖道感染的症状,包括异味、瘙痒、白带增多、性状颜色异常、下腹疼痛、尿频与尿痛等;均对此研究知情并同意。排除标准:伴有其他心、肝、肾等严重性器质性疾病者;伴有免疫性疾病史;伴有子宫切除史者;妊娠期与哺乳期妇女。本研究已通过医院伦理委员会审批。
2 研究方法
2.1 阴道分泌物的采集与检测:采用窥阴器暴露阴道部位后,用无菌棉拭子轻轻刮取阴道侧壁,1根加入10%的KOH溶液进行胺试验,若闻到有氨味或鱼腥样气味,则初步判断存在阴道炎,然后再将1根棉拭子加入生理盐水中反复洗涤,采用悬滴湿片法直接进行滴虫观察,找到滴虫即可确诊为滴虫性阴道炎,采用革兰染色法在油镜下观察霉菌与细菌形态,找到霉菌即可确诊为霉菌性阴道炎,而当线索细胞阳性比例>20%确诊为细菌性阴道炎。
2.2 宫颈分泌物、脱落细胞的采集与检测:采用窥阴器暴露宫颈部位后,先以无菌棉球擦去宫颈表面黏液,使用无菌棉拭子在宫颈管内旋转停留几秒取出,以1 ml无菌生理盐水洗脱,使用实时荧光聚合酶链式扩增反应(Real-time polymerase chain reaction,RT-PCR)检测衣原体、支原体与解脲脲原体感染情况;再使用无菌采样刷在宫颈内顺逆时针各旋转3周,1支置入HPV检测保存液中,采用PCR-反向点杂交法进行HPV分型检测,另1支置入生理盐水中进行离心,去上清后将下层沉淀移入肝素抗凝管中,采用流式细胞仪分析分泌物中CD4+T与CD8+T淋巴细胞比例,每个标本检测3次取平均值。
2.3 血清氧化应激与炎性因子水平检测:空腹抽取外周血,分离血清后采用全自动生化分析仪分析氧化应激水平及炎性因子浓度。氧化应激水平:采用总抗氧化能力检测试剂盒检测总氧化态(Total oxidation state,TOS)与总还原态(Total antioxidant state,TAS),计算氧化应激指数(Oxidative stress index,OSI),OSI=TOS(μmolH2O2Eq/L)/ TAS(mmol Trolox Eq/L)。炎性因子浓度:采用酶联免疫吸附试剂盒检测血清中γ干扰素(Interferon-γ,IFN-γ)、白介素2(Interleukin-2,IL-2)与白介素4(Interleukin-4,IL-4)的浓度,每个标本检测3次取平均值。

结 果
1 HR-HPV感染情况 宫颈分泌物检查结果显示,112例患者中HR-HPV感染阳性患者47例(占41.96%),其中HPV16亚型29例(61.70%),HPV18亚型9例(19.15%),HPV31亚型2例(4.26%),HPV35亚型1例(2.13%),HPV51亚型1例(2.13%),HPV52亚型5例(10.64%)。
2 HR-HPV感染与阴道菌群的关系 HR-HPV阳性组衣原体、解脲脲原体与细菌性阴道炎检出率明显高于HR-HPV阴性组(P<0.05),两组间支原体、霉菌与滴虫检出率无统计学差异(P>0.05),见表1。
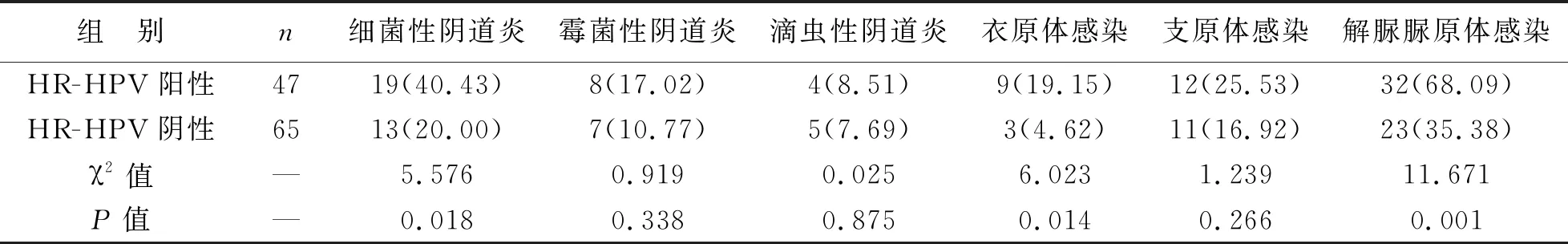
表1 HR-HPV感染与阴道菌群的关系[例(%)]
3 HR-HPV感染与血清氧化应激及炎性因子水平的关系 HR-HPV阳性组TOS、OSI、IFN-γ与IL-2浓度明显高于HR-HPV阴性组(P<0.05),而HR-HPV阳性组TAS与IL-4浓度明显低于HR-HPV阴性组(P<0.05),见表2。
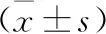
表2 HR-HPV感染与血清氧化应激及炎性因子水平的关系
4 HR-HPV感染与宫颈分泌物CD4+T与CD8+T淋巴细胞比例的关系 HR-HPV阳性组宫颈分泌物CD4+T淋巴细胞比例与CD4+T/CD8+T比值明显低于HR-HPV阴性组(P<0.05),两组间CD8+T淋巴细胞比例无统计学差异(P>0.05),见表3。
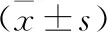
表3 HR-HPV感染与宫颈分泌物CD4+T与CD8+T淋巴细胞比例
5 HR-HPV感染的多因素Logistic回归分析 先对分类变量赋值:HR-HPV阴性=0,HR-HPV阳性=1;细菌性未感染=0,细菌性感染=1 ;衣原体未感染=0,衣原体感染=1;支原体未感染=0,支原体感染=1;解脲脲原体未感染=0,解脲脲原体感染=1;霉菌未感染=0,霉菌感染=1;滴虫未感染=0,滴虫感染=1,进行多因素Logistic回归分析。结果显示,HR-HPV感染与衣原体、解脲脲原体感染率呈现独立正相关关系(P<0.05),与血清TOS、OSI、IFN-γ及IL-2浓度呈现独立正相关关系(P<0.05),与宫颈分泌物中CD4+T/CD8+T比值及血清TAS呈现负相关关系(P<0.05),见表4。
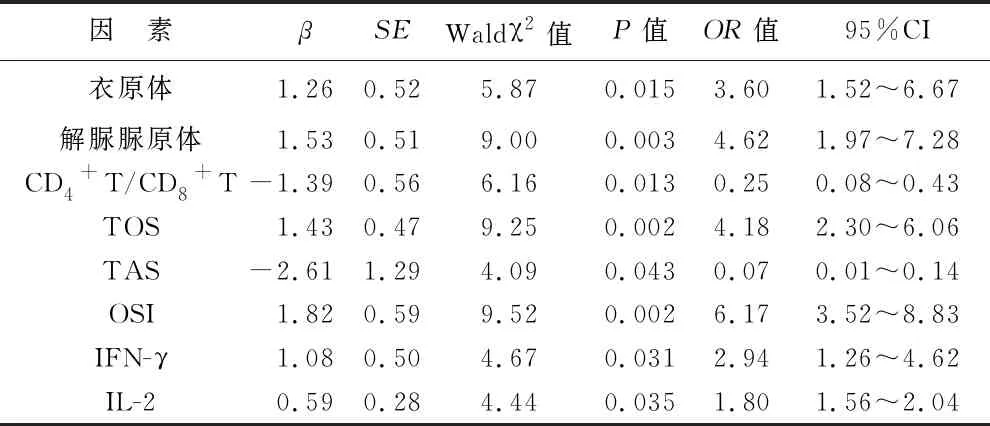
表4 HR-HPV感染多因素Logistic回归分析
讨 论
HR-HPV持续感染宫颈会导致宫颈癌变,而宫颈癌是女性常见的恶性肿瘤,且有逐年年轻化趋势,严重威胁着女性健康[8]。HPV主要传播途径为性传播、母婴传播以及破损黏膜与皮肤的接触性传播等,据最新综述报道接种HPV疫苗可以显著降低HPV感染率,但目前疫苗普及率仍较低,且由于该疫苗的高成本限制了接种人群[9]。由于HPV感染致癌的特殊性,近年来关于HPV的研究仍为临床研究的热门话题,研究其致病机制有助于临床寻求合理的诊疗对策。
本研究中纳入的112例存在生殖道感染症状的女性中,经宫颈分泌物检查结果显示,HR-HPV感染阳性患者47例(占41.96%),其中主要为HPV16亚型(61.70%)与HPV18亚型(19.15%)。HPV是一种长度为8000 bps的双链DNA病毒,目前已分离出的类型多达200种,其中HR-HPV如HPV16亚型与HPV18亚型在宫颈感染中最为常见[10]。既往谢建萍等[11]对300例生殖道感染妇女进行检查,HR-HPV感染者123例,感染率为41.0%,其中主要为HPV16亚型(56.9%)与HPV52亚型(13.8%),总的HR-HPV感染率及HPV16亚型感染率相近,HPV52与HPV18感染率稍有不同,这可能是由于样本基数不够大导致。
本研究结果显示,HR-HPV阳性组衣原体、解脲脲原体与细菌性阴道炎检出率明显高于HR-HPV阴性组,多因素分析后发现HR-HPV感染与衣原体、解脲脲原体感染率呈现独立正相关关系。正常状态下,女性阴道菌群处于一个动态平衡中,乳酸杆菌可以分泌乳酸来维持阴道的酸性环境,还可分泌细菌素、拮抗物质与其他活性物质黏附于阴道黏膜内,这些物质能破坏细菌生物膜,从而抵抗病原体入侵[12-13]。在受到感染与炎性等病理刺激时,阴道菌群会失去平衡[14]。HR-HPV感染后会协同其他病原体如细菌性阴道炎导致癌变,而这些病原体感染与HPV感染的先后顺序难以辨明,可能相辅相成,相互促进[15]。进一步检测发现HR-HPV阳性组宫颈分泌物CD4+T淋巴细胞比例与CD4+T/CD8+T比值明显低于HR-HPV阴性组,回归分析显示HR-HPV感染与宫颈分泌物中CD4+T/CD8+T比值呈负相关关系,显示HR-HPV感染破坏了宫颈有效的细胞免疫作用,促使局部免疫环境失调。沙眼衣原体与解脲脲原体感染后会吸附于生殖道黏膜,损伤黏膜上皮细胞,促使发生炎症反应,使得局部pH升高,生殖道免疫屏障遭受破坏,病原菌容易入侵,增加了HPV感染概率;细菌性阴道炎发生后改变了阴道内菌群结构,乳酸杆菌比例会大幅减少,从而使得弱酸性环境遭受破坏,影响了HPV的清除速率,同时细菌代谢会产生具有致癌作用的亚硝基胺,增强了对HPV的易感性[16-17]。
本研究还发现HR-HPV阳性组血清TOS与OSI浓度明显高于HR-HPV阴性组,而TAS明显低于HR-HPV阴性组,提示HR-HPV感染患者有着更高的血清氧化应激程度。机体在与外界环境相互作用中会不断产生活性氧自由基,这些活性氧与自由基大量存在时会损害人体的正常细胞,需要被及时清除,而负责清除这些物质的是机体的氧化-抗氧化防御系统,这个系统一旦失衡就会产生氧化应激损伤,导致衰老与疾病。HR-HPV感染后,引起活性氧的释放,同时促进前氧化性细胞因子的分泌,导致细胞膜磷脂层的脂质过氧化,而这些过氧化物会跨膜引起膜转运和线粒体呼吸链的功能紊乱,促使细胞凋亡,造成组织损伤[18]。Williams等[19]指出HPV基因产物会增加宿主细胞中的ROS水平,从而诱发的一系列氧化应激反应。Foppoli等[20]指出HPV可以调节宿主细胞的氧化还原稳态,以利于感染和肿瘤转化。氧化应激与炎症反应密切相关,亦互为促进,当机体发生炎症反应时,会诱发氧化应激,而当处于高应激状态时,则会进一步促进炎症反应[20]。HR-HPV阳性组IFN-γ与IL-2浓度明显高于HR-HPV阴性组,而HR-HPV阳性组IL-4浓度明显低于HR-HPV阴性组。IFN-γ主要功能为促进Th1细胞的成熟,并抑制Th2细胞的活化,IL-2是机体免疫应答的关键性细胞因子,其表达有助于增强巨噬细胞的抗瘤活性,IL-4则具有拮抗IFN-γ与IL-2的作用,能促进淋巴母细胞分化成Th2,抑制杀伤细胞激活,HPV感染后血清中IL-2与IFN-γ水平上升,而IL-4水平下降[4]。多因素回归分析发现,HR-HPV与血清TOS、OSI、IFN-γ及IL-2浓度呈现独立正相关关系,与宫颈分泌物中血清TAS呈现负相关关系,再次验证上述推测。
综上所述,宫颈HR-HPV感染患者阴道衣原体与解脲脲原体感染率升高,感染部位局部免疫功能降低,而血清呈现高炎性因子水平与氧化应激状态,均与HR-HPV感染密切相关,对于日后生殖道HPV感染的诊治中或能带来一些启发。本研究的局限性在单中心研究,纳入病例数有限,所以可能造成一定程度的偏倚,有待于日后联合多中心进行大样本的临床试验对此进行验证。
