CircAKT3对视网膜母细胞瘤细胞SO-Rb50增殖和凋亡的影响
2020-09-09周鹏翔宋晓鹏孙启会
周鹏翔,信 波,宋晓鹏,孙启会
解放军第九六〇医院泰安医疗区(泰安 271100)
视网膜母细胞瘤发病率约占所有儿童期癌症的3%,是最常见的眼内恶性肿瘤[1-2],且其高度恶性,肿瘤细胞易通过视神经直接进入到大脑中,或通过血液播散到肺、骨骼及人体其他器官而导致患者死亡[3]。在治疗方面,尽管已经有了诸多有效的治疗方法并且取得了新的进展,但相当多的患者仍必须行眼球摘除术[4-6]。因此,探索视网膜母细胞瘤发生发展背后的分子调控机制,对寻找新的潜在治疗靶点具有重要意义。作为非编码RNA的重要成员,环状RNA(Circular RNA,CircRNA)是一种由共价闭合环构成的RNA分子,它的分子结构决定了其稳定性高,不容易被酶降解[7-8]。最近,大量研究表明,异常表达的CircRNAs参与肿瘤的发生和发展[9-11]。而CircAKT3作为CircRNAs中的一员,其被证明参与了胃癌和肺癌的进展,在这两种肿瘤中均起到癌基因作用,但其是否参与视网膜母细胞瘤的发生和发展,不得而知[12-13]。本实验选取CircAKT3在视网膜母细胞瘤中进行研究,旨在为视网膜母细胞瘤的治疗提供新的靶点。
材料与方法
1 实验材料 ①主要试剂及设备:细胞培养瓶及孔板(美国Corning公司);胎牛血清(Fetal bovine serum,FBS)(杭州四季青公司);通用RT-PCR试剂盒和2×Taq Plus PCR Master Mix试剂盒(北京索莱宝公司);RPMI-1640培养基(美国Hyclone公司);LipofectamineTM2000转染试剂及TRIzol溶液(美国Invitrogen公司);Annexin V-FITC/PI 双染细胞凋亡检测试剂盒(上海贝博公司);分光光度计(日本日立公司);多功能酶标仪(瑞士Tecan公司);梯度PCR仪(美国Bio-Rad公司);荧光定量PCR仪(德国QIAGEN公司);流式细胞仪(美国BD公司)。②细胞株:正常视网膜上皮细胞细胞ARPE-19和视网膜母细胞瘤细胞SO-Rb50均购于美国ATCC。两细胞株均采用含有10% FBS的RPMI-1640培养基在细胞培养箱内进行培养,培养条件设定为:饱和湿度、37 ℃和5 % CO2浓度。
2 实验方法 ①细胞转染:实验所用SiRNA及其对照序列购自广州锐博生物技术有限公司。所有转染均在6孔板内进行,细胞铺板24 h后开始转染,此时处于对数生长期的细胞的汇合度约为50%。采用LipofectamineTM2000试剂进行转染,SiRNA及其对照序列的转染浓度为100 nmol/L,具体步骤参考LipofectamineTM2000操作手册。②实验分组:将实验分为两组,实验组予以转染CircAKT3的SiRNA,对照组转染SiRNA序列的对照序列。③qRT-PCR实验:采用TRIzol溶液提取细胞内RNA,随后采用通用RT-PCR试剂盒进行反转录,最后采用2×Taq Plus PCR MasterMix试剂盒进行qPCR反应。CircAKT3上游引物: 5’-TCCAAATAAACGCCTTGGTGG-3’,下游引物:5’-CCTCAGAGAACACCCGCTCT-3’。GAPDH上游引物: 5’-CGCTCTCTGCTCCTCCTGTTC-3’;下游引物:5’-ATCCGTTGACTCCGACCTTCAC-3’。④CCK-8实验:待细胞转染24 h后,离心收集实验组和对照组细胞,进行3次细胞计数,计算4000细胞所需悬液体积,依次加入96孔板每孔,每孔终体积为100 μl,每组取6个复孔,一共铺4块板。每24 h取一块孔板,每孔加入10 μl CCK-8溶液,在37 ℃放置1 h后,将孔板放入多功能酶标仪进行上机检测。⑤细胞凋亡检测:待细胞转染48 h后,离心收集实验组和对照组细胞,室温下2000 r/min离心5 min,弃去上清。预冷的PBS将细胞重悬,继续离心然后收集细胞,如此洗涤两遍。将细胞浓度调整至1×106/ml,然后向每管中加入400 μl细胞悬液。每管加入 5 μl Annexin V-FITC溶液,轻轻摇匀后,在4 ℃避光孵育15 min。继续加入5 μl PI溶液,在4 ℃避光孵育5 min。然后上机检测。
结 果
1 视网膜母细胞瘤细胞SO-Rb50中CircAKT3表达水平 为了初步明确CircAKT3可能在视网膜母细胞瘤中的作用,实验选择以正常视网膜上皮细胞ARPE-19为参照来检测视网膜母细胞瘤细胞SO-Rb50中CircAKT3的表达水平。qRT-PCR实验结果表明,相较于ARPE-19细胞,SO-Rb50细胞内CircAKT3的表达水平明显增高,两组比较差异有统计学意义(P<0.01)(图1)。结果提示SO-Rb50细胞中表达上升的CircAKT3可能起到促进肿瘤进展的作用。
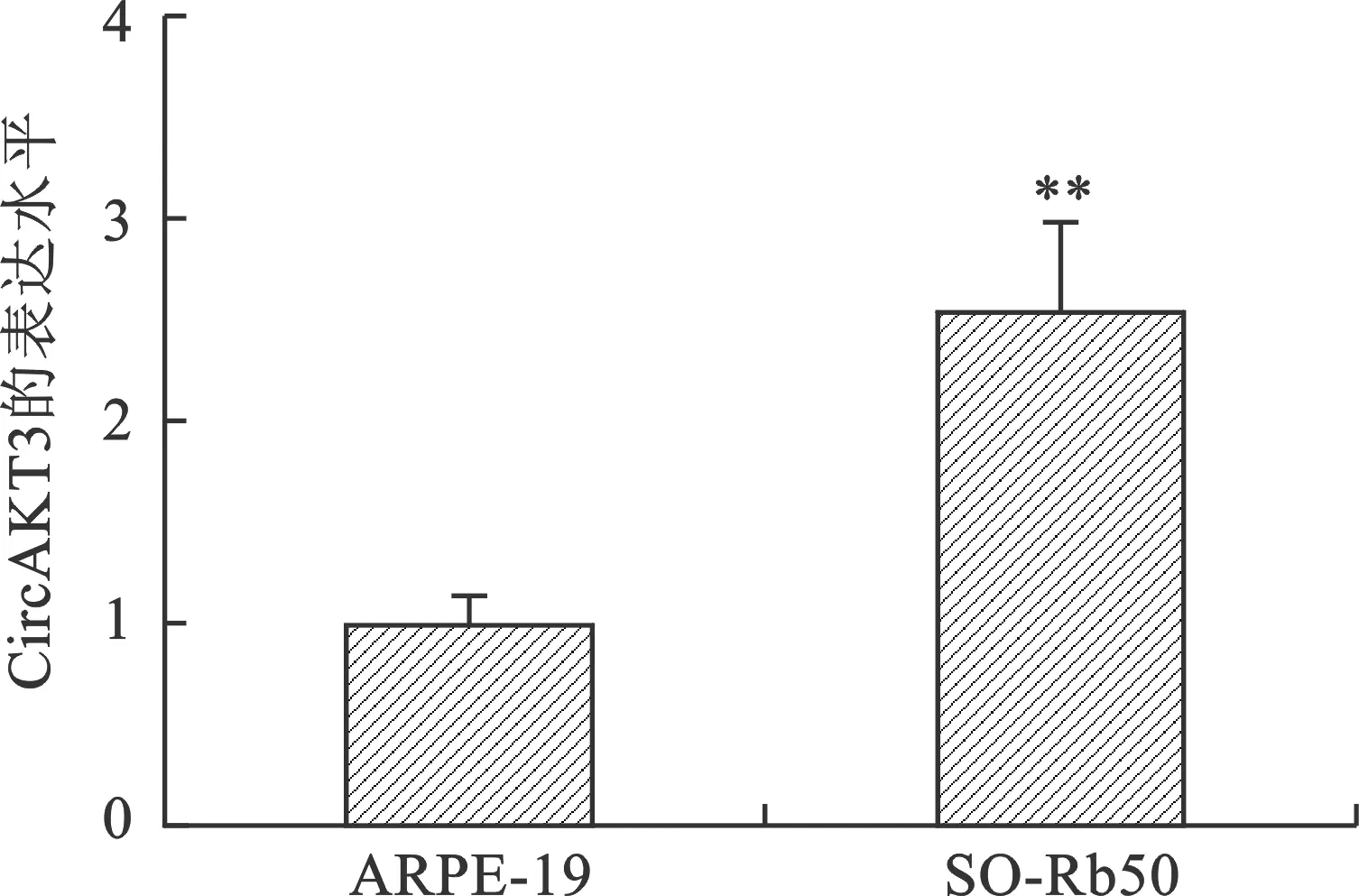
注:与ARPE-19比较,**P<0.01
2 视网膜母细胞瘤细胞SO-Rb50中CircAKT3 SiRNA沉默效率的验证 为了进一步明确CircAKT3在视网膜母细胞瘤中的作用,实验选择SiRNA来下调CircAKT3表达后再进行后续功能验证。在转染24 h后,采用qRT-PCR检测实验组和对照组中SO-Rb50细胞中CircAKT3的表达水平,结果显示,实验组在转染SiRNA后,其细胞内CircAKT3的表达水平与对照组相比明显降低,两组比较差异有统计学意义(P<0.05)(图2)。
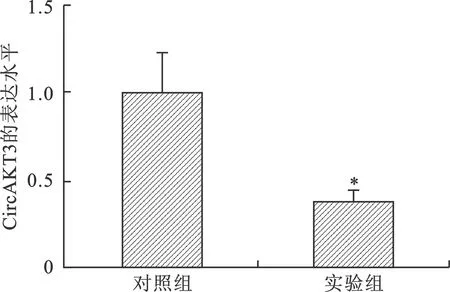
注:与对照组比较,*P<0.05
3 CircAKT3对视网膜母细胞瘤细胞SO-Rb50增殖的影响 在下调SO-Rb50细胞内CircAKT3的表达后,采用CCK-8实验明确CircAKT3对SO-Rb50细胞增殖的影响。实验组在通过转染SiRNA下调CircAKT3的表达后,其细胞在72 h和96 h的OD值明显低于对照组,结果表明,实验组细胞在抑制CircAKT3的表达后,其在72 h和96 h的增殖速度较对照组明显降低,两组比较差异有统计学意义(P<0.05)(图3)。结果也表明CircAKT3本身可以提高SO-Rb50细胞的增殖能力,促进肿瘤进展。
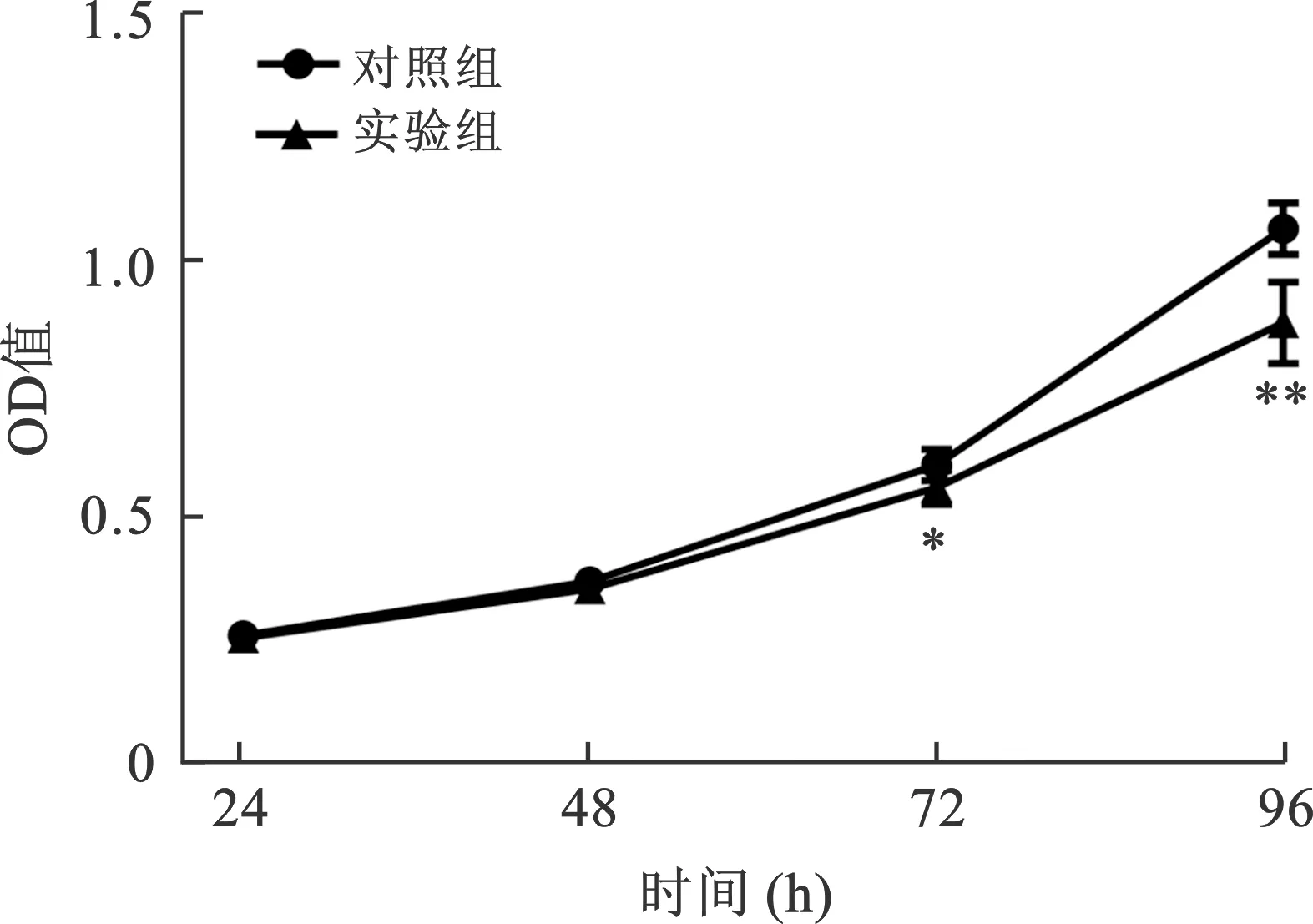
注:与相应时间点对照组相比,*P<0.05,**P<0.01
4 CircAKT3对视网膜母细胞瘤细胞SO-Rb50凋亡的影响 在下调SO-Rb50细胞内CircAKT3的表达后,采用流式细胞仪检测CircAKT3对SO-Rb50细胞凋亡的影响。实验组在通过转染SiRNA下调CircAKT3的表达后,其细胞的凋亡率为(7.71±0.396)%,对照组细胞的凋亡率为(3.51±0.478)%,实验组凋亡率较对照组明显增加,两组比较差异有统计学意义(P<0.001)(图4)。结果也表明CircAKT3本身可以抑制SO-Rb50细胞的凋亡,促进肿瘤进展。

注:与对照组相比,***P<0.001
讨 论
CircRNA是非编码肿瘤基因组中的一个新成员,具有独特的性质和多样的细胞功能,目前正在以稳步增长的速度进行研究,已经成为现在的研究热点。CircRNAs在多种肿瘤中的作用已被探索并逐渐得到证实,例如,在膀胱癌中的一项研究中心,一些异常表达的CircRNAs在癌症组织中被检测出来,后续观察到一个来自TCF25的CircRNA通过海绵吸附mir-103a-3p和miR-107促进膀胱癌细胞的增殖和迁移[14]。最近,来自MYLK的CircRNA被证明在膀胱癌中具有致癌作用,它与miR-29a结合,抑制了后者对其靶基因VEGFA的内源性抑制作用,进而导致上皮-间充质转化、血管生成和转移[15]。同样,在乳腺癌中,有研究表明来自ABCB10的CircRNA在乳腺癌中表达上调,体外敲除该CircRNA可抑制乳腺癌细胞的增殖并促进细胞凋亡[16]。此外,在结肠癌中,CIRS-7的高表达被证明与患者的生存不良相关[17]。在另一项研究中,通过RNA测序也发现一些CircRNAs在结直肠癌中显著下调,暗示这些分子可能与结直肠癌的发生发展相关[18]。通过分析胶质瘤和非肿瘤脑样本的RNA测序数据,发现了476个差异表达的CircRNAs。后续研究表明,一种源自VCAN基因的CircRNA被发现在少突胶质细胞瘤和胶质母细胞瘤中表达上调,该基因与胶质瘤的发生有关[19]。
虽然现在CircRNA在肿瘤中的相关研究已经成为热点,但是有关CircRNA在视网膜母细胞瘤中的研究报道不多。在本研究中,我们对CircAKT3在视网膜母细胞瘤中的表达水平以及功能进行了检测,证实了CircAKT3在视网膜母细胞瘤细胞中高表达,且其会促进肿瘤细胞增殖和抑制细胞凋亡。研究结果同CircAKT3在肺癌和胃癌中的报道一致,都是起到癌基因作用,促进肿瘤进展[12-13]。
研究表明,CircRNA具有miRNA的ceRNA 作用,CircRNA可通过海绵吸附miRNA来抑制miRNA的活性,并在调节基因转录和与蛋白质的结合中发挥作用[20]。例如,CircAmotl1可以通过海绵吸附miR-17-5p调节Dnmt3a和STAT3的表达来加速伤口的修复[20]。同样,Circ-0001564通过抑制miR-29c-3p作用来影响骨肉瘤的发展[21]。研究表明,CircRNA-100290在口腔鳞癌中可促进癌细胞体外增殖,后续的机制研究表明,CircRNA-100290与miR-29家族成员可直接结合并解除后者对于CDK6 的抑制,从而促进癌细胞的增殖[22]。此外,CircRNA-103809在结直肠癌组织中低表达,并与肿瘤组织的分期和淋巴结转移有关,机制研究结果表明,CircRNA-103809在结直肠癌中是通过作用于miR-532-3P/FOXO4轴进而参与大肠癌生物学功能的调节[23]。
关于CircAKT3,它已被证明可海绵吸附miR-516b-5p和miR-198,但其在视网膜母细胞瘤细胞中是否通过上述两个miRNAs发挥作用,需要进行下一步研究[12-13]。
本研究证实了CircAKT3在视网膜母细胞瘤中可促进细胞增殖和抑制细胞凋亡,虽然其具体作用机制还需要进一步证明,但它的发现也为视网膜母细胞瘤的治疗提供了新的思路和靶点。
