慢性自发性荨麻疹患者血清IL-17、IL-31和IL-33水平检测及临床意义*
2020-09-09孟祖东刘里云
赵 芳,王 玉,孟祖东,刘里云
1.锦州医科大学十堰市人民医院研究生培养基地(十堰442000);
2.湖北医药学院附属十堰市人民医院皮肤科(十堰442000)
慢性自发性荨麻疹(Chronic spontaneous urticaria,CSU)是临床上常见的、易诊难治的皮肤病,因其涉及许多复杂的机制,也被认为是一种致残性疾病[1],严重影响患者的情绪和生活质量。抗高亲和力IgE受体(抗IgE、抗fceri、抗tpo)的功能性自身抗体只涉及约三分之一的患者,提示其他循环介质如白细胞介素可能与CSU发病机制有关[2]。白细胞介素(Interleukin)具有功能复杂的特点,在免疫细胞成熟、增殖、活化及免疫调节等一系列过程中发挥着重要作用[3]。已有研究证实CSU发病大部分是Th1/Th2细胞免疫网络失衡所致,其中Th2细胞在免疫应答中占主导地位[4]。现阶段研究认为白细胞介素-17(Interleukin-17,IL-17)和Th2类细胞因子白细胞介素-31(Interleukin-31,IL-31)、白细胞介素-33(Interleukin-33,IL-33)与一些免疫反应密切相关,可能涉及到CSU的病理生理过程,它们的水平可能与CSU病情严重程度密切相关,并可能是CSU临床治疗反应的生物标记[5-7]。本研究对56例CSU患者血清的IL-17、IL-31和IL-33表达水平进行检测以探讨其临床意义。
对象与方法
1 研究对象 按纳入和排除标准选取2018年12月至2019年12月就诊于十堰市人民医院皮肤科门诊被确诊为CSU的患者为研究组(n=56)及同期健康体检者(无系统免疫性及过敏性疾病史)为对照组(n=30)。病例纳入标准:①符合《中国临床皮肤病学》第2版CSU临床诊断标准[8]:临床症状为反复发作且瘙痒的一过性风团 (持续时间<24 h),病程超过6周;②入院前24 h内处于发作状态(表现为风团或红斑伴瘙痒症状);③本研究经伦理委员会同意,患者家属及本人均知晓并自愿参加本次研究,并签署知情同意书。排除标准:①合并严重的脏器或其他系统疾病者;②1周内应用抗组胺药物、糖皮质激素或免疫抑制剂者;③皮肤划痕症、物理刺激引起的荨麻疹、胆碱能性荨麻疹、遗传血管水肿性和其他明确原因 (药物、感染和食物等) 引起荨麻疹的患者;④妊娠及哺乳期妇女;⑤不能配合完成评分和抽血者。
2 研究方法
2.1 主要试剂与仪器:本次研究选用全自动酶免分析仪 (由美国Molecular Devices公司提供的Spectre Max Plus 384型),与配套IL-17、IL-31和IL-33检测试剂盒。
2.2 标本的收集与处理:于清晨空腹时采集两组肘部静脉血3 ml,置入离心管内,静置30 min后3000 r/min离心10 min分离血清,随后提取血清装于EP管内,置入-80℃环境内保存以备进行IL-17、IL-31和IL-33水平的检测。
2.3 酶联免疫吸附法(ELISA法)检测血浆IL-17、IL-31和IL-33的浓度:严格依据试剂盒说明书的操作步骤进行ELISA法测定血清IL-17、IL-31和IL-33的浓度,此过程根据制造商的指导对样品进行批量测定分析,以尽量减少系统误差。
3 观察指标及判定标准
3.1 荨麻疹活动性评分 (Urticaria activity score,UAS)[8]:采用UAS7表统计患者连续7 d病情活动情况,包括风团数量和瘙痒程度2项:小于10个小风团 (直径≤3 cm) 为0分;10~50个小风团或少于10个大风团 (直径>3 cm) 为1分;多于50个小风团或10~50个大风团为2分;几乎全部皮肤受累为3分。瘙痒强度评分:无瘙痒为0分;轻度瘙痒但不引起情绪异常为1分;中度瘙痒、情绪烦躁但不影响生活与睡眠为2分;重度瘙痒,对生活与睡眠造成严重影响为3分。
3.2 CSU病情评估:依据上述荨麻疹活动性评分,每日UAS不超过6分,每周总分不超过42分,并根据EAACI/GA(2)LEN/EDF/WAO指南[9]评估CSU患者的平均活动评分,以评估疾病的严重程度(通常为7 d),每周UAS:0~14分(轻度)、15~28分(中度)和29~42分(重度);每周瘙痒强度分级:0~7分(轻度)、8~14(中度)和15~21(重度)。

结 果
1 研究组与正常对照组一般资料比较 研究组女性占60.71%,对照组女性占60.00%,两组性别、年龄及病程等对比,差异均无统计学意义(P>0.05),见表1。
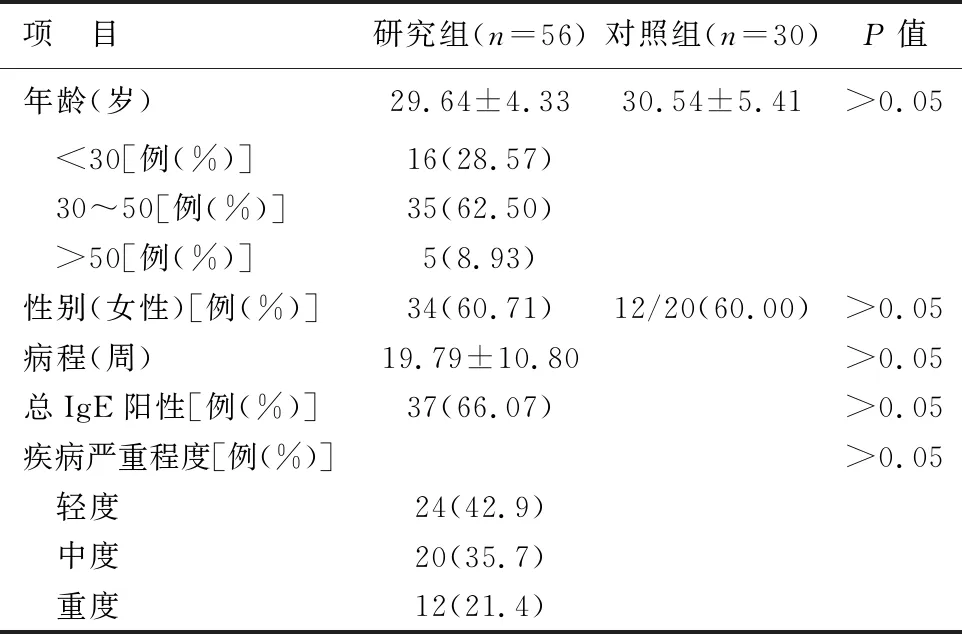
表1 研究组和对照组临床特征比较
2 研究组与对照组血清IL-17、IL-31和IL-33水平比较 研究组血清IL-17、IL-31和IL-33水平与对照组相比明显升高,差异有统计学意义(P<0.01),见表2。

表2 两组血清IL-17、IL-31和IL-33水平比较(ng/L)
3 CSU患者血清IL-17、IL-31和IL-33水平在不同严重程度组之间比较 在CSU活动性方面,重度组CSU患者血清IL-17水平明显高于中度和轻度组患者(t=2.117,3.061;P=0.043,0.004 );且不同严重程度组之间血清IL-17水平差异有统计学意义(F=6.568,P<0.05)。不同严重程度组之间血清IL-31水平差异无统计学意义(F=10.166,P>0.05);若仅从临床瘙痒程度分析,重度组CSU患者血清IL-31水平明显高于轻、中度组患者,差异有统计学意义(t=3.713,2.827;P=0.001,0.008),但轻中度组之间比较差异无统计学意义(t=-0.844,P=0.404)。见表3。血清IL-33水平在轻、中度组CSU患者之间比较差异无统计学意义(t=-1.027,P>0.05);但重度组CSU患者血清IL-33水平较轻、中度组均升高,差异有统计学意义(t=2.321,1.960;P=0.026,0.045);且不同严重程度组之间比较血清IL-33水平差异有统计学意义(F=5.107,P<0.05)。见表4。
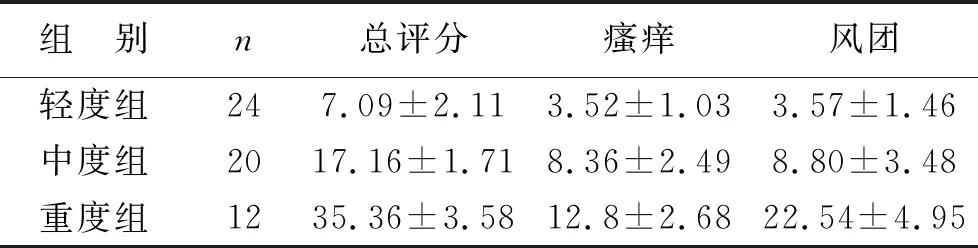
表3 CSU患者不同严重程度组临床活动性评分情况比较(分)

表4 CSU患者血清IL-17、IL-31和IL-33水平在不同严重程度组之间的比较(ng/L)
4 CSU患者血清IL-17、IL-31和IL-33水平之间的相关性分析 采用Spearman秩检验法评估CSU患者血清IL-17、IL-31和IL-33水平的相关性,结果显示,血清IL-17(r=0.301,P=0.024)和IL-31(r=0.035,P=0.043)都与IL-33水平显著相关;血清IL-17水平与IL-31水平无相关性(r=0.059,P>0.05)。
讨 论
慢性荨麻疹(Chronic urticaria,CU)是一种常见的、异质性的、衰弱性疾病[10]。CSU被定义为慢性荨麻疹和(或)血管性水肿与任何其他全身性疾病过程无关,也不是由物理因素诱导所致的CU,约占CU的70%~80%[11]。已有大量研究证实细胞因子及IgE表达水平在其发病机制中起核心作用[4],在目前研究基础上为了更好地认识细胞活素类因子在CSU免疫发病机制中的作用,进一步获得对该疾病发生、发展的充分理解,我们通过实验研究发现CSU患者血清IL-17、IL-31和IL-33水平显著升高,表明三者可能参与到CSU患者机体生理与病理反应,从而涉及到CSU的发病机制。
Th17细胞被报道能增强抗原对Th2细胞的诱导作用,进而促进Th2细胞介导的嗜酸性粒细胞的炎症反应而参与过敏性疾病的发生[12]。IL-17作为Th17细胞的核心因子,被认为与部分炎症性和自身免疫疾病密切相关,且通过增强Th2反应在CSU的发生中发挥一定作用[13]。本研究结果显示,与健康对照组相比较,CSU患者血清IL-17水平显著升高,且重度组患者血清IL-17水平明显高于轻、中度组。与我们研究结果一致的是,一些研究表明CSU患者血清IL-17水平高于对照组,且血清IL-17、IL-23、TNF-α水平与疾病的活动性有明显的正相关性[5]。另一研究报道,自体血清皮肤试验(ASST)阳性的CSU患者血清IL-17水平明显高于ASST阴性者,其循环中TNF-α、IL-1β和IL-6同时有所增加[14],这些促炎性细胞因子相应的被认为是由IL-17促发产生,它们彼此间功能性联系有助于CSU炎症过程的发展。
CSU是一种主要由肥大细胞引起的过敏性皮肤病,其瘙痒是除外风团和(或)血管性水肿外的关键症状。虽然组胺和神经肽被认为在许多自身免疫性皮肤病的瘙痒中起作用,但最近的证据表明,瘙痒原性细胞因子IL-31是瘙痒反应的主要驱动因素[15]。IL-31在瘙痒性皮肤病的重要作用已逐渐被认知,其过度表达与强烈的瘙痒行为、脱发和皮炎有关[16]。抗IL-31抗体已被证实能显著减轻特应性皮炎小鼠的痒感,且该作用近期在中重度特应性皮炎患者也已被证实[17]。有关瘙痒性疾病肥大细胞增多症[18]的一项研究表明,高水平的IL-31与患者疾病活动性有着直接的相关性。我们的研究结果表明CSU患者血清IL-31水平与健康对照组相比显著升高,与以往研究一致。但是,血清IL-31水平在自体血清皮肤试验(ASST)阳性的CSU患者和阴性患者之间无明显差异,也没有找到血清IL-31水平与疾病活动的相关性来支持以往的研究,但如果只考虑瘙痒症状,重度组CSU患者血清IL-31水平显著高于轻、中度组患者,伴剧烈瘙痒的CSU患者与瘙痒相对较轻但没有疾病活动的患者相比,表现出显著升高的血清IL-31水平,支持了高水平IL-31会导致CSU患者的瘙痒而不是疾病活动这样的观点,表明IL-31可能为CSU的致痒介质[19]。此外,相关研究表明IL-31除了具有致痒作用外,在支持Th2型免疫方面也有潜在的免疫调节作用,而Th2型免疫通常是IgE相关的自身免疫性疾病及过敏性皮肤病(如CSU)[19]。相应的是,CSU患者对奥马丽珠单抗的治疗反应最近被证明与降低血清IL-31水平有关[20],这表明IL-31可能是由血清IgE依赖机制调节的,并进一步突出了抗IL-31作为CSU的一种治疗方法,为临床缓解CSU瘙痒提供了新的思路。
IL-33越来越被被认为是一种Th2型启动细胞因子,它可以与细胞膜受体ST2结合,促进T细胞、肥大细胞及嗜酸性粒细胞等免疫细胞活化,从而激发或增强Th2的反应,在CSU中发挥炎性因子的作用[21]。本研究结果显示CSU患者血清IL-33水平明显升高,且重度组CSU患者血清IL-33水平显著高于轻、中度组。高水平IL-33可以诱导增加Th2型细胞因子如IL-5和IL-13等从Th2型细胞释放到体外,并提高血清IgE 和嗜酸性粒细胞水平从而参与CSU的发病机制[22]。在CSU患者皮肤活检中,已有研究证实了Th2型(IL-4和IL-5)细胞因子表达增加,提示通过先天性免疫机制释放的Th2型启动细胞因子(IL-33、IL-25和TSLP)可能在促进CSU炎性反应的发展中发挥一定作用[23]。与此相应,接受了两周抗组胺药物治疗的CSU患者血清IL-33水平明显降低[14],这些发现也可能对CSU临床治疗具有指导意义。
本研究发现CSU患者血清IL-33水平与IL-17和IL-31都相关。越来越多的研究提供了这些细胞因子在人类过敏性疾病中功能性联系的间接证据。Vocca[24]、Peng[25]等分别在过敏性气道疾病及变应性鼻炎的发展过程中,描述了IL-33/ST2轴与Th2/IL-31、Th17免疫反应有关。过敏性气道疾病患者血清IL-31和IL-33水平均与可溶性ST2水平呈正相关,这表明IL-33/ST2相互作用在促进过敏性疾病的Th2/IL-31免疫反应中发挥重要作用。与我们研究结果相应的是Nygaard[26]发现IL-33和IL-31血清表达水平在特应性皮炎患者有正相关性,作为Th2/IL-31免疫反应的生物标记,IL-33/ST2轴的激活是过敏性皮肤病免疫反应和表皮动态平衡的关键通路。另一方面,Gupta等[27]发现IL-17A通过EGFR、EPK、p38和 JAK/STAT1旁路在表皮中产生IL-33,这对IL-33的产生至关重要。CSU作为临床上常见的过敏性皮肤病,其血清IL-33水平受IL-17和IL-31等多种细胞因子相互作用的影响,进一步突出这些细胞因子间可能存在功能性联系,彼此间形成的复杂网络结构在疾病发展中的确切机制尚未明确,并需要进一步研究。
本研究的局限性是缺乏阳性对照组,因此,收集更多的患者并设计阳性对照组如作为炎症性、瘙痒性皮肤病的特应性皮炎或银屑病,进行进一步实验来研究不同的Th1、Th2和Th17细胞因子在CSU患者血清和皮肤中的表达,以证实并完善我们的研究结果是必要的。细胞因子间的功能性联系及其受体和信号通路的进一步研究有助于更好地理解疾病的发病机制,在不久的将来,影响它们的平衡可能有助于调节免疫系统的第一反应,以防止许多过敏及炎症相关疾病的发展,并可能促进新的治疗方法的进展。总之,我们的实验研究结果表明CSU患者发病机制可能与血清IL-17、IL-31和IL-33水平升高有关;同时发现血清IL-17、IL-33和IL-31表达水平分别与CSU疾病严重程度和瘙痒呈正相关,强调了这些细胞因子在常见炎症性、瘙痒性皮肤疾病发病机制中的功能性作用,进一步可以转化临床,为CSU患者临床病情评估及疗效监测提供必要的参考指标。
