miR-637调控RING1表达抑制口腔鳞癌Tac-8113细胞增殖实验研究*
2020-09-09莘晓陶
白 雪,张 斌,汪 潇,莘晓陶
锦州医科大学附属第一医院口腔科(锦州 121001)
口腔鳞癌是常见于口腔颌面部的一种恶性肿瘤,具有侵袭性强、易发生转移等特点,容易侵袭颅脑、上呼吸道等部位,严重影响人们生命健康。口腔鳞癌发病过程涉及多种癌基因的激活、抑癌基因失活及信号通路的异常改变[1-3]。随着肿瘤生物学的深入研究,采取靶向性调控肿瘤细胞的方法,将可能抑制肿瘤的复发转移、耐药,可能为肿瘤临床治疗开辟一种新的干预手段。因此,潜在靶点的选择,深入研究与肿瘤细胞相关的调控机制,为靶向治疗肿瘤开辟了一条新道路。近年来越来越多研究显示微小RNA(microRNA,miR)表达异常参与口腔鳞癌的发生发展过程[4]。研究显示,miR-637在胆管癌、胶质瘤等恶性肿瘤中表达异常[5-6],但其在口腔鳞癌中还未见研究,RING1是Polycomb家族(PCG)蛋白复合物(Polycomb repessive complex 1,PRC1)中主要成员,主要维持已处于阻抑状态的染色质的稳定性,在肿瘤发生过程中发挥重要作用[7-8],经miRdb生信网站预测,RING1与miR-637存在靶向关系。因此本研究重点探讨miR-637过表达对口腔鳞癌细胞增殖的影响,以及miR-637与RING1的关系,初步研究其发挥作用的分子机制。
材料与方法
1 实验材料 人口腔鳞癌细胞株Tca-8113,购自中国科学院典型培养物保藏委员会细胞库。miR-637 mimic及miR-637 NC购自厦门慧嘉生物科技有限公司。miR-637 mimics序列为5’-UUCAAGUAAUCCAGGAUAGGCU-3’,miR-637 NC序列为5’-UUCUCCGAACGUGUCACGUTT-3’。RPMI 1640培养基、10%胎牛血清、胰酶购自美国Sigma公司;实时荧光定量PCR(qRT-PCR)试剂盒(批号DRR041A)、反转录试剂盒(批号DRR047A)购自大连宝生物工程有限公司;CCK-8相关试剂购于美国GLPBIO公司;蛋白提取试剂盒、BCA试剂盒购自北京全式金生物公司;鼠抗人增殖细胞核抗原(PCNA)、RING1、GAPDH一抗及二抗(辣根过氧化物酶标记羊抗鼠IgG)购自美国Abcam公司;双荧光素酶报告检测试剂盒购自美国Promega公司;普通光学显微镜购自日本Olympus公司;荧光定量PCR仪、自动酶标仪(Elx800)购自美国Bio-Rad公司。
2 实验方法
2.1 细胞培养:Tca-8113细胞经常规复苏后,加入含10%胎牛血清的RPMI 1640培养基重悬细胞,并置于37℃、5% CO2培养箱中培养,待细胞融合至80%左右时胰酶消化传代。
2.2 细胞转染及转染效率检测:选取对数生长期的Tca-8113细胞,以2×105/孔密度接种于24孔板中,待细胞密度达50%~70%时,按照Lipofectamine 2000转染试剂盒说明说进行转染,每组设置6个复孔。试验分为三组:对照组,含10%FBS的RPMI 1640培养基;miR-637 NC组,转染空载体;miR-637 mimics组,转染miR-637 mimics。通过倒置荧光显微镜观测转染效率,转染后通过400 mg/L的G418筛选稳定细胞株,并以400 mg/L的G418维持培养。转染后48 h收集细胞供后续使用。
2.3 qRT-PCR检测miR-637表达情况:收集2.2中各组细胞,利用Trizol试剂盒抽提细胞总RNA,应用反转录试剂盒将1 μg RNA反转录为cDNA,反转录体系为10 μl(2 μl 5×Reaction mix,1 μl Random primer,0.5 μl逆转录酶,5 μl RNA样品),25 ℃、5 min,42 ℃、30 min,85 ℃、5 min灭活逆转录酶活性,用去离子水将cDNA稀释10倍后-20℃保存。以cDNA为模板进行qRT-PCR扩增。程序设定为:95 ℃预热3 min,95 ℃、30 s ,60 ℃、30 s,72 ℃、15 s,上述3步骤35次循环,72 ℃、5 min终止反应。miR-637以U6为内参基因,引物由生工生物工程(上海)股份有限公司合成,引物设计见表1。采用2-ΔΔCt算法计算miR-637相对表达量。

表1 qRT-PCR引物序列
2.4 CCK-8法检测Tac-8113细胞增殖情况:收集2.2中各组细胞,分别培养24、48、72、96 h,每组设6个复孔,加入10 μl CCK-8溶液,培养4 h后用酶联免疫检测仪测定各孔吸光值(OD值),以未接种细胞质加培养基孔的OD值为空白对照调零,并计算细胞增殖抑制率。细胞增殖抑制率=[1-处理组OD值/未处理组OD值]×100%。
2.5 平板克隆法检测细胞增殖情况:收集2.2中各组细胞,分别用0.25%胰酶消化并吹打成单个细胞,将细胞悬浮在含10%胎牛血清的DMEM培养基中备用,将细胞悬液作梯度倍数稀释,每组细胞以每皿50、100、200个细胞梯度分别接种在培养皿中,转动使细胞均匀分散,置于37℃、5%CO2饱和湿度的细胞培养箱中培养,当培养皿中出现肉眼可见克隆时终止培养,弃上清,加4%多聚甲醛固定15 min,去除固定液,加应用染色液20~30 min,流水缓慢洗去染色液,空气干燥。在显微镜(低倍镜)计数大于10个细胞的克隆数,计算克隆形成率。克隆形成率=(克隆数/接种细胞数)×100%。
2.6 双荧光素酶报告基因:收集2.1中对数期TCA-8113细胞,以2×104/孔密度接种于24孔板中,设置四组,每组6个复孔,24 h后分别转染Neg-miR 637(空载体)+野生型(WT)-RING1,Neg-miR 637(空载体)+突变型(MT)-RING1,miR 637+WT-RING1,miR 637+MT-RING1。24 h后按照双荧光素酶报告基因检测试剂盒说明书添加萤火虫和海参荧光素酶试剂上机检测。每孔的数值以萤火虫荧光活性/海参荧光活性显示,试验重复3次。
2.7 蛋白免疫印迹法检测ki67蛋白表达情况:收集2.2中各组细胞,加入RIPA裂解液,冰上静置,充分裂解后通过蛋白提取试剂盒提取总蛋白。使用BCA蛋白试剂盒测定细胞中总蛋白浓度。用10%SDS-PAGE分离蛋白,半干法转移至硝酸纤维素膜上,TBST清洗3次后,在室温下用5%脱脂牛奶封闭2 h,加入一抗,PCNA(1∶500)、RING1(1∶250),以GAPDH做为内参,24 h后吸取一抗,清洗硝酸纤维素膜后,加入相应二抗(辣根过氧化物酶标记的山羊抗兔1∶2000)37 ℃封闭2 h,洗膜后滴加ECL显色液,用凝胶成像系统获取蛋白条带图片,用Tanon 600图像分析系统拍照对蛋白质表达量进行定量分析。

结 果
1 转染效率检测 荧光显微镜下miR-637 NC组、miR-637 mimics组中细胞转染效率均达90%以上。qRT-PCR显示,与对照组相比,miR-637 NC组miR-637表达差异无统计学意义(P>0.05),miR-637 mimics组miR-637表达显著升高(P<0.05);与miR-637 NC组相比,miR-637 mimics组miR-637表达显著升高(P<0.05)。见图1、表2。

图1 荧光显微镜观察miR-637 NC组、miR-637 mimics组转染效率(×200)
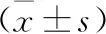
表2 各组miR-637表达水平比较
2 miR-637过表达对Tac-8113细胞增殖的影响 CCK-8实验显示,与对照组相比,miR-637 NC组各时间点OD值差异无统计学意义(P>0.05),miR-637 mimics组转染后48、72 、96 h后OD值显著降低(P<0.05);与miR-637 NC组相比,miR-637 mimics组转染后48 、72 、96 h后OD值显著降低(P<0.05)。见表3。
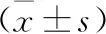
表3 各组OD值比较
3 平板克隆法 平板克隆法显示,与对照组相比,miR-637 NC组克隆形成率差异无统计学意义(P>0.05),miR-637 mimics组克隆形成率显著降低(P<0.05);与miR-637 NC组相比,miR-637 mimics组克隆形成率显著降低(P<0.05)。见图2、表4。
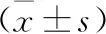
表4 各组克隆形成率比较
4 miR-637过表达对增殖相关蛋白表达的影响(抑制增殖) 蛋白免疫印迹法结果显示,与对照组相比,miR-637 NC组PCNA蛋白表达差异无统计学意义(P>0.05),miR-637 mimics组PCNA蛋白表达显著降低(P<0.05);与miR-637 NC组相比,miR-637 mimics组PCNA蛋白表达显著降低(P<0.05)。见图3、表5。
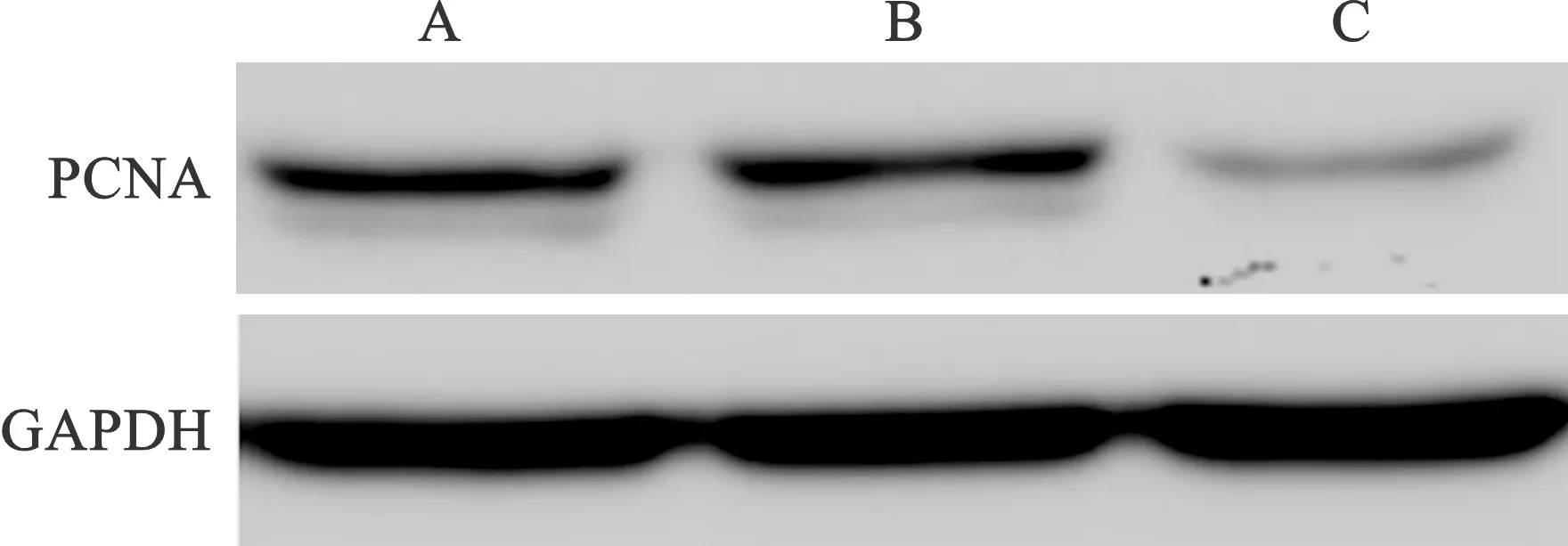
A:对照组;B:miR-637 NC组;C:miR-637 mimics组
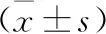
表5 各组增殖相关蛋白PCNA表达水平比较
5 双荧光素酶检测miR-637与RING1关系 双荧光素酶报告基因检测显示共同转染miR-637+WT-RING1后,荧光素酶活性表达受抑制,而转染Neg-miR637+WT-RING1、Neg-miR637+MT-RING1、miR-637+MT-RING1组荧光素酶活性无明显变化,见图4。

图4 双荧光素酶报告基因分析结果
6 miR-637过表达对RING1蛋白表达影响 蛋白免疫印迹法结果显示,与对照组相比,miR-637 NC组RING1蛋白表达差异无统计学意义(P>0.05),miR-637 mimics组RING1蛋白显著降低(P>0.05);与miR-637 NC组相比,miR-637 mimics组RING1蛋白显著降低(P>0.05)。见图5、表6。

A:对照组;B:miR-637 NC组;C:miR-637 mimics组
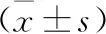
表6 各组RING1蛋白表达水平比较
讨 论
miR-637是近年来新发现的miRNA[9-10],Zhang等[11]研究表明miR-637在结直肠癌中表达显著下调,miR-637过表达抑制结直肠癌细胞增殖。Yi等[12]研究显示,miR-637在胶质瘤中低表达,其异常表达并可参与肿瘤细胞增殖及侵袭等生物学过程。研究显示,miR-637在卵巢癌中表达显著下调,过表达可抑制卵巢癌上皮间充质转化过程[13]。但miR-637在口腔鳞癌中报道较少,本研究前期试验显示miR-637在口腔鳞癌中低表达,猜测miR-637在口腔鳞癌中可能与其他恶性肿瘤中发挥相同作用。为此我们选取口腔鳞癌细胞Tac-8113进行转染使miR-637过表达,探讨miR-637在Tac-8113发挥作用。倒置荧光显微镜镜下观察空载体及miR-637 mimics转染进入细胞内的效率高,qRT-PCR检测发现miR-637 mimics组miR-637表达水平显著高于miR-637 NC组与对照组,提示转染成功可供后续使用。CCK8试验显示显示miR-637 mimics组Tac-8113细胞增殖抑制率显著高于对照组、miR-637 NC组,提示miR-637过表达可降低Tac-8113细胞增殖,此外平板克隆试验也验证了这一猜测,但miR-637抑制Tac-8113细胞增殖相关机制尚不清楚。PCNA是DNA 复制所必需的一种聚合酶的附属蛋白,对细胞由G1期向S期过渡起调节作用,其含量的变化与细胞增殖的进程同步,可作为衡量细胞增殖状态的客观指标之一,一般认为,肿瘤分化程度越低,其增殖能力越强,PCNA表达也越高[14-15]。本研究中,口腔鳞癌细胞Tac-8113经miR-637 mimics转染后PCNA蛋白水平显著下调,提示miR-637可能在Tac-8113细胞中发挥抑癌基因作用。
经生物信息学软件miRdb预测,RING1是miR-637的候选靶基因,PCG基因是进化中较为保守的转录抑制因子,通过形成蛋白复合物PRC1、PRC2发挥沉默靶向基因的作用,RING1是PRC2中的主要成员[16],研究表明,RING1在乳腺癌中高表达,发挥癌基因作用[17]。本研究双荧光素酶报告基因系统显示,通过转染miR-637 mimics与WT-RING1后,双荧光素酶活性明显抑制,提示miR-637对Tac-8113细胞中RING1基因发挥抑制作用。此外WB结果显示,miR-637 mimics组RING1蛋白表达显著低于miR-637 NC组与对照组,进一步验证了二者的靶向关系。猜测miR-637可能通过靶向RING1表达参口腔鳞癌Tac-8113细胞增殖过程,miR-637可能成为治疗口腔鳞癌的潜在靶点,但其内在分子机制尚不明确,有待进一步研究。
综上所述,miR-637可能通过下调RING1表达抑制口腔鳞癌Tac-8113细胞增殖,可为口腔鳞癌分子诊断及靶向治疗提供理论基础。但本研究也存在一定不足,miR-637调控RING1相关通路有待进一步研究。
