多重引物HRMA对成骨不全患者COL1A1/2基因突变的筛查与分析
2020-09-07杨立张天可周怀蔚鞠明艳白雪李克秋任秀智李光
杨立 张天可 周怀蔚 鞠明艳 白雪 李克秋 任秀智 李光*
1.天津医科大学基础医学院,天津 300070
2.天津市天津医院检验科,天津 300211
3.天津市武清区人民医院骨科三病区,天津 301700
成骨不全(osteogenesis imperfecta,OI)也称为脆性骨病,是一种常染色体显性遗传病,主要由于COL1A1或COL1A2两个基因发生突变所致,分别编码了I型胶原的pro-α1和pro-α2两条肽链,一旦发生基因突变,将导致I型胶原合成不足及其三螺旋胶原结构发生异常[1-2]。成骨不全在儿童中发病率接近于1/10 000,临床表现多种多样,很难确定基因型和表现型之间的关系[3-4]。90%患病家系的基因突变类型为点突变(包括无义突变、错义突变等),并且随机发生于COL1A1的51个外显子和COL1A2的52个外显子上,每个外显子之间的突变类型又有所不同,使得突变区域结构相当庞大复杂;此外,COL1A1和COL1A2基因片段较长,外显子众多,没有突变热点,尤其是COL1A2较易形成发卡结构,这些都为突变筛查增加了难度[5-6]。当前对于成骨不全基因突变筛查,传统PCR操作简便、结果可靠;传统高分辨熔解曲线分析(high resolution melting analysis,HRMA)灵敏度高、特异性强、简单快速、高效经济,检测不受碱基位点的局限,可同时对等位基因的变化进行识别;qPCR-HRMA同时具备两者的特点。上述筛查方法均只针对于单对引物,对于拥有众多外显子的COL1A1和COL1A2,筛查起来工作量较大,耗时、耗材、耗费用。
本研究在传统HRMA的基础上,建立了多重引物HRMA的方法,将满足一定条件的两对引物进行配对,并与单个样本DNA混合作为扩增体系,可同时对COL1A1或COL1A2的两个外显子进行突变筛查。并用该方法成功筛查了两例OI患者在COL1A1、COL1A2上的突变。多重引物HRMA不仅可以用于OI患者基因突变的筛查,也为其他遗传病致病基因的筛查提供了新思路。这类遗传病往往都是常染色体显性遗传病,致病基因上具有较多的外显子,而且没有突变热点。
1 资料与方法
1.1 一般资料
两例OI患者和50例正常对照样本均来源于天津市天津医院,50例正常对照样本与鞠明艳等[7]的研究一致,包括28名男性,22名女性,平均年龄9岁,均为汉族人群,个体间无血缘关系。收集OI患者的相关临床资料,包括家族史、骨骼畸形情况、巩膜颜色和X线表现等等。实验项目在OI患者或其家属签订知情同意书下进行,并且得到了天津市天津医院伦理委员会批准。
先证者1:男,9岁,患者身高120 cm,蓝色巩膜,牙质发育不全,牙齿稀疏,共发生15次骨折,初次骨折为出生时,四肢向外弯曲畸形。X线检查显示:左胫腓骨骨密度降低,骨干变细,骨皮质变薄,骨干向胫侧弯曲变形;左股骨下端断裂,髓内钉固定,临床诊断为Ⅳ型OI。先证者父亲,身高165 cm,在2岁时曾发生骨折,浅蓝色巩膜。先证者哥哥,身高145 cm,初次骨折发生于出生时,蓝色巩膜,龋齿。先证者母亲无相关症状。
先证者2:女,11岁,患者身高150 cm,浅蓝色巩膜,牙质发育不全,牙齿稀疏,鸡胸,共发生20次骨折,初次骨折为出生后35 d,四肢向外弯曲畸形。X线片显示:左胫腓骨骨密度减低,骨皮质变薄,骨小梁稀疏,胫腓骨骨干弯曲变形;左右股骨骨密度降低,向外侧弯曲变形,骨干变细,骨皮质变薄;右股骨骨干、左右胫骨髓内钉固定,骨干变细,骨密度减低,临床诊断为Ⅳ型OI。先证者母亲,身高153 cm,在3岁时曾骨折两次,均为小腿骨折,浅蓝色巩膜。先证者父亲无相关症状。两个先证者的X线片、家系调查及临床表现分别见图1~图3、表1。
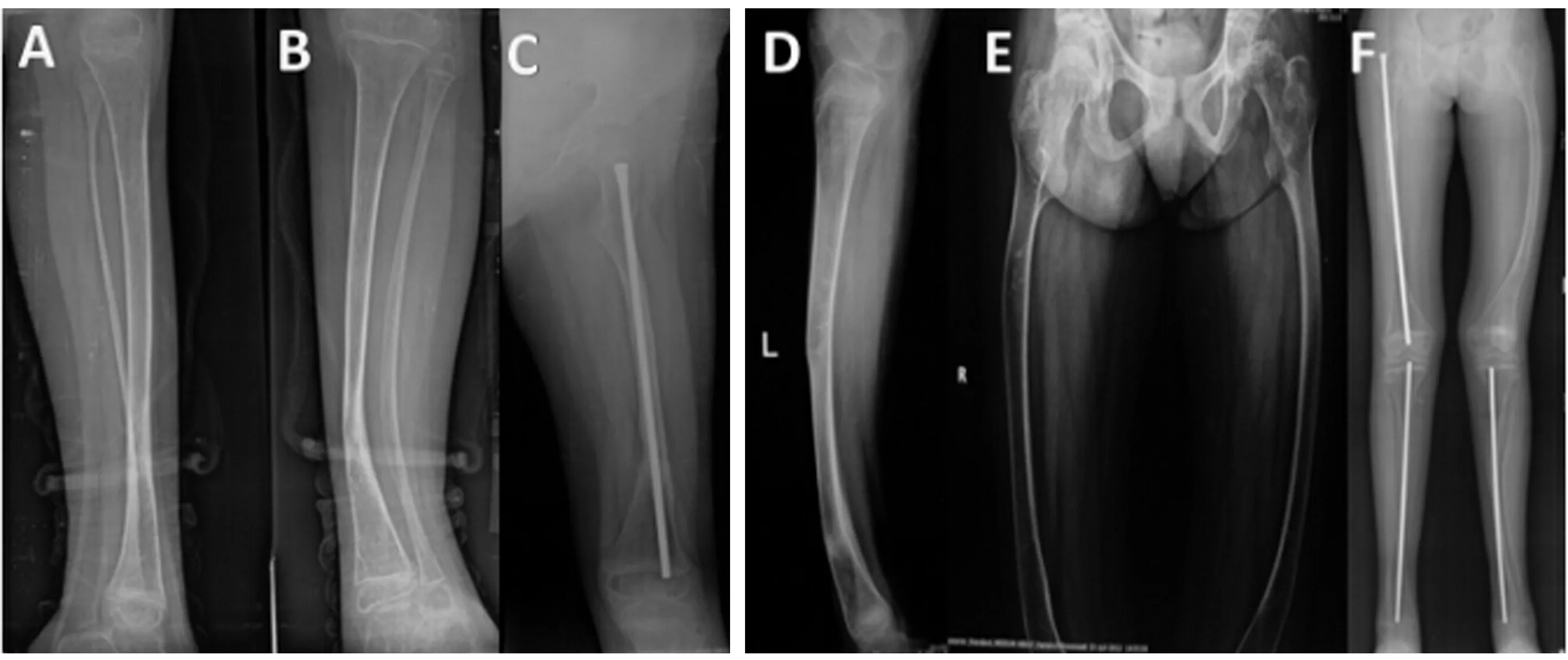
图1 先证者X线片注:A、B、C X线片取自于先证者1;D、E、F X线片取自于先证者2。Fig.1 X-rays of the probands
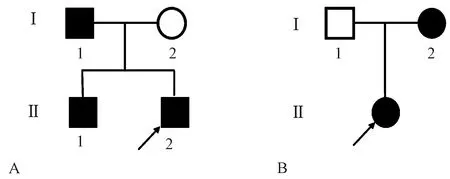
图2 家系图注:家系1(A)的Ⅱ-2是先证者1;家系2(B)的子代是先证者2;□○:分别为正常男性、正常女性;■●:分别为患病男性、患病女性。Fig.2 Pedigree chart

图3 先证者临床表现注:A、B照片取自于先证者1;C、D照片取自于先证者2。两例先证者均伴有牙质发育不全和蓝色巩膜。Fig.3 Clinical manifestations of the probands

表1 两例患者的临床表现Table 1 Clinical presents of the two proband
1.2 方法
1.2.1基因组DNA制备:采集两例成骨不全患者和50例正常对照人群的静脉血,EDTA抗凝,-80 ℃进行保存。采用美国AxyPrep血基因组试剂盒提取血液中的样本DNA,使用NanoDrop 2000核酸定量分析仪(德国)检测DNA的浓度和纯度,保证浓度为(20±2)ng/μL,置于-80 ℃保存备用。
1.2.2引物设计及合成:采用Primer 5.0和Oligo 7.0对COL1A1的51个外显子和COL1A2的52个外显子进行引物的双重分析与设计,使得引物满足条件:退火温度60 ℃~64 ℃;长度20~24 bp;产物长度80~280 bp;|ΔG|、|ΔC|<4.5 kcal/mol;将每个外显子对应的扩增产物Tm值差距为3 ℃~4 ℃,且验证后无相互干扰的两对引物设为一组,与单份样本DNA混合作为扩增体系。对于结构较长的外显子可以设计两对或多对引物。引物由上海生工合成。
1.2.3多重引物HRMA筛查分析基因突变:采用QIAGEN(德国)Type-it HRM PCR Kit 400试剂盒。采用基因公司(美国)illumina Eco荧光定量PCR仪,反应条件为:95 ℃预变性5 min;95 ℃变性10 s、退火温度(60 ℃或64 ℃)30 s、72 ℃延伸10 s,40个循环。采用48孔板(美国illumina公司)进行产物合成,每孔总反应体积为10 μL:PCR Master Mix 5 μL,两对引物各自的上下游引物初始浓度均为10 μmol/L 0.35 μL,样本DNA为20 ng/μL 1.5 μL,无酶水(北京TIANGEN公司)2.1 μL。HRMA分析条件为95 ℃预处理15 s,熔解温度为65 ℃~95 ℃,上升速度为0.1 ℃/s,每升高1 ℃采集10次荧光信号,Eco V3.0软件进行熔解曲线分析,每个样本重复4~5次。
1.2.4长片段引物扩增与测序:经过多重引物HRMA筛查分析后,HRMA熔解曲线提示存在突变,针对存在突变的基因序列自行设计长片段引物,并与单份正常对照DNA样本混合作为扩增体系,进行PCR合成。采用Applied Biosystems公司梯度PCR仪(美国),由上海生工完成测序。
1.2.5产物序列分析:运用GENEBLAST及GENETOOL等软件分析测序结果,与GENEBANK上的正常序列进行比对分析,确定突变位点和变化的氨基酸编码序列,在人类突变数据库中(https://www.le.ac.uk/genetics/collagen/)查找为新的突变类型。
2 结果
2.1 正常对照下多重引物HRMA分析
COL1A1和COL1A2两个基因共103对引物,将满足一定条件的引物两两配对与单份正常对照样本DNA混合,作为扩增体系进行HRMA合成,成功配对78个即39对外显子。另外的25个外显子未配对成功,成功率为75.73%。其中两对引物HRMA熔解曲线见图4。
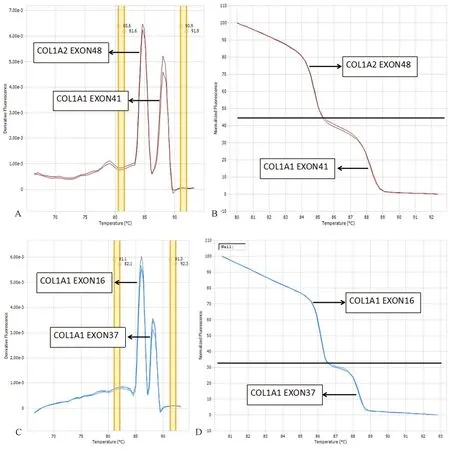
图4 正常对照HRMA熔解曲线注:A:COL1A2 exon48、COL1A1 exon41配对合成派生曲线,Tm分别为84.7 ℃、88.1 ℃;B:COL1A2 exon48、COL1A1 exon41配对合成标准曲线,据此判断有无异常;C:COL1A1 exon16、COL1A1 exon37配对合成派生曲线,Tm分别为86.1 ℃、88.2 ℃;D:COL1A1 exon16、COL1A1 exon37配对合成标准曲线,据此判断有无异常。Fig.4 High resolution melting analysis curves
2.2 多重引物HRMA筛查2例患者基因突变
提取两例先证者的DNA样本,与成功配对的引物混合,作为扩增体系进行HRMA合成。在正常对照下,两例先证者HRMA熔解曲线见图5。

图5 患者HRMA熔解曲线注:A:患者1,WT为野生型,MT为突变型,多重HRMA标准曲线在COL1A1第41外显子上存在异常,并且提示杂合突变;B:患者1,WT为野生型,传统HRMA标准曲线在COL1A1第41外显子上存在杂合突变;C:患者2,WT为野生型,MT为突变型,多重HRMA标准曲线在COL1A1第16外显子上有异常,并且提示杂合突变:D:患者2,WT为野生型,传统HRMA标准曲线在COL1A1第16外显子上存在杂合突变。Fig.5 High resolution melting analysis curves
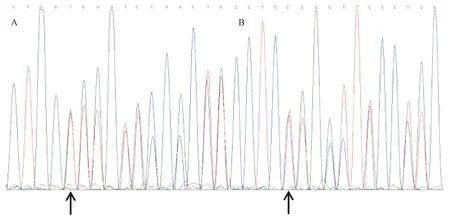
图6 先证者测序图注:箭头所示分别是先证者1(A)和先证者2(B)的突变位点,两者的突变类型均是杂合突变。Fig.6 Sequence curves of the proband
2.3 测序结果
采用Applied Biosystems公司梯度PCR仪(美国)进行合成,由上海生工完成测序。测序结果为:先证者1在COL1A1第41外显子上c.2877delT杂合突变,即cDNA2 877位碱基T缺失,编码的缬氨酸变成色氨酸;先证者2在COL1A1第16外显子上c.1028delC杂合突变,即cDNA1 028位碱基C缺失,编码的脯氨酸变成亮氨酸,与传统HRMA筛查结果一致。测序图见图6。两种突变类型在人类突变数据库(https://www.le.ac.uk/genetics/collagen/)中均未见报道。
3 讨论
OI主要由于COL1A1和COL1A2发生基因突变导致,这两个基因分别编码I型胶原蛋白的pro-α1、pro-α2链。两种肽链因基因突变,表达出现异常,导致骨组织质或量的改变,从而引起成骨不全。OI基因突变形式多样,种类繁多,随机发生在103个外显子上,每个OI家系又有自己的“特异突变”[8],使得传统PCR筛查突变的工作量大、难度高、成本高、效率低。Gentile等[9]在2012年首次引入qPCR-HRMA筛查OI基因突变,该方法基于扩增产物之间Tm的微小差异及熔解曲线差异来进行突变筛查,具有快速、高效、成本低等优点。2015年,Wang等[10]运用qPCR-HRMA筛查出两例新的OI突变,再一次证实qPCR-HRMA方法对于筛查OI基因的有效性。本项目研究在qPCR-HRMA的基础上进行了创新,建立了多重引物HRMA,将103个外显子所对应的引物按照一定的条件进行两两配对,进一步降低了OI突变筛查的工作量,使之减半,提高了效率,降低了成本。并用该方法筛查了两例OI患者基因突变。
在正常对照样本下,成功配对了39对即78个外显子,成功率为75.73%,剩余未配对成功的COL1A1有3个外显子,COL1A2有22个外显子,大部分存在于COL1A2。究其原因,可能由于COL1A2上碱基A/T的比例明显高于G/C的比例,碱基序列的Tm高于COL1A1的碱基序列;另外,由于COL1A2序列较长,结构较为复杂,设计的引物之间较易形成发卡结构,序列之间较易相互干扰。多重引物HRMA熔解曲线相对于单对引物而言有两个高峰,即代表着两对引物配对成功,可以说成功配对几对引物就会出现几个高峰。这也是该方法的创新之处。
在家系1中,筛查发现先证者1的HRMA标准曲线在COL1A1 41外显子上存在差异,患者Tm大约为87.5 ℃,正常对照Tm约为88.1 ℃,两者相差0.6 ℃;HRMA标准曲线提示杂合突变;测序结果为c.2877delT杂合突变,即cDNA2 877位碱基T缺失,编码的缬氨酸变成色氨酸。该家系中存在着一个令人关注的现象:先证者的突变位点存在于一段致死基因序列上(869位碱基到1001位碱基之间),该序列与配体结合区域MLBR2密切相关[11]。在家系2中,筛查发现先证者2的HRMA标准曲线在COL1A1 16外显子上存在差异,患者Tm大约为86 ℃,正常对照Tm约为86.3 ℃,两者相差0.3 ℃;HRMA标准曲线提示杂合突变;测序结果为c.1028delC杂合突变,即cDNA1028位碱基C缺失,编码的脯氨酸变成亮氨酸。多重引物HRMA熔解曲线显示只有在有突变的外显子上才存在异常,若配对的两对外显子上都有突变,则同时存在异常,与传统HRMA熔解曲线的筛查结果无明显差异,同时也证实了多重引物HRMA具有一定的可行性。
环境、遗传及个体差异等共同影响使得OI的基因型与表型的关系还不是很清楚[12],临床诊断也仅仅依赖患者的临床特征和影像学特征[13]。尽管如此,OI分型仍以Sillence分型为主,根据临床表现和组织病理学主要分为Ⅰ~Ⅳ型,病情严重程度也有所不同。所以OI表现型和基因型的关系仍是亟待研究的问题。相反地,对于OI患者突变筛查的方法却不断在创新,从传统PCR到qPCR-HRMA,再到本文中建立的多重引物HRMA,其筛查效率不断提高,工作量不断减少,筛查成本也在不断降低。目前,多重引物HRMA筛查OI患者突变仅适用于两对引物配对的情况,三对及三对以上配对还有待研究。另外,文章中仅涉及到两例OI患者的突变筛查,数量有限,多重引物HRMA的有效性和可行性还需要大量样本进行分析。尽管如此,两例患者的筛查结果作为新的突变位点,为科研工作者对其他OI患者的研究提供了有用的信息。
总之,多重引物HRMA为成骨不全以及其他遗传病的突变筛查提供了新的思路。这类遗传病往往是常染色体显性遗传病,基因上存在较多外显子,而且不具有突变热点。
