细胞衰老在老年骨质疏松症防治中的研究进展
2020-09-07倪乙洪王正博刘权毛莉陈璐璐
倪乙洪 王正博 刘权 毛莉 陈璐璐*
1.南京医科大学,江苏 南京211166
2.南京市第一医院,江苏 南京210006
3.淮安市第一人民医院,江苏 淮安223300
随着人口老龄化的发展和骨质疏松性骨折发病率的增加,人们迫切需要找到治疗骨质疏松症的新方法。老年骨质疏松症通常与多种衰老相关疾病共存,因为这些疾病具有相同的潜在危险因素即衰老,所以人们越来越关注“老年学假说”,认为控制衰老机制会延迟多种慢性疾病的出现或抑制其严重程度。因此,越来越多的学者开始关注细胞衰老在年龄相关的骨丢失中的作用。本文将对清除衰老细胞防治老年骨质疏松症的研究进展作一综述。
1 骨质疏松症的现状
骨质疏松症是老年人常见病之一,以骨量减少、骨微结构破坏为主要特点,是一种常见的全身性骨骼疾病,导致骨脆性增加和易发骨折。近年来,随着全球人口老龄化的发展,骨质疏松症和骨折的发病率逐年增加,成为了一个重要的公共卫生问题。统计数据表明,2010年我国骨质疏松性骨折患者达233万,其中有36万例髋部骨折,111万例椎体骨折,其他骨质疏松性骨折占86万,医疗支出将近64亿元。2016年,中国60岁以上的老年人中,36%患有骨质疏松,其中男性占23%,女性占49%,这充分说明骨质疏松症已成为公众高度关注的卫生健康问题之一[1-2]。据估计,至2050年,我国骨质疏松症患病人数将达599万,其相应的医疗支出高达1 745亿人民币[3]。骨质疏松症的发生发展是多方面因素共同作用的结果,而年龄增长是主要因素之一。
与许多其他慢性病一样,过去30年来,在开发防治骨质疏松症的新药方面取得了巨大进展,包括选择性雌激素受体调节剂(雷洛昔芬)、双膦酸盐(阿仑膦酸盐、利塞膦酸盐、伊班膦酸盐和唑来膦酸)、核因子κ-B配体受体激活剂(RANKL)的单克隆抗体(狄诺塞麦)以及甲状旁腺素(PTH)/ PTH相关肽(PTHrP)类似物(特立帕肽、阿巴帕肽)[4-9]。然而,尽管取得了这些重大进展,但仍有许多骨质疏松症患者目前还没有接受适当的治疗。最近的一项研究[10]发现,在22 598例患者中,髋部骨折后双膦酸盐的使用率从2004年的15%下降到2013年的3%。
骨质疏松症患者无法得到适当的治疗有很多原因,例如出现双膦酸盐使用相关的副作用,如颌骨坏死(ONJ)和非典型股骨骨折(AFFs)[11]。另外,骨质疏松症在老年人中不是孤立存在,相反,它与许多其他老年疾病共存,包括心血管疾病、糖尿病、类风湿关节炎、骨关节炎等[12]。反过来,这又导致了骨质疏松症治疗出现新的障碍。首先,医生经常直接对症处理紧迫的疾病(例如高血压或糖尿病);其次,老年患者越来越多地负担多药的问题,调查发现36%~39%的老年人服用5种甚至更多的处方药;加上非处方药物的使用,服用5种或更多药物的老年人增加到67%[13]。从根本上说,目前所有针对年龄相关的慢性病的治疗策略都是疾病特异性的,每种药物都只针对某一种疾病,例如,降低心血管风险的他汀类药物,治疗糖尿病的抗高血糖药物,抗骨质疏松症的双膦酸盐等,不可避免地出现使用多种药物后的不良反应。
2 细胞衰老与机体衰老
越来越多的研究[14]认为衰老是动脉粥样硬化、肿瘤、神经退行性疾病、糖尿病和骨质疏松等年龄相关慢性疾病的最大风险因素,因此产生了“老年学假设”,认为抑制衰老可延迟多种慢性疾病的出现或减缓其严重程度。常见的抗衰老机制包括DNA损伤修复、维持蛋白稳态、抑制细胞衰老等[15]。美国的一项临床试验研究[16]发现,随机给予3 000余名65~79岁的受试者安慰剂或二甲双胍治疗后,发现二甲双胍不仅能够减少31%Ⅱ型糖尿病的发病率,而且还能改善心血管疾病的风险和亚临床型动脉粥样硬化,这与二甲双胍激活AMPK有关。
细胞衰老是生物体中普遍存在的一种不可逆的生长停滞现象,是机体衰老的基础。作为预防或治疗多种慢性疾病的潜在靶标,近年来受到相当大的关注。细胞衰老最初是由Hayflick和Moorhead在实验中发现的,即体外培养的非转化细胞经过一定次数的分裂后,能够自发的停止增殖现象,然而,它们在衰老状态下仍然可以存活数周[17]。影响细胞衰老的因素众多,端粒缩短、DNA损伤、原癌基因激活、活性氧积累等均可激活p53-p21和p16-Rb介导的信号通路。衰老的细胞表现为体积增大,衰老相关的β-半乳糖苷酶(SA-β-gal)、p16Ink4a、层粘连蛋白B1和γH2AX表达增加。衰老的细胞还伴有与细胞内信号转导相关的40多种因子表达上调,包括促炎症因子、趋化因子、生长因子、基质金属蛋白酶等,称为衰老相关分泌表型(SASP)。SASP使衰老细胞通过自分泌或旁分泌作用影响其周围的细胞,最终可以导致多种疾病的发生。在灵长类动物中约10%~15%的SASP就足以引起组织功能障碍[18]。2011年Kirkland / van Deursen实验室研究人员通过对转基因小鼠的研究[19]发现,清除表达p16Ink4a的衰老细胞能够有效的改善脂肪、骨骼肌等的衰老表型,延缓机体的衰老从而延长寿命。Kirkland实验室接下来测试了46种药物,其中包括达沙替尼和槲皮素,当组合使用时,在体外和体内清除衰老细胞方面均显示出特别的功效,老年小鼠的心脏功能和颈动脉血管反应性得到明显改善。之后,更多针对BcL-2家族的药物(navitoclax,ABT263,A1331852,A1155463)、p53 / p21(FOXO4相关肽,荜茇酰胺)、HSP-90(格尔德霉素)和PI3K / AKT(非瑟酮)等被证明具有抗衰老的作用[20]。因此,清除衰老细胞可能是未来治疗老龄化疾病、延长人类寿命的新的靶标。
3 细胞衰老和骨骼衰老
鉴于大量的证据证明了细胞衰老在许多与年龄相关的疾病中的关键作用,越来越多的研究人员开始关注细胞衰老在骨骼衰老中的作用。为了鉴定机体衰老时骨微环境的变化,研究人员从6月龄、24月龄小鼠骨中分离出不同细胞群进行体外培养并检测细胞衰老和SASP的变化。结果发现,与6月龄小鼠相比,24月龄小鼠体外培养物中的p16Ink4a的表达量随着B细胞、T细胞、骨细胞、成骨细胞祖细胞及成骨细胞的老化而显著升高。体内实验也发现24月龄小鼠骨皮质中骨细胞的衰老明显增加;对36个SASP基因进行检测发现,随着B细胞、T细胞、成骨细胞祖细胞、成骨细胞的衰老而SASP的表达并无显著改变,而在骨细胞和骨髓细胞中分别有23个、26个SASP基因显著上调[21]。对年轻(平均年龄27岁)和老年(平均年龄78岁)健康女性志愿者(每组n=10)的骨组织检查发现,与年轻女性相比,老年女性骨组织中的p16Ink4a和p21表达显著增加并有12个SASP基因显著上调,与动物研究结果一致。这些结果表明,随着机体衰老,骨微环境中细胞衰老增加。Piemontese等[22]也证实了骨细胞衰老随着机体衰老而增加。与7月龄年轻小鼠相比,21月龄老年小鼠的骨细胞中γH2AX、p16Ink4a和几种SASP标志物的表达均明显增加。这些改变还与骨细胞RANKL表达增加和皮质孔隙变化相关,表明骨细胞衰老可能加速了皮质骨的骨吸收。吡咯喹啉苯醌(PQQ)和N-乙酰-L-半胱氨酸(NAC)被认为是强大的抗氧化剂,可以清除ROS,保护线粒体活性使其免遭氧化损伤的作用。有研究[23-24]发现PQQ或NAC均可通过抑制氧化应激增加,减少骨细胞衰老和SASP的产生,抑制骨吸收从而纠正小鼠的骨丢失。对骨祖细胞的研究[25]发现,随着年龄的增长,骨祖细胞减少,并且其减少与γH2AX和其他衰老标志物的表达增加有关。
为了进一步明确细胞衰老与年龄相关的骨丢失之间的关系,研究者使用三种不同的策略来靶向抑制衰老细胞并评估它们对老年小鼠骨骼的影响:利用INK-ATTAC转基因小鼠、给予达沙替尼或槲皮素、使用JAK 1/2抑制剂(JAKi)抑制衰老细胞及SASP的产生[19,26-29]。通过上述三种干预措施对已确定骨质流失的20~22月龄的老年小鼠进行治疗,结果显示,2~4个月后骨小梁和皮质骨的骨量和骨微结构均显著改善。研究结果还发现,衰老细胞的积累需要时间,间歇性的抑制衰老对骨骼健康最有益。
研究人员进一步揭示了通过靶向抑制衰老骨细胞从而抗骨质疏松症的机制,在小梁骨中,骨小梁的骨量和骨微结构的改善与抑制骨吸收、维持骨形成有关;而在皮质骨中,骨皮质厚度增加与骨吸收减少和骨形成增加有关。体外研究证明衰老细胞的条件培养基抑制成骨细胞矿化和促进破骨细胞存活,导致破骨细胞生成增加。而目前临床使用的抗骨质疏松药物虽然可以抑制骨吸收但始终伴有骨形成减少的副作用[30](图1 A)。相比之下,使用抗衰老药物抑制细胞衰老后骨吸收减少、骨形成增加(皮质骨)或维持(骨小梁),从而有效地治疗骨质疏松(图1B)。这一结果表明,与传统的抗骨吸收方法相比,通过抑制细胞衰老抗骨质疏松的方法对骨骼产生更持久的有益作用,但仍需要进一步的研究来佐证。
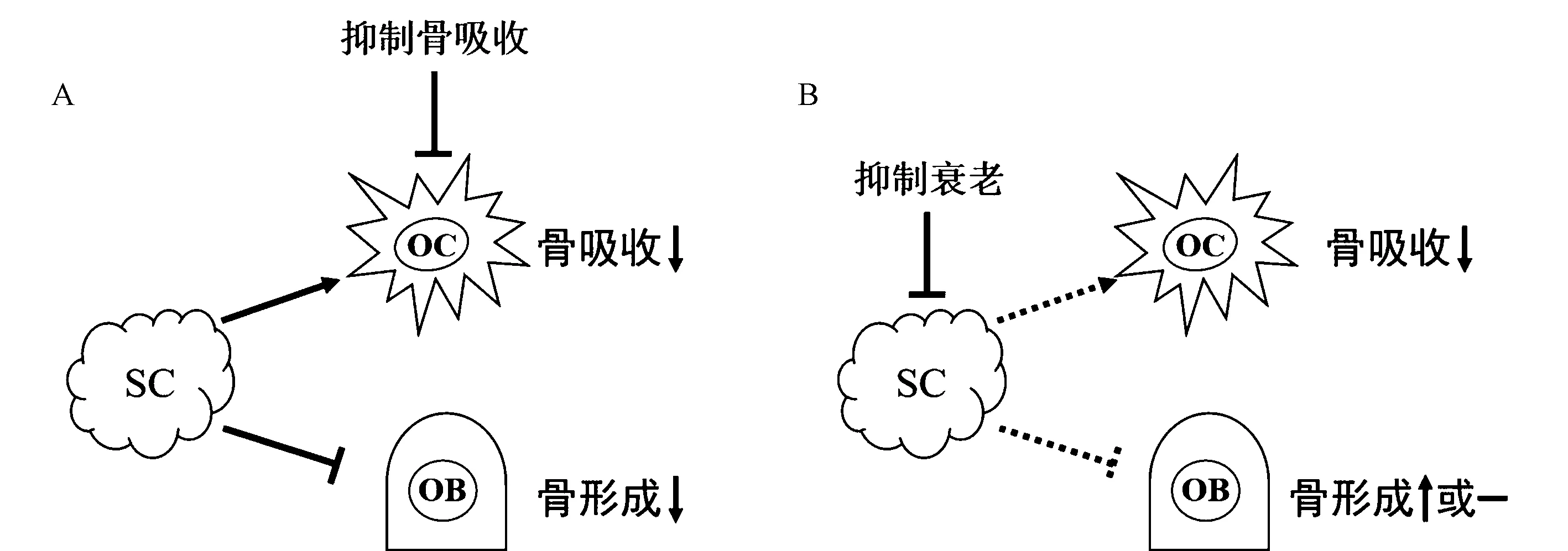
图1 抑制骨吸收、清除衰老细胞对骨代谢的影响 A:抑制骨吸收对骨代谢的影响;B:清除衰老细胞对骨代谢的影响。Fig.1 The effects of anti-resorptive and senolytic therapies on bone metabolism
在“老年学假说”的背景下,对基本衰老机制的操纵可延迟多种慢性疾病的出现或抑制其严重程度,因此将靶向抑制衰老细胞的骨骼效应放在其他衰老相关疾病的背景下显得尤为重要。已有证据[28,31-33]表明,消除衰老细胞或抑制SASP的产生有改善心脏和血管舒缩功能,减少主动脉钙化和斑块不稳定,改善胰岛素敏感性等作用。由于衰老细胞的表达随着年龄的增长而增加,通过各种方法靶向抑制细胞衰老可以调节基本衰老机制,并通过药物改变许多年龄相关疾病的病程[14]。在骨质疏松症领域,因使用odanacatib(组织蛋白酶K抑制剂)会导致卒中风险的增加以及romosozumab(骨硬化蛋白抑制剂)导致患心血管疾病的潜在风险增加,研究人员对开发新的抗骨质疏松症药物的兴趣明显下降[34-36]。然而,将骨质疏松症与多种其他衰老相关疾病共同治疗可能为新药开发提供新的希望。
4 小结与展望
虽然越来越多的证据表明减少衰老细胞或抑制其SASP可预防甚至逆转衰老病症,但这些方法的使用仍存在重要问题。如前所述,衰老很可能演变为一种抗癌机制,其中致癌性损伤的细胞被重定向到衰老、生长停滞的表型而不是不受控制的增殖和癌症。因此,抑制细胞衰老可能会增加肿瘤发生。然而,由于间歇性给予抗衰老药物有一定的效果,因此可通过这些药物周期性地减少衰老细胞而不是完全阻止其产生。
有研究[37]表明细胞衰老在伤口愈合中发挥作用,在此期间,衰老的成纤维细胞和内皮细胞在皮肤伤口愈合过程中出现,并通过分泌PDGF-AA促进愈合。同样,通过抗衰老药物间歇性减少衰老细胞是否会对伤口愈合或其他形式的组织修复产生负面影响仍需要进一步研究。
在动物模型(例如转基因INK-ATTAC小鼠)中,特异性表达高水平p16Ink4a的衰老细胞被消除会导致潜在的风险,即通过遗传手段可能具有不良影响,因此并不能应用于人类。相反,抗衰老药物靶向抑制衰老细胞并不是特异性清除p16Ink4a或其他单一调节基因,从而减少不良影响的产生。
虽然细胞衰老与肿瘤发生、组织修复和靶向特定途径相关的问题需要更多更仔细的评估,但已有抗衰老药物进入了早期临床试验,并且鉴于细胞衰老在年龄相关疾病中的作用,这些试验的研究在未来几年可能会不断增长。
靶向抑制细胞衰老代表了一种新的治疗策略,用于预防甚至逆转与年龄相关的骨质疏松症并同时治疗多种其他衰老相关的疾病。这种方法并不专注于骨骼,而是针对基本的机体老化机制。如果在临床研究中能得到与临床前研究一致的结果,或许能够改善老龄化人口的健康状况。
