3D打印聚己内酯/氧化铜支架促成骨及抗菌性能的体外研究
2020-09-07赵双谢凯郭煜谭嘉吴钧翔杨阳子王磊姜闻博郝永强
赵双 谢凯 郭煜 谭嘉 吴钧翔 杨阳子 王磊 姜闻博 郝永强
骨缺损修复一直是临床的重大挑战,目前常用的移植骨或填充材料面临来源有限、与缺损部位不匹配、成骨活性低以及感染风险等问题。理想的骨修复材料应具有个性化设计的外形,并且可以降低细菌感染的风险[1-2]。随着骨组织工程技术和3D打印技术的发展,研发兼具个性化外观和生物功能的骨修复支架成为新的研究热点。
聚己内酯(PCL)作为人工高分子材料,因具有良好的生物相容性和可降解性,已被广泛应用于骨组织工程领域[3]。但是,单纯PCL表面疏水且生物学活性不足,难以满足骨植入需求[4]。因此,有必要对PCL进行改性,赋予其生物学功能。
铜是细胞生长的必需微量元素,作为一种辅助因子或活化剂参与细胞代谢的许多方面,具有多种生物学功能,尤其在骨形成和抗菌等方面具有独特作用[5-6]。混铜或铜涂层材料虽有良好的成骨性和抗菌性,但可能导致大量Cu2+或微小铜颗粒释放,在局部引起严重而持久的异物反应[7]。因此,将铜的氧化物混入复合材料中,是研究和利用铜的生物学功能的重要方式。
本研究拟通过熔融共混法将0%、5%、10%的CuO粉末混入PCL基材中,用熔融沉积方法(FDM)3D打印方式制作个性化多孔支架,初步探索PCL/CuO复合材料的促成骨和抗菌性能,为含铜骨修复支架的研究和临床应用提供依据。
1 材料和方法
1.1 试剂和仪器
PCL(无锡沙欣纳新材料科技有限公司),CuO粉末、茜素红染色试剂盒(美国Sigma公司),磷酸盐缓冲液、α-基础培养基、胎牛血清(美国Gibco公司),成骨诱导培养液(美国Cyagen公司),碱性磷酸酶(ALP)活性检测试剂盒(上海碧云天生物技术有限公司),ALP染色试剂盒(上海虹桥医用试剂实验研究所),CCK-8试剂盒(日本Dojindo公司),PCR相关试剂盒(日本TaKaRa公司),细菌活死染色试剂盒(美国Invitrogen公司),划痕实验培养皿插件(德国Ibidi公司)。
混料机XSS-300转矩流变仪(上海科创色谱仪器有限公司),FDM打印机(杭州捷诺飞生物科技股份有限公司),PCR仪(美国Thermo Fisher公司),酶标仪(美国Bio-Tek公司),光学显微镜(日本Olympus公司),荧光显微镜(德国Leica公司),ICP离子浓度检测仪(美国Agilent公司)。
1.2 PCL/CuO复合材料及支架制备
通过混料机将0%、5%、10%的CuO分别与PCL充分混合后制备PCL/CuO复合材料(PCL、PCL/5%CuO和PCL/10%CuO),根据计算机辅助设计软件设计的支架规格(圆片状,直径8 mm,高度1.5 mm,丝径300 μm,丝距400 μm,夹角60 °),使用FDM打印机制备多孔支架(图1)。打印机的具体参数:温度90 ℃,气压0.6 MPa,速度6~8 mm/s。

a-c:设计图;d:PCL;e:PCL/5%CuO;f:PCL/10%CuOa-c: schematic diagrams; d: PCL; e: PCL/5%CuO; f: PCL/10%CuO图1 支架设计和实物Fig. 1 Schematic diagrams and photographs of the different scaffolds
1.3 浸提液制备及Cu2+释放实验
将经环氧乙烷灭菌后的PCL、PCL/5%CuO、PCL/10%CuO多孔支架依据ISO 10993-12标准按0.1 g/mL的比例浸泡于含10%胎牛血清的α-MEM培养基,置入37 ℃、含5%CO2细胞培养箱中,72 h后收集浸提液于4 ℃冰箱中保存备用。将支架按上述比例浸泡于培养基并置于培养箱中,在第1、2、3、5、7、14天时用ICP离子浓度检测仪检测培养基中累积的Cu2+浓度。
1.4 细胞实验
1.4.1细胞黏附实验
将环氧乙烷灭菌后的3组支架各3枚置于24孔板中,每孔加入1 mL的大鼠骨髓间充质干细胞(rBMSCs)悬液,细胞密度为1×105个/mL。支架和细胞共培养1、3、5、7 h 后,用PBS冲洗后将支架移入新的24孔板中,每孔中加入500 μL的CCK-8工作液(培养基与CCK-8液体积比为10∶1),培养箱中孵育1 h后,每孔吸取100 μL工作液至相应的96孔板内,用酶标仪检测各组在波长450 nm处的光密度值(OD值)。
1.4.2细胞增殖实验
将rBMSCs以5 000个/孔接种于96孔板,置入细胞培养箱中,待细胞完全贴壁后,将各孔的细胞培养液更换为相应的浸提液,继续培养。在第1、3、5、7天时采用CCK-8法检测各组在波长450 nm处的OD值,方法同1.4.1。
1.4.3细胞成骨分化实验
将rBMSCs与各组浸提液共培养并进行成骨诱导,通过ALP染色及活性测定、茜素红染色及半定量分析、PCR检测成骨相关基因的表达情况,探讨PCL组、PCL/5%CuO组、PCL/10%CuO组支架浸提液对rBMSCs成骨分化的影响。向各组浸提液中加入100 μg/mL链霉素、100 IU/mL青霉素、0.1 μmol/L地塞米松、10 mmol/L β-甘油磷酸钠和50 μg/mL抗坏血酸盐,组成各组成骨诱导培养液。
1.4.3.1ALP染色及活性测定
将rBMSCs按5×104个/L的数量接种于24孔板中,细胞生长融合达80%后更换成骨诱导培养液继续培养。培养7 d后行ALP染色并拍照,按试剂盒说明书行ALP活性定量分析[8]。
1.4.3.2茜素红染色及半定量分析
参照1.4.3.1方法对rBMSCs进行成骨诱导培养,21 d后行茜素红染色并拍照,孔板内的固态颗粒即矿化结节,再加入氯化十六烷基吡啶溶液充分溶解该结节,检测各孔在波长620 nm处的OD值[8]。
1.4.3.3PCR检测成骨相关基因表达
将rBMSCs按2×105个/L的数量接种于6孔板中,rBMSCs成骨诱导方法同1.4.3.1。培养第7天时,用Takara试剂盒提取各孔总RNA,按照试剂盒行逆转录PCR分析。检测的成骨相关基因为Ⅰ型胶原(Col-1)、ALP、Runt相关转录因子2(Runx2)、骨桥蛋白(OPN)[8],GAPDH设为内参(表1)。

表1 PCR引物序列Table 1 PCR primer sequence
1.4.4细胞迁移实验
将70 μL的rBMSCs悬液加入Ibidi培养插件内,细胞接种密度为3×105个/mL,镜下观察细胞已经全部贴壁后,超净台中小心移除插件,再用显微镜检查“划痕”,初始的划痕宽度为500 μm。加入1 mL对应的浸提液继续培养6 h,4%多聚甲醛固定,PBS清洗后镜下观察迁移效果并拍照,使用Image-Pro Plus 6.0软件测量宽度。
1.5 抗菌实验
1.5.1耐甲氧西林金黄色葡萄球菌(MRSA)菌液的制备
取MRSA的新鲜培养物于大豆胰蛋白胨肉汤培养基(TSB)中,37 ℃培养过夜后,得到细菌原液,再用各组支架浸提液稀释至1×106CFU/mL的细菌悬液备用,单纯TSB设为对照(TSB组)。
1.5.2浸提液抑菌实验
将细菌悬液按每孔100 μL接种于96孔板内,TSB组为对照组,每组3孔,置于细菌培养箱中,于1、2、3、4、5、6、9、12 h后用酶标仪检测各孔在波长600 nm处的OD值。
1.5.3抗生物膜形成实验
将细菌悬液按每孔500 μL接种于24孔板内,TSB组为对照组,每组3孔,置于细菌培养箱中,于1、3、6 h后行细菌活死细胞染色,荧光显微镜下观察细菌生物膜形成情况[9]。
1.6 统计学方法
所有实验数据均使用GraphPad Prism 8及SPSS 25.0软件进行统计学分析,采用t检验和单因素方差分析进行组间比较,P<0.05表示差异有统计学意义。
2 结果
2.1 Cu2+释放实验
根据支架材料在完全培养基内模拟体内环境所进行的释放实验,随着浸泡时间延长,PCL/5%CuO组、PCL/10%CuO组复合材料均可缓慢释放Cu2+(图2)。

图2 支架体外降解:不同时间点的累积Cu2+浓度Fig. 2 In vitro degradation of scaffolds: cumulative Cu2+ concentrations at different time points
2.2 细胞实验
2.2.1细胞黏附实验
通过CCK-8法评估rBMSCs在不同时间点与支架的黏附情况。结果(图3a)显示,在早期(5 h以内),各组OD值均有升高趋势,但各组间差异无统计学意义(P>0.05)。在7 h时,相较于PCL组,PCL/5%CuO组和PCL/10%CuO组细胞黏附增加(P<0.05),但两组间无统计学差异(P>0.05)。
2.2.2细胞增殖实验
通过CCK-8法评估rBMSCs在各组浸提液里的增殖情况。结果(图3b)显示,培养3 d时,PCL/5%CuO组和PCL/10%CuO组的OD值均较PCL组升高(P<0.05),但PCL/5%CuO组和PCL/10%CuO组的OD值之间无统计学差异(P>0.05)。培养7 d时,PCL/10%CuO组OD值较其他两组高(P<0.05)。
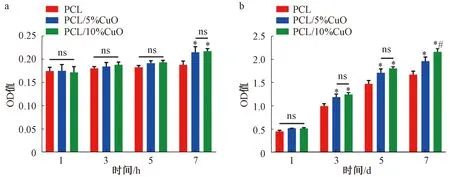
*: 与PCL组相比,P<0.05; #: 与PCL/5%CuO组相比,P<0.05;ns:P>0.05*: compared with PCL group, P<0.05; #: compared with PCL/5%CuO group, P<0.05;ns: P>0.05图3 CCK-8法检测rBMSCs的黏附(a)和增殖(b)Fig. 3 Cell adhesion (a) and proliferation (b) of rBMSCs detected by CCK-8
2.2.3细胞成骨分化实验
2.2.3.1ALP染色及活性测定
浸提液成骨诱导培养7 d时,PCL/5%CuO组和PCL/10%CuO组ALP染色均显著强于PCL组,且PCL/10%CuO组强于PCL/5%CuO组(图4a)。ALP活性测试表明,PCL/5%CuO组和PCL/10%CuO组ALP活性明显高于PCL组(P<0.05),PCL/10%CuO组高于PCL/5%CuO组(P<0.05,图4b)。
2.2.3.2茜素红染色及半定量分析
浸提液成骨诱导培养21 d时,PCL/5%CuO组和PCL/10%CuO组茜素红染色均显著强于PCL组,且PCL/10%CuO组强于PCL/5%CuO组(图5a)。钙结节半定量分析表明,PCL/5%CuO组和PCL/10%CuO组OD值均明显高于PCL组(P<0.05),PCL/10%CuO组高于PCL/5%CuO组(P<0.05,图5b)。

*: 与PCL组相比,P<0.05; #: 与PCL/5%CuO组相比,P<0.05*: compared with PCL group, P<0.05; #: compared with PCL/5%CuO group, P<0.05图4 ALP染色(a)及定量分析(b)Fig. 4 ALP staining (a) and quantitative analysis (b)
2.2.3.3PCR检测结果
使用PCR对rBMSCs成骨分化相关基因表达进行检测。如图6所示,与PCL组相比,PCL/5%CuO组和PCL/10%CuO组浸提液的Col-1、ALP、Runx2和OPN的mRNA表达水平均有显著提高(P<0.05),且PCL/10%CuO组Col-1表达水平高于PCL/5%CuO组(P<0.05)。
2.2.4细胞迁移实验
如图7、8所示,rBMSCs与各组支架浸提液培养6 h以后,相比PCL组,PCL/5%CuO组和PCL/10%CuO组迁移宽度均变小(P<0.05),但PCL/5%CuO 组和PCL/10%CuO组间无统计学差异(P>0.05)。
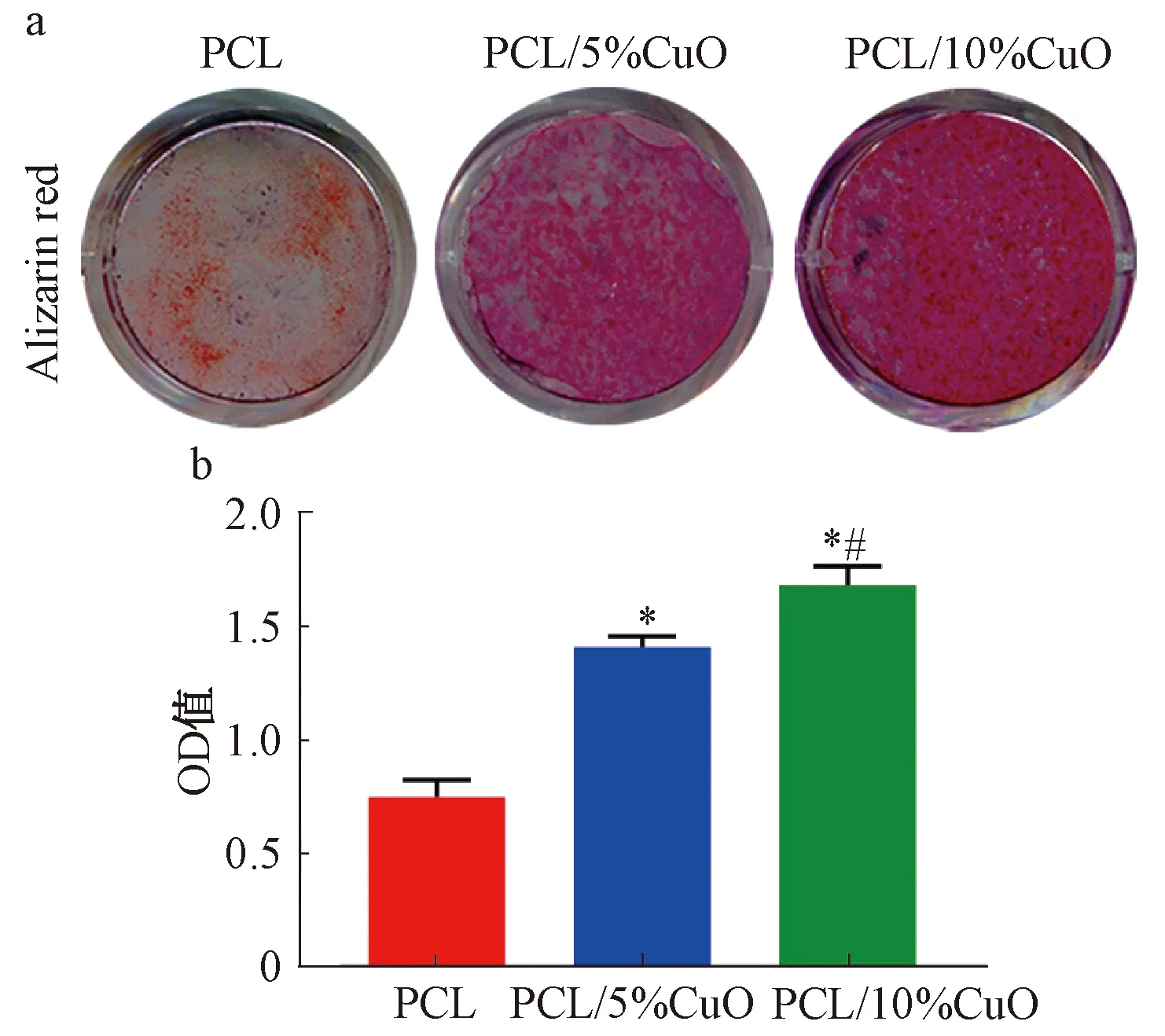
*: 与PCL组相比,P<0.05; #: 与PCL/5%CuO组相比,P<0.05*: compared with PCL group, P<0.05; #: compared with PCL/5%CuO group, P<0.05图5 茜素红染色(a)及半定量分析(b)Fig. 5 Alizarin red staining (a) and semi-quantitative analysis (b)
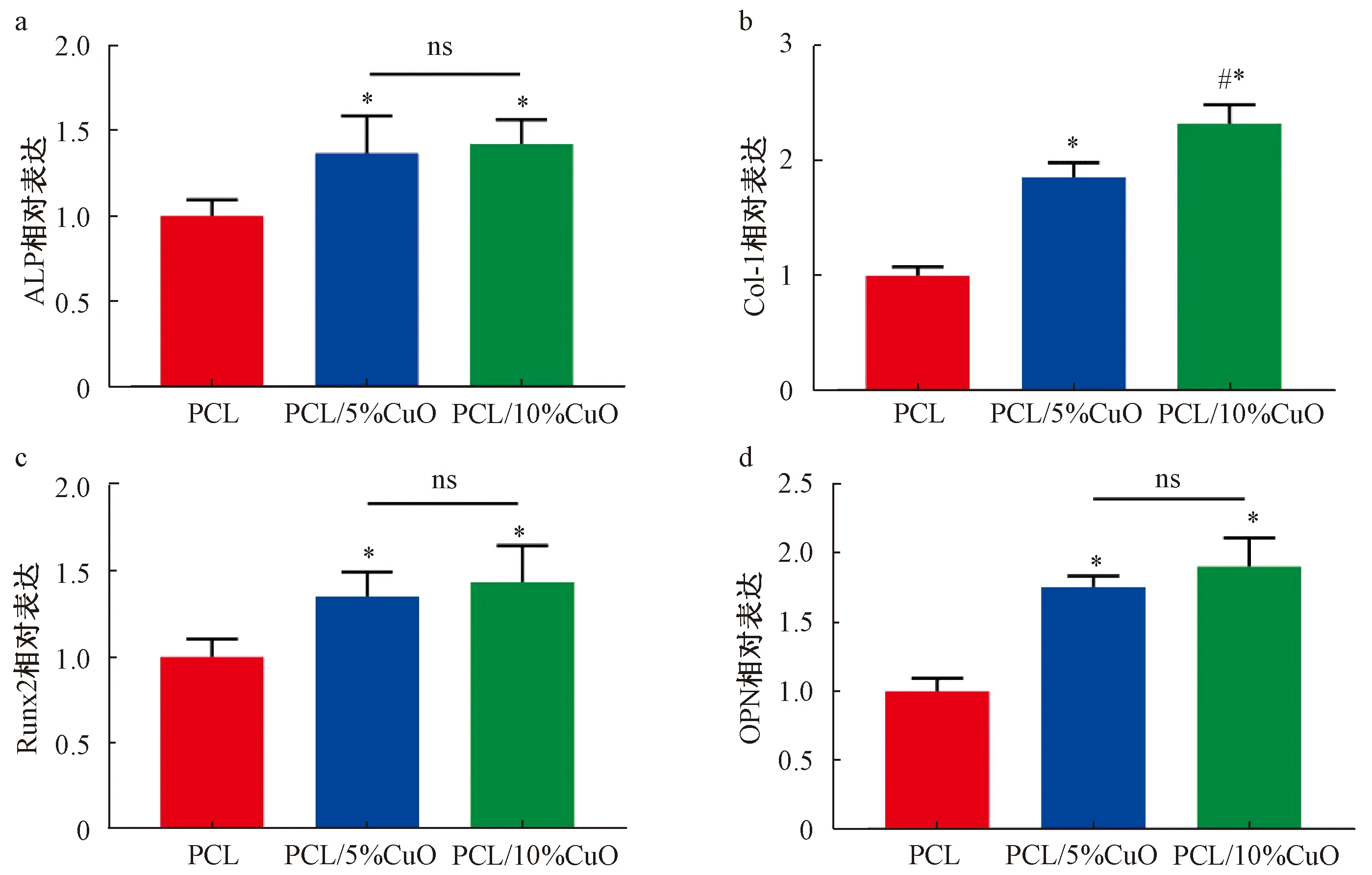
*: 与PCL组相比,P<0.05; #: 与PCL/5%CuO组相比,P<0.05; ns:P>0.05*: compared with PCL group, P<0.05; #: compared with PCL/5%CuO group, P<0.05; ns:P>0.05图6 成骨相关基因ALP(a)、C01-1(b)、Runx2(c)和OPN(d)的表达Fig. 6 Expression of osteogenic related genes:ALP(a)、C01-1(b)、Runx2(c)和OPN(d)

a:初始宽度;b:PCL组;c:PCL/5%CuO组;d:PCL/10%CuO组a: initial width; b: PCL group; c: PCL/5%CuO group;d: PCL/10%CuO group图7 rBMSCs与浸提液共培养6 h后的迁移宽度(标尺:200 μm)Fig. 7 Migration width of rBMSCs after co-culture with extracts for 6 hours (scale bar: 200 μm)

*: 与PCL组相比,P<0.05;ns:P>0.05*: compared with PCL group, P<0.05;ns:P>0.05图8 rBMSCs与浸提液共培养6 h后的迁移宽度分析Fig. 8 Quantitative analysis of rBMSCs migration after co-culture with extracts for 6 hours
2.3 细菌实验
2.3.1浸提液抑菌实验
如图9所示,在4 h内,各组间的细菌活性无明显差异(P>0.05),从5 h开始,PCL/5%CuO组和PCL/10%CuO组浸提内的OD值明显低于PCL组和TSB组(P<0.05)。

图9 浸提液抑菌实验Fig. 9 Antibacterial experiment of extracts
2.3.2抗细菌生物膜形成实验
培养1 h后,TSB组和PCL组已经有细菌黏附,但PCL/5%CuO组和PCL/10%CuO组几乎没有细菌黏附。6 h后,PCL/5%CuO组和PCL/10%CuO组有较多细菌生长,但未形成细菌生物膜,而TSB组和PCL组已形成致密的细菌生物膜(图10)。
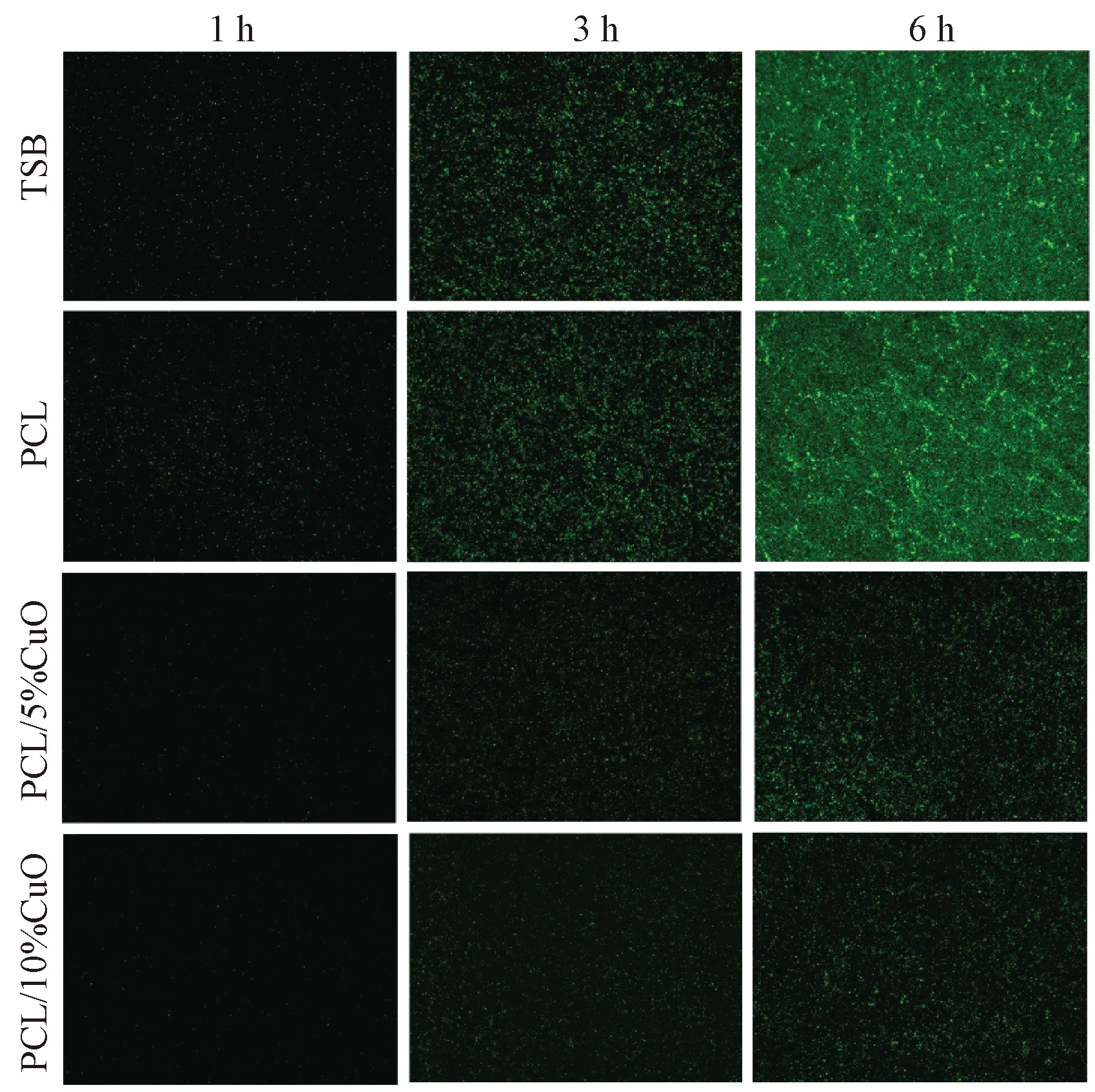
图10 抗细菌生物膜形成实验Fig. 10 Photographs of antibacterial biofilm formation
3 讨论
创伤、感染、肿瘤、先天性疾病等造成的骨缺损或损伤,是临床面对的巨大挑战之一。目前,骨缺损的修复方法主要有两大类:骨移植和骨移植替代材料。骨移植包括自体骨移植、同种异体骨移植和异种异体骨移植等,这些方法存在供骨量有限、传播传染性疾病和引起免疫排斥反应等潜在危险。骨移植替代材料中生物陶瓷材料降解过快、早期无法承重,植入部位易塌陷;医用金属材料则缺乏必要的生物降解性和生物活性,且弹性模量远高于人骨,易产生应力遮挡效应,引发植入物周围骨吸收、萎缩等风险。
近年来,骨组织工程和3D打印技术发展迅速,通过对材料进行改性,可研发兼具可降解性和生物活性的骨修复支架。因此,我们通过FDM技术制备了具有良好生物学性能的PCL/CuO多孔支架。Cu2+释放实验表明,PCL/CuO支架材料可以稳定释放Cu2+。研究发现,Cu2+可促进rBMSCs的增殖,还可增强其成骨分化[10-11]。本研究结果显示,rBMSCs在PCL/5%CuO和PCL/10%CuO组有更多的黏附和增殖。在早期成骨阶段,PCL/5%CuO和PCL/10%CuO组ALP染色明显强于PCL组,ALP活性定量显示,PCL/10%CuO组>PCL/5%CuO组>PCL组。在成骨晚期阶段,茜素红的染色结果与ALP染色一致,PCL/5%CuO和PCL/10%CuO组茜素红染色更深,钙结节数量更多,且PCL/10%CuO组有更强的促成骨性能,提示浸提液中较高浓度的Cu2+可以持续促进rBMSCs的成骨分化。PCR检测结果表明,PCL/5%CuO和PCL/10%CuO组成骨相关基因Col-1、ALP、Runx2、OPN的表达均明显升高。Li等[12]认为,Cu2+可以激活rBMSCs缺氧诱导因子(HIF-1)信号通路,促进rBMSCs的增殖和成骨分化。但是,Cu2+对rBMSCs的具体生物学机制还有待进一步研究。
铜是参与调节细胞迁移的相关生物酶的辅助因子,对细胞的迁移有一定的影响[13-14]。促进rBMSCs迁移是复合材料生物细胞学活性的重要特征,迁移到骨缺损部位的rBMSCs能够促进骨缺损修复。因此,细胞在材料表面及周围的迁移情况在一定程度上体现了该材料的促进骨缺损修复的能力。实验中,我们用支架浸提液与rBMSCs共培养6 h后发现,PCL/CuO组的划痕距离明显缩小,表明支架浸提液中的Cu2+可以促进rBMSCs的迁移。
铜还具有良好的抗菌作用,可有效抑制包括耐MRSA在内的革兰阳性细菌[15]。相对于银、铝、锌等离子,Cu2+在抗菌与生物相容性之间可以达到完美的平衡[16]。Cu2+作为一种广谱抗菌剂,其抗菌机制包括破坏细菌DNA、裂解细菌胞膜和诱导蛋白质变性[17-19]。实验中,我们用支架浸提液与MRSA共培养,通过检测OD值及细菌活死染色,发现PCL/5%CuO和PCL/10%CuO组支架可以有效抑制MRSA繁殖和细菌生物膜形成,显示了良好的抗菌性能,在预防植入物感染方面有潜在作用。
综上所述,FDM技术制备的PCL/CuO多孔骨修复支架在体外研究中有效地促进了rBMSCs的增殖、成骨分化和迁移,显著抑制了MRSA的繁殖和细菌生物膜形成,其中PCL/10%CuO组具有最佳的促成骨性能与抗菌性能,有望为骨缺损修复的体内研究和临床应用提供新的思路。
