携带IL-2/NK4双基因减毒沙门氏菌TPIN的遗传稳定性研究
2020-09-07蒋如如哈小琴
蒋如如, 魏 静, 李 欣, 哈小琴*
(1.甘肃中医药大学 临床医学院,甘肃 兰州 730030;2.人民解放军联勤保障部队 第九四〇医院检验科,甘肃 兰州 730050;3.甘肃省干细胞与基因药物重点实验室,甘肃 兰州 730050)
自1990年开始,细菌治疗的临床前研究取得了很大的进展[1]。减毒沙门氏菌作为目前FDA批准的可用于疫苗生产的工程菌,是肿瘤靶向领域中研究最广泛的细菌。研究表明,与正常靶器官相比,减毒沙门氏菌在肿瘤组织中优先定殖,肿瘤组织与正常组织比例大于1 000∶1[2]。此外,减毒沙门氏菌其本身所含的脂多糖(lipopolysaccharide, LPS)、脂磷壁酸(lipoteichoic acid, LTA)和鞭毛蛋白等可引起机体产生免疫反应,诱导T淋巴细胞、B淋巴细胞及巨噬细胞等数量增加,增强宿主的免疫应答能力[3-4],同时,减毒沙门氏菌作为基因治疗载体可通过口服方式给药,属于非侵袭性给药,其给药方式安全,易施行。基于以上特性,减毒沙门氏菌作为基因治疗载体,具有良好的应用价值。1997年,Date等[5]对重组人肝细胞生长因子(hepatocyte growth factor, HGF)消化裂解发现了一种新的全面拮抗HGF生物活性的拮抗剂——NK4。NK4是HGF的变体形式,可与HGF竞争性结合c-Met受体,从而阻遏HGF/c-Met 系统的信号传导[6]。研究表明,NK4可抑制人肝癌MHCC-97H细胞的增殖和迁移以及肿瘤血管生成具有抑制作用[7],有良好的抗肿瘤效果。而白细胞介素-2(IL-2)是由活化的T细胞产生的细胞因子,可增加细胞毒性T细胞、NK细胞和单核细胞的增殖和活化[8]。重组IL-2在临床中的抗肿瘤活性使其分别于1992年和1998年获得FDA的批准,应用于转移性肾癌和转移性黑色素瘤患者的治疗,总缓解率在黑色素瘤中为16%,在RCC中为15%[9-10]。多年来,IL-2被广泛应用于治疗癌症[11]。本研究将NK4 和IL-2基因连接到PIRES-SEQ质粒上,形成pCMV-IL-2-IRES-NK4,随后将其电转入减毒沙门氏菌Ty21a中,形成最终携带NK4和IL-2基因的减毒沙门氏菌,命名为TPIN,因PIRES-SEQ质粒上含有氨苄青霉素(Amp)基因位点,所以TPIN可在含有Amp LB平板上生长,以此筛选阳性菌落,即TPIN。前期实验研究表明TPIN经口服后可抑制瘤体生长以及增强自身免疫反应[12]。为了进一步进行TPIN的批量生产,本研究以探究TPIN的稳定性为目的,从目的基因片段的大小和目的蛋白的表达两方面观察TPIN的遗传稳定性,确保质粒在传代过程中无丢失。
1 材料与方法
1.1 材料
1.1.1 菌株来源和细胞 鼠伤寒减毒沙门氏菌Ty21a购自中国药品生物制品检定所,TPIN为本实验室制备,人肝癌细胞HepG2购自中国科学院上海细胞所。
1.1.2 培养基 ①LB培养基:胰蛋白胨 1%,酵母提取物 0.5%,NaCl 1%,121 ℃高压灭菌20 min。固体培养基另外加入琼脂糖 1.5%。②LA培养基:在LB培养基中加入氨苄青霉素(培养基冷却至60 ℃左右时加入),终质量浓度为50 μg/mL。
1.1.3 试剂与仪器 PremixTaqTM、XhoⅠ、MluⅠ、SalⅠ、NotⅠ限制性内切酶(TaKaRa公司);琼脂糖、TAE电泳缓冲液(索莱宝公司);SuperRed/GelRed 核酸染色液(白鲨生物科技);氨苄西林钠(石家庄华北制药集团);人肝细胞生长因子(HGF)ELISA、人白细胞介素-2 ELISA试剂盒(上海江莱生物有限公司);革兰染色液(珠海贝索生物技术有限公司);杜氏磷酸盐缓冲液(D-PBS)(gibco公司)。高速低温离心机(5417R,德国Eppendorf公司);酶标仪(M200 PRO,瑞士Tecan集团);电子分析天平(AUW120D,日本Shimadzu公司);PCR仪(System 9700,美国ABI公司);凝胶成像系统(UVItee,美国ABI公司);稳压电泳系统(PowerSupply,北京六一公司);电热恒温水浴箱(HH.W21.420,北京科伟永兴仪器有限公司)。
1.2 方法
1.2.1 传代方法 将保存的初代菌用四区划线法接种于LA和LB平板,置于37 ℃恒温培养箱24 h,分别取生长良好的单克隆菌落于10 mL LA和LB液体培养基中,37 ℃、220 r/min培养至OD600为0.6时,取100 μL于LA和LB平板培养,完成传代1次,按此方式连续传代40次,取10代、20代、30代、40代菌落进行稳定性检测。
1.2.2 涂片检查 TPIN每10代进行涂片检查。取1滴生理盐水于盖玻片上,用接种环挑取待测菌落制作涂片,置于酒精灯上方快速过3次固定后进行革兰染色。
1.2.3 菌落PCR TPIN每5代进行菌落PCR观察目的基因有无丢失。用接种针挑取待测菌落于0.2 mL PCR管中,加入10 μL无菌水中混匀,盖紧。100 ℃煮沸5 min,-20 ℃冷冻5 min,重复2次后,5 000 r/min离心5 min,取上清作DNA模板,进行菌落PCR扩增目的基因和启动子CMV。混匀,离心,去气泡,上机检测。PCR仪扩增温度设置:95 ℃ 30 s,55 ℃ 30 s,72 ℃ 1 min/kb,共30个循环,取扩增产物进行电泳检测(表1、表2)。

表1 引物序列表

表2 PCR反应体系
1.2.4 双酶切鉴定 挑取待测菌落于10 mL LA和LB液体培养基中,37 ℃、220 r/min培养10 h后,按质粒提取试剂盒操作提取质粒,测浓度后进行双酶切鉴定(表3)。
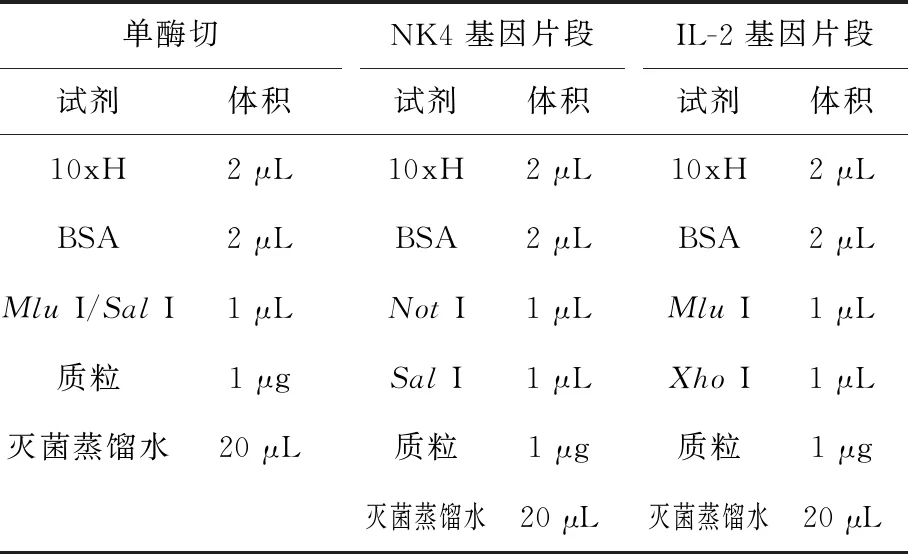
表3 酶切体系
取上述混合物于37 ℃水浴1 h后,取酶切产物进行电泳分析。
1.2.5 TPIN转染HepG2细胞 挑取新鲜接种的TPIN和Ty21a初始代菌落分别接种于10 mL LA和10 mL LB液体培养基中,37 ℃恒温摇床培养OD600为0.6,离心,D-PBS洗涤3遍后,调整细菌浓度为1×108cfu/mL用于细胞转染。将1×106个HepG2细胞接种于25 cm2细胞瓶中,待细胞贴壁后,分为3组:TPIN组、Ty21a组和PBS组,以1×108cfu加入细胞中共孵育2 h,弃去菌悬液,D-PBS洗涤3次后加入含庆大霉素10 ng/mL DMED培养基培养1 h后,D-PBS洗涤3次,加入含双抗的完全培养基继续培养,于12、24、48、72 h检测3组NK4和IL-2蛋白表达情况。按上述转染方法分别转染初始代、10代、20代、30代和40代TPIN,同时设Ty21a组和PBS组作对照,观察48 h NK4蛋白表达和72 h IL-2蛋白表达。

2 结果与分析
2.1 菌落和菌体形态分析
菌落和菌体形态如图1、图2所示,TPIN 10代、20代、30代和40代在LA和LB平板上菌落形态一致,均为淡黄色半透明、边缘整齐、表面光滑湿润的圆形菌落。
2.2 菌落PCR
各代TPIN菌落PCR结果显示,在LA和LB平板上均可扩增出NK4、IL-2和CMV基因且片段大小合适,分别为1.4 kb、444 bp和140 bp,表明TPIN在传代过程中质粒无丢失(图3、图4)。此外,在没有抗生素的选择压力下TPIN也可扩增出相应目的基因,进一步表明本实验室构建的TPIN在没有Amp的条件下也可稳定传代,表达相应目的基因。
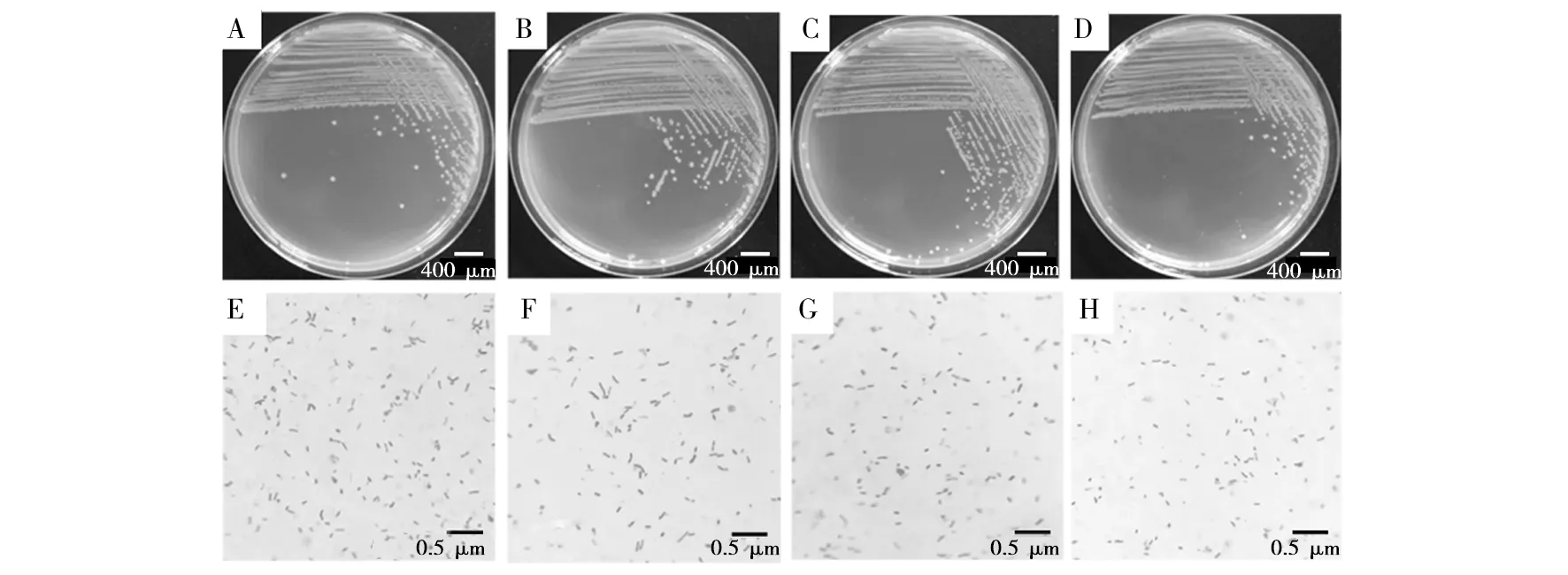
图1 各代TPIN在LA平板上的菌落和菌体特征Fig.1 Colony and bacterial characteristics of each generation of TPIN in LA platesA~D:TPIN 10代、20代、30代和40代在LA平板上的菌落形态;E~H:油镜下TPIN 10代、20代、30代和40代在LA平板上革兰染色菌体形态A-D: Colony morphology of TPIN 10 th, 20 th, 30 th and 40 th generation on LA plates; E-H: Morphology of Gram-stained cells on LA plates of TPIN 10 th, 20 th, 30 th and 40 th generations under oil lens of OLYMPUS microscope

图2 各代TPIN在LB平板上的菌落和菌体特征Fig.2 Colony and bacterial characteristics of each generation of TPIN in LB platesa~d:TPIN 10代、20代、30代和40代在 LB平板上的菌落形态;e~h:油镜下TPIN 10代、20代、30代和40代在 LB平板上革兰染色菌体形态a-d: Colony morphology of TPIN 10 th, 20 th, 30 th and 40 th generation on LB plates; e-h:Morphology of Gram-stained cells on LB plates of TPIN 10 th, 20 th, 30 th and 40 th generations under oil lens of OLYMPUS microscope
2.3 双酶切鉴定
TPIN在LA和LB平板上培养第10代、20代、30代和40代后,提取质粒并测其浓度,结果显示在含Amp和不含Amp的传代过程中,质粒浓度稳定(表4),无明显降低。双酶切结果显示,LA和LB平板上培养第10代、20代、30代和40代TPIN中所含质粒均可被相应的限制性内切酶切割出目的基因条带,由于XhoI在TPIN质粒中存在两个酶切位点,一个位于质粒IRES序列上,一个位于NK4基因上,因此XhoI单酶切有两个片段,经查询,两个片段大小分别为1.6 kb和4.5 kb,与电泳结果相符。因此,MluI和XhoI双酶切可存在3个片段,其大小分别为444 bp(IL-2)、1.1 kb和4.5 kb,与电泳结果相符(图5、图6)。 双酶切结果显示即使在无抗生素选择的压力下,TPIN所含质粒也可被限制性内切酶有效切割目的基因片段。
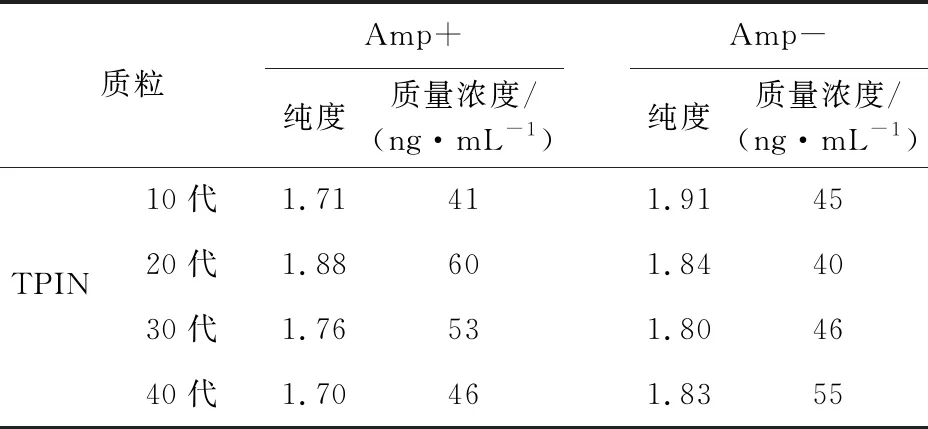
表4 质粒浓度与纯度
2.4 NK4和IL-2蛋白表达
初代TPIN转染HepG2细胞结果如图7A所示,与PBS组和Ty21a组相比,TPIN组NK4蛋白表达显著升高(P<0.01),并于48 h达到高峰,质量浓度为(1.953±0.082)ng/mL;如图7B所示,与PBS组和Ty21a组相比,TPIN组IL-2蛋白表达显著升高(P<0.01)并于72 h达到高峰,其质量浓度为(2.080±0.139) ng/mL。

图3 各代TPIN菌落PCR结果Fig.3 PCR results of each generation of TPIN colonies1、10、19:DL2000 DNA Marker;2~9:TPIN在LA平板上第5代、10代、15代、20代、25代、30代、35代、40代NK4扩增产物;11~18:TPIN在LA平板上5代、10代、15代、20代、25代、30代、35代、40代IL-2扩增产物;20~27:TPIN在LA平板上5代、10代、15代、20代、25代、30代、35代、40代CMV扩增产物1, 10, 19: DL2000 DNA Marker; 2-9: 5 th, 10 th, 15 th, 20 th, 25 th, 30 th, 35 th, and 40 th generation NK4 amplification products of TPIN on LA plate; 11-18: 5 th, 10 th, 15 th, 20 th, 25 th, 30 th, 35 th, and 40 th generation IL-2 amplification products of TPIN on LA plate; 20-27: 5 th, 10 th, 15 th, 20 th, 25 th, 30 th, 35 th, and 40 th generation CMV amplification products of TPIN on LA plate
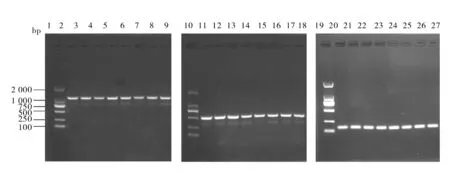
图4 各代TPIN菌落PCR结果Fig.4 PCR results of each generation of TPIN colonies1、10、19:DL2000 DNA Marker;2~9:TPIN在LB平板上第5代、10代、15代、20代、25代、30代、35代、40代NK4扩增产物;11~18:TPIN在LB平板上5代、10代、15代、20代、25代、30代、35代、40代IL-2扩增产物;20~27:TPIN在LB平板上5代、10代、15代、20代、25代、30代、35代、40代CMV扩增产物1, 10, 19: DL2000 DNA Marker; 2-9: 5 th, 10 th, 15 th, 20 th, 25 th, 30 th, 35 th, and 40 th generation NK4 amplification products of TPIN on LB plate; 11-18: 5 th, 10 th, 15 th, 20 th, 25 th, 30 th, 35 th, and 40 th generation IL-2 amplification products of TPIN on LB plate; 20-27: 5 th, 10 th, 15 th, 20 th, 25 th, 30 th, 35 th, and 40 th generation CMV amplification products of TPIN on LB plate
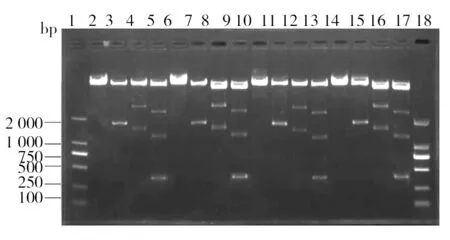
图5 LA平板TPIN双酶切结果Fig.5 Double digestion results of TPIN on LA plate 1、18:DL2 000 DNA Marker;2、6、10、14:10代、20代、30代、40代质粒Mlu I单酶切;3、7、11、15:10代、20代、30代、40代质粒Xho I单酶切;4、8、12、16:10代、20代、30代、40代质粒Not I、Sal I双酶切;5、9、13、17:10代、20代、30代、40代质粒Mlu I、Xho I双酶切1, 18: DL2 000 DNA Marker; 2, 6, 10, 14: Mlu I single digestion of 10 th, 20 th, 30 th, 40 th generation plasmid; 3, 7, 11, 15: Xho I single digestion of 10 th, 20 th, 30 th, 40 th generation plasmid; 4, 8, 12, 16: Not I, Sal I double digestionof 10 th, 20 th, 30 th, 40 th generation plasmid; 5, 9, 13, 17: Mlu I, Xho I double digestion of 10 th, 20 th, 30 th, 40 th generation plasmid
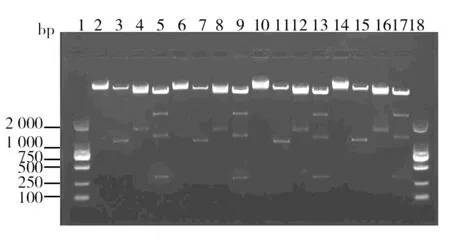
图6 LB平板TPIN双酶切结果Fig.6 Double digestion results of TPIN on LB plate 1、18:DL2 000 DNA Marker;2、6、10、14:10代、20代、30代、40代质粒Mlu I单酶切;3、7、11、15:10代、20代、30代、40代质粒Xho I单酶切;4、8、12、16:10代、20代、30代、40代质粒Not I、Sal I双酶切;5、9、13、17:10代、20代、30代、40代质粒Mlu I、Xho I双酶切 1, 18: DL2 000 DNA Marker; 2, 6, 10, 14: Mlu I single digestion of 10 th, 20 th, 30 th, 40 th generation plasmid; 3, 7, 11, 15: Xho I single digestion of 10 th, 20 th, 30 th, 40 th generation plasmid; 4, 8, 12, 16: Not I, Sal I double digestionof 10 th, 20 th, 30 th, 40 th generation plasmid; 5, 9, 13, 17: Mlu I, Xho I double digestion of 10 th, 20 th, 30 th, 40 th generation plasmid

图7 NK4和IL-2蛋白表达水平Fig.7 Expression level of NK4 and IL-2 proteinsA:NK4蛋白表达; B:IL-2蛋白表达;*:与PBS组相比P<0.05,**:与PBS组相比P<0.01;#:与Ty21a组相比P<0.05,##:与Ty21a组相比P<0.01;PBS:对照组,Ty21a:空载体组,TPIN:TPIN实验组,下图同A: The expression of NK4 protein; B: The expression of IL-2 protein; *: Compared with PBS group, P<0.05; **: Compared with PBS group, P<0.01; #: Compared with Ty21a group, P<0.05; ##: Compared with Ty21a group, P<0.01, the same as below
将1代、10代、20代、30代和40代TPIN转染HepG2细胞后, 其转染结果显示,与PBS组相比,NK4蛋白表达在48 h明显增加(P<0.01)且每代间NK4蛋白表达无差异(P>0.05)。同样,与PBS组相比,IL-2蛋白表达在96 h明显增加(P<0.01)且每代间IL-2蛋白表达无差异(P>0.05),见图8。
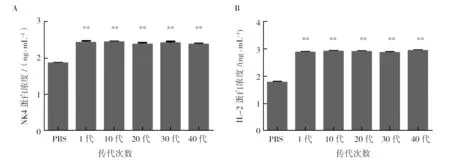
图8 每10代间NK4和IL-2蛋白表达水平Fig.8 Expression levels of NK4 and IL-2 proteins per 10 generations
3 讨 论
基因工程菌(Gene Engineering Bacteria)是利用基因工程技术,将外源目的基因导入宿主细胞使其表达所需蛋白的重组菌[13]。基因工程菌的遗传稳定性对生物制药至关重要,其稳定性是进行扩大生产的前提。目前,在美国有两种获得许可的伤寒疫苗可用于人类,其中包括Ty21a[14-15]。Ty21a由于进行几种减毒突变,其在细胞中存活能力差,只有在最初的24 h 内检测到非常低的脱落。这导致疫苗株具有极好地安全性,在过去30年中,全球范围内已有超过2亿种疫苗的接种[16]。因此,本课题组选用Ty21a作为递送基因的载体,利用基因重组技术将NK4和IL-2基因导入Ty21a中用于治疗消化道肿瘤。
本研究构建的携带NK4/IL-2基因的减毒沙门氏菌TPIN具有较高的稳定性。本研究主要从传代方面观察TPIN在遗传稳定性方面的改变,将TPIN在含和不含Amp的LB平板上连续传代40次后,观察NK4和IL-2基因和蛋白的表达情况。研究结果显示,每10代间菌体和菌落的形态一致,均符合沙门氏菌的形态特征,表明传代次数和携带的目的基因对减毒沙门氏菌的生长不产生影响。传代后TPIN每5代可扩增出携带的目的基因片段(NK4(1 460 bp)和IL-2(444 bp))和启动子CMV(140 bp);每10代可双酶切出NK4和IL-2片段,表明在传代过程中,NK4和IL-2基因不随传代次数的增加而丢失。此外,将TPIN转染HepG2细胞结果显示,NK4和IL-2蛋白具有明显升高的趋势,分别于48 h和72 h达到高峰,而每10代TPIN转染HepG2细胞后,其每10代间表达并无差异,表明TPIN可有效感染HepG2细胞且传代次数并不影响NK4和IL-2蛋白的表达。
本研究通过对TPIN连续传代,从菌落和菌体特征、目的基因存在和表达方面观察后发现,其连续传代40次后,TPIN仍具有良好的稳定性,可稳定表达相应的目的基因和蛋白。研究结果表明,TPIN的遗传稳定性良好,可进一步用于扩大生产和生物制药。
