超声造影对原发性输尿管移行上皮细胞癌的诊断研究
2020-09-05胡文洁陈文莉
刘 阳,李 凡,于 洁,胡文洁,陈文莉
上海交通大学附属第一人民医院超声科,上海 200080
移行细胞癌位居全球癌症第4位,其中5%~10%发生在上尿路,仅发生在输尿管的情况很少见[1]。虽然输尿管移行上皮细胞癌(ureter transitional cell carcinoma,UTCC)发生率低,但是这类患者往往不能在早期得到诊断,预后较差[2-3]。超声检查具有无辐射、动态成像、操作方便等优点,是尿路病变的首选检查方式。但由于输尿管位置深,受到仪器设置、患者体型、肠道气体及不同超声医师的操作技巧等因素的影响[4-6],超声对输尿管病变的诊断效能不高。
超声造影(contrast-enhanced ultrasound,CEUS)技术是近十几年发展起来的新技术,以显示组织或病变微循环为优势。CEUS技术中的微泡造影剂是含有惰性气体的磷脂包被微泡,其在体内半衰期为15 min,通过呼吸排出体外,安全性好;微泡造影剂是纯血池示踪剂,不穿过组织间隙,因此可敏感地捕捉病变微循环灌注的全过程。在过去十多年的应用中,CEUS对不同脏器肿瘤定性诊断价值不断得到证实[7]。国内外学者的研究中,CEUS已被证实可提高泌尿系肿瘤的诊断效能,尤其是对于肾功能不全的患者,可作为放射影像学检查有益的补充[8-10]。但目前针对输尿管病变的研究尚少。
1 资料和方法
1.1 患者信息
选取自2015年5月—2019年1月在上海交通大学附属第一人民医院行CEUS检查的原发性UTCC患者临床资料。回顾并分析所有患者的超声及临床信息,包括年龄、性别、临床症状等。
纳入标准:① 已获得知情同意;② 超声图像质量优良;③ 临床资料信息完整;④ 具有手术后病理学检查结果;⑤ 不伴发其他部位肿瘤。排除标准:① 超声图像质量差;② 临床资料信息不完整;③ 无手术后病理学检查结果;④ 伴发其他部位肿瘤。
1.2 仪器与方法
采用德国Siemens 公司的Acuson Sequoia512及美国GE公司的Logiq E9彩色超声诊断仪,探头分别为4C1-S及C1-6凸阵探头;Acuson Sequoia512配有脉冲对比度脉冲序列模式,Logiq E9配有高保真调幅造影模式;机械指数分别为0.21和0.12。造影剂为意大利Bracco公司的声诺维(SonoVue),剂量为2.4 mL。检查前嘱患者憋尿。取平卧位及侧卧位扫查,从肾门处开始扫查输尿管,结合横断面及纵断面沿全程仔细观察整个输尿管全程,扫查过程中适当加压探头,以避开肠气干扰。选取病变最大切面处固定探头,进入造影模式,调节图像深度及聚焦,一键优化统一图像增益。经肘静脉快速团注造影剂,尾推5 mL 0.9%的NaCl溶液,推注开始时计时,工作站同步录制图像。选择双幅模式,避免图像在检查过程中偏移。造影检查持续观察2 min,图像以DICOM格式存储。
由2名从事CEUS诊断5年以上的医师采用双盲法对肿瘤的常规超声图像和CEUS图像进行诊断。常规超声图像分析病变的位置、回声、边界及大小;观察彩色多普勒血流显像(color Doppler flow imaging,CDFI)上病变的血流信号。在CEUS图像上观察病变的增强程度、测量病变大小、观察管壁形态及分界。按照中国CEUS指南将CEUS时相分为动脉期及静脉期,病变增强程度与输尿管周围的组织进行对照。
1.3 统计学处理
采用SPSS 18.0统计软件进行数据处理。两组间率的比较采用χ2检验,不符合正态分布方差齐性的计量资料采用Wilcoxon秩和检验,P<0.05为差异有统计学意义。
2 结 果
26例UTCC患者平均年龄(66.46±13.25)岁,性别、临床表现、病灶位置见表1。所有病灶二维超声上表现为等回声或低回声。经腹超声可清晰显示管腔内肿块上下边界者17例。CDFI仅在8例肿瘤中显示血流信号。19例患者伴发轻度肾盂积水,7例患者伴中、重度肾盂积水。
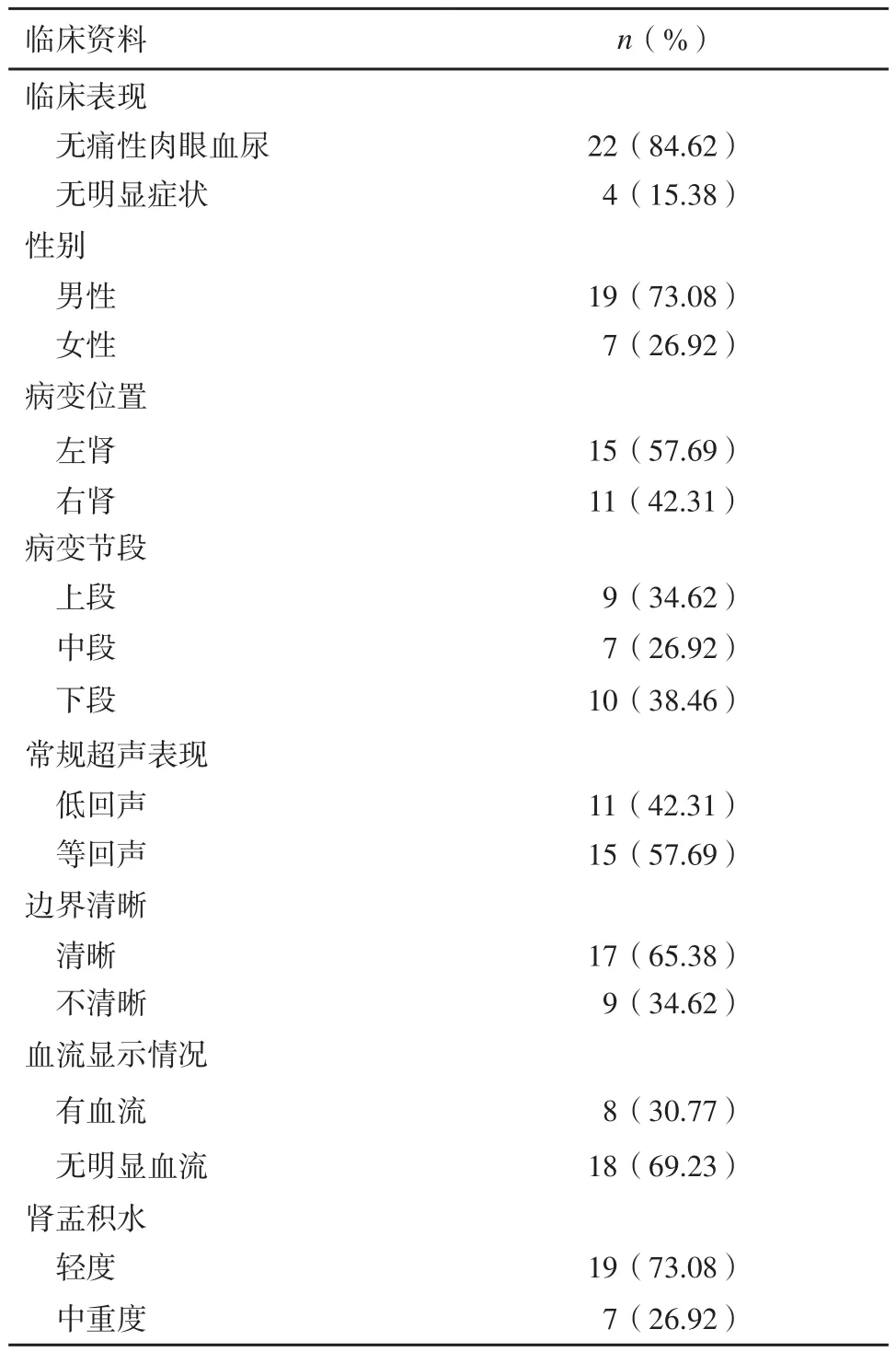
表1 26例UTCC患者流行病学及常规超声影像学资料
CEUS图像上于动脉期及静脉期均呈高增强表现,与管腔内无增强的尿液形成鲜明对照,病变边界清晰。经手术切除后病理学检查证实,T0~T4期肿瘤例数分别为2、6、5、12及1例。在CEUS声像图上肿瘤横径、管壁形态及分界在T0~T2期及T3~T4期间差异显著(P<0.05,表2,图1~2)。26例患者病理学检查证实为高级别UTCC 23例,低级别UTCC 3例。
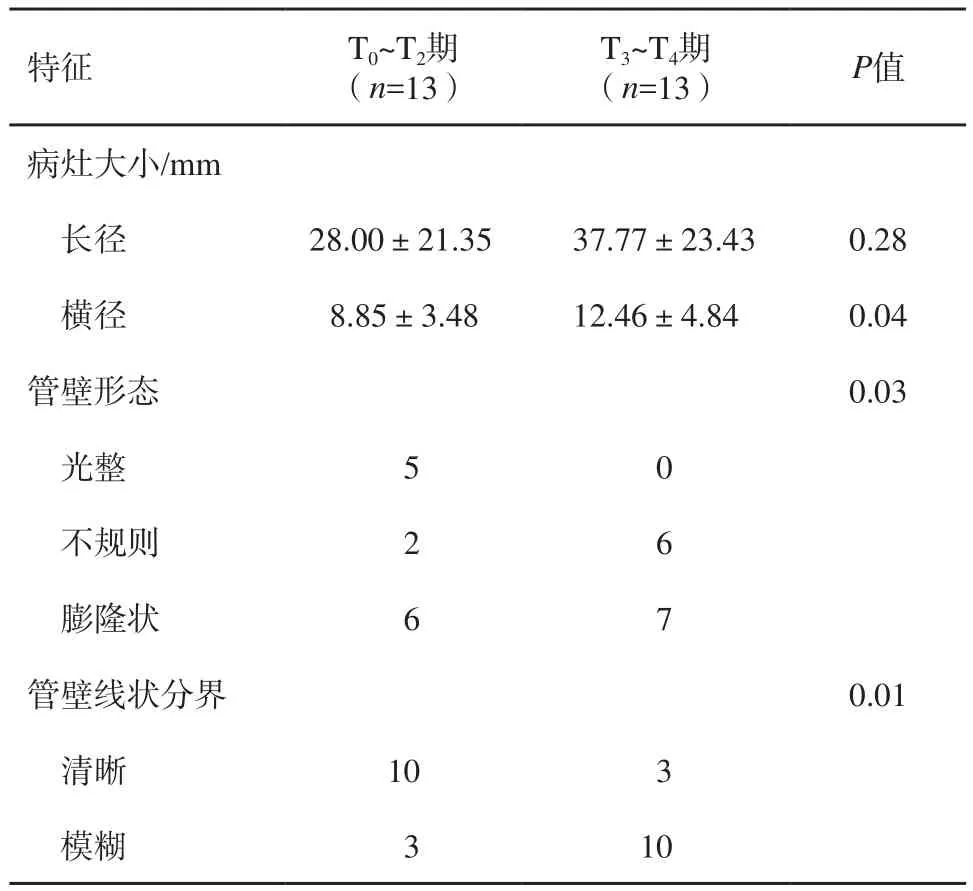
表2 不同分期UTCC组间CEUS声像图特征比较

图1 原发性UTCC的CEUS表现(T1期)

图2 原发性UTCC的CEUS表现(T3期)
3 讨 论
常规超声虽然是泌尿系疾病的首选检查手段,但对输尿管癌的诊断效能不高。这是由于输尿管癌在常规超声上呈低回声或等回声,这些患者往往伴发血尿,导致输尿管腔内透声不佳;其次,当肿瘤未完全堵塞管腔时,患者可能不出现明显的输尿管扩张或肾盂积水,忽视了对输尿管的扫查;再次,输尿管位置深,超声检查时容易受到腹腔气体干扰,尤其是中段病变的显示,导致漏诊[4-6]。本研究回顾并分析了26例输尿管癌病变,这些患者均因可疑输尿管病变入院,因此我们均对患者的全程输尿管进行了仔细的检查,发现可疑病变部位,包括中段病变。但本研究中65.38%(17/26)的患者病变在常规超声上显示出清晰的边界,其余患者在常规超声上无法评估管腔内肿瘤的上下边界,因此也无法准确地测量肿瘤的长径。此外,CDFI仅在30.77%(8/26)的患者肿瘤内显示出血流信号,在其余患者病灶中无血流信号显示,因此无法准确诊断为肿瘤性病变。
在常规超声初步定位输尿管肿瘤后,利用CEUS清晰地显示了全部的UTCC,所有肿瘤均呈现管腔内高增强即富血供的表现,这样与未增强的输尿管腔内的尿液形成显著对比,极大地提高了肿瘤显示率且能准确地测量肿瘤大小。本组患者中25例为结节状生长方式,仅1例为浸润状生长方式。所有肿瘤均表现为均匀增强,肿瘤内未见明显无增强区即坏死区域。考虑到本组患者中23例为高分化UTCC,仅3例为低分化,而高分化的肿瘤较低分化肿瘤发生坏死概率小,由此病变未表现出明显的不均匀增强。
肿瘤分期关系到患者治疗方案的选择以及患者预后的评估。根据世界卫生组织(World Health Organization,WHO)对UTCC的分期标准,可将其分为T0期(肿瘤局限于黏膜内)、T1期(肿瘤侵犯固有膜)、T2期(肿瘤侵犯肌层)、T3期(肿瘤穿透外膜和侵犯周围脂肪)和T4期(肿瘤侵犯邻近脏器或伴局部淋巴结转移)[11-12]。从理论上讲,正常输尿管肌层内无明显血管,在CEUS上会表现为低增强或无增强。但经腹超声探头的分辨率尚无法对肌层进行准确分层,故无法对T2期以下肿瘤进行分期评估,但不同分期组间输尿管管壁的形态有所不同(P=0.03,P=0.01)。当肿瘤在T0~T2期时,肿瘤部位的输尿管管壁与肿块同步增强,但其线状结构仍清晰可辨,管壁形态尚规则;当肿瘤在T3~T4期时,肿瘤浸润至输尿管壁全层,肿块与管壁同步增强的同时,其外围组织也可出现增强,导致管壁分界模糊,且由于肿瘤的全层浸润,致使病变处管壁形态不规则。既往研究表明,肿瘤的大小与肿瘤分期高度相关,肿瘤大于3.5 cm是评估患者预后的独立危险因素[13]。本研究结果亦表明,高、低分期组间肿瘤横径大小差异显著(P=0.04)。
输尿管癌需要与其他输尿管良性病变进行鉴别,主要包括炎性反应、息肉及结石。既往研究表明,输尿管炎性病变血供不及恶性肿瘤丰富[14]。笔者在临床实践过程中发现,输尿管炎性病变在CEUS上表现为近似于或低于输尿管周围组织的增强程度,输尿管管腔内无明显高增强结节状病灶表现;而输尿管息肉则与输尿管癌在CEUS表现上有所重叠,亦可呈富血供,但由于息肉带蒂,会产生特异的“虫蠕动”改变,即病变在管腔内出现上下移动的征象,以及与管壁分界清晰[15-16]。输尿管结石在常规超声上即可作出有效诊断,但当结石合并肿瘤时鉴别诊断有一定困难。
本研究有一定的局限性:首先患者数尚少,由于输尿管癌仅占泌尿系统恶性肿瘤的1%~2%,发病率极低;其次,纳入的患者中仅3例为低分化UTCC,尚无法对组织学上高、低分化的肿瘤进行CEUS特征比较。在今后的临床工作中需进一步积累患者资料进行更为深入的研究。
本研究通过对UTCC的CEUS图像特征进行回顾性分析,发现CEUS能够较常规超声更清晰地显示UTCC的边界,所有UTCC在CEUS上表现为高增强富血供占位,不仅如此,通过分析病变处输尿管壁的增强形态还可辅助UTCC的分期评估。
