肝脏局灶性结节性增生的超声造影与增强磁共振成像的增强表现对比研究
2020-09-05张炜彬汪瀚韬季正标黄备建王文平
张炜彬,董 怡,汪瀚韬,季正标,汤 敏,黄备建,王文平
1. 复旦大学附属中山医院超声科,上海 200032;
2. 上海市影像医学研究所,上海 200032
肝脏局灶性结节性增生(focal nodular hyperplasia,FNH)曾被认为是肝脏少见的占位性病变,但随着近几十年医学影像技术的发展和普及,该病的检出率逐渐上升,成为仅次于肝血管瘤的第2位常见的肝脏良性占位性病变[1]。超声造影(contrast-enhanced ultrasound,CEUS)可以实时动态、精准地显示肝脏肿瘤的内部微循环血供情况,对观察肝脏FNH的CEUS特征有很大帮助[2]。而增强磁共振成像(contrast-enhanced magnetic resonance imaging,CEMRI)的多序列成像及三期定帧扫描可反映病灶的病理学特征和全方位地观察病灶,对显示多发及较小病灶的FNH有独特优势[3]。本研究纳入经外科手术且病理学检查证实的肝脏FNH患者,所有患者术前均经CEUS及CEMRI检查,通过分析对比FNH的CEUS及CEMRI的影像学表现,探讨肝脏FNH表现在两种影像学检查间的差异。
1 资料和方法
1.1 研究对象
选择2010年12月—2018年4月行CEUS及CEMRI检查的74例肝脏FNH患者,均经手术切除后病理学检查证实。其中男性32例,女性42例,年龄为17~67岁,平均年龄(35.6±11.2)岁。本组患者9例为多发,选择其中最大的病灶作为观察对象。本组患者入院后检查甲胎蛋白(alpha fetoprotein,AFP)、癌胚抗原(carcinoembryonic antigen,CEA)及糖类抗原19-9(carbohydrate antigen 19-9,CA19-9)均为阴性。
1.2 CEUS检查
超声检查仪器包括:荷兰Philips公司的iU 22(探头C5-1)及EPIQ7(探头C5-1),美国GE公司的LOGIQ E9(探头C1-5)等型号彩色多普勒超声诊断仪,均具有行CEUS检查的功能。常规检查时探头频率为3.5~7.0 MHz,造影时探头频率为2.0~5.0 MHz,机械指数为0.06~0.09。造影剂使用意大利Bracco公司的SonoVue,使用前加入5 mL 0.9%的NaCl溶液配成浓度为8 μl/mL的六氟化硫微泡悬浊液。每次注射抽取1.5~2.4 mL微泡悬浊液,经肘前静脉用20 G注射针静脉团注,随后快速推入5 mL 0.9%的NaCl溶液冲管。检查时先行常规二维超声,选择最佳观察切面,观察并记录病灶数目、大小、边界及内部回声。切换CEUS模式后嘱患者配合屏气或缓慢呼吸,以保持观察病灶处于观察切面中央。造影剂注射后即开始计时,连续观察病灶及周围肝组织增强消退情况。CEUS过程录像并存储,CEUS时间>3 min,2次CEUS之间至少间隔15 min。
1.3 CEMRI检查
采用1.5T场强磁共振成像仪(德国Siemens公司的Magnetom Avanto),联合应用体部8通道相控阵表面线圈。采用序列包括T1WI、T2WI、扩散加权成像(diffusion-weighted imaging,DWI),序列层厚3.5~5.0 mm,增强前扫描一个回合。磁共振造影剂选用钆喷酸葡胺(Gd-DTPA),剂量为0.2 mol/kg,经肘前静脉注射,注射速度2 mL/s。分别于注射磁共振造影剂后30~40、60~80、180~300 s嘱患者屏气,进行3个回合的扫描。
1.4 CEUS图像分析
由超声医师脱机分析超声图像。在灰阶超声图像上观察并评价病灶的大小、边界、回声等级及内部回声均匀性,并对肝脏的背景回声进行评价。根据2012年欧洲超声医学与生物学联合会(European Federation of Societies for Ultrasound in Medicine and Biology,EFSUMB)肝脏CEUS指南,将CEUS过程分为3个时相:动脉期,为注射造影剂后10~45 s;门脉期,为45~120 s;延迟期,为120 s之后。根据病灶增强强度与肝实质进行比较,病灶在3个时相的增强回声可分为高回声增强、等回声增强及低回声增强。根据病灶增强回声在各时相对比肝实质增强强度的变化,将FNH的增强变化分为“快进慢出”、“快进同出”、“快进快出”。FNH在动脉期的动态增强表现方式分为泉涌状增强(图1)、轮辐状增强(图2)、分支状增强(表现为病灶内部可见显著增强的血管,但排列不呈轮辐状)及整体一致性增强。另外,在各时相观察病灶内部的中央瘢痕及病灶外周的滋养动脉(图3)的出现情况。
1.5 CEMRI图像分析
由放射科医师评价分析CEMRI图像,观察并记录病灶的大小、边界、信号等级及内部回声均匀性,并对肝脏背景信号进行评价。在CEMRI成像观察并评价病灶在各时相的信号强度改变及均匀性,并在各时相观察病灶的外周滋养动脉(图4)及中央瘢痕(图5)的出现情况。
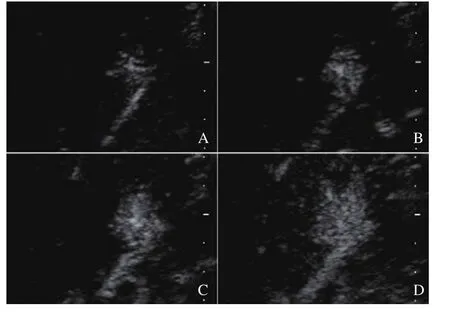
图1 CEUS显示FNH的泉涌状增强
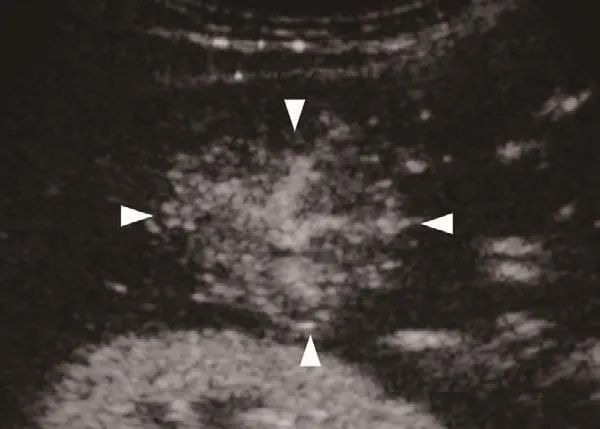
图2 CEUS显示FNH的轮辐状增强

图3 CEUS显示FNH的中央瘢痕及滋养动脉

图4 CEMRI显示FNH的滋养动脉

图5 CEMRI显示FNH的中央瘢痕
1.6 统计学处理
采用SPSS 22.0软件对数据进行处理,连续资料以±s形式表示,计数资料以频率(频数/总数)表示。CEUS与CEMRI显示FNH增强-减退变化的差异采用Fisher精确检验。CEUS与CEMRI显示FNH滋养动脉及中央瘢痕的差异采用McNemar检验,并计算Kappa值进行一致性检验。CEUS及CEMRI分别对比病理学检查显示FNH中央瘢痕的差异采用McNemar检验,并计算Kappa值进行一致性检验。P<0.05为差异有统计学意义。
2 结 果
2.1 灰阶超声与平扫磁共振的影像学对比
本组FNH病灶共74个,病灶平均直径(40.3±21.2)mm,最小8 mm,最大97 mm。其中4.1%(3/74)位于尾状叶,29.7%(22/74)位于肝左叶,66.2%(49/74)位于肝右叶。灰阶超声显示本组病灶中63.5%(47/74)表现为低或稍低回声,10.8%(8/74)为等回声,25.7%(19/74)为高或稍高回声;78.4%(58/74)边界清楚,21.6%(16/74)边界不清。平扫磁共振显示本组病灶在T1WI上89.2%(66/74)呈低信号,10.8%(8/74)呈等信号。在T2WI上86.5%(64/74)呈高信号,12.2%(9/74)呈等信号,1.4%(1/74)呈低信号。在DWI上均呈高信号。64.9%(48/74)病灶边界清晰,35.1%(26/74)边界不清。
2.2 CEUS与CEMRI的影像学对比
CEUS检查注射造影剂后,本组病灶均表现为快速高回声增强(100.0%),凭借CEUS动态实时观察的优势,动脉期观察到病灶的增强方式45.9%(34/74)呈泉涌状增强,21.6%(16/74)呈轮辐状增强,17.6%(13/74)呈分支状增强,14.9%(11/74)呈整体一致性增强。CEMRI检查显示本组病灶在动脉期均快速整体高增强(100.0%),CEUS与CEMRI显示FNH各时相的增强强度如表1所示。CEUS与CEMRI对FNH的增强特征对比如表2所示,CEUS与CEMRI在显示FNH增强-减退上差异无统计学意义(Fisher精确检验,P=0.052)。CEUS与CEMRI在显示FNH滋养动脉上差异有统计学意义(McNemar检验,P=0.000),且两组检查方法的一致性不高(Kappa值=0.033)。CEUS与CEMRI在显示FNH中央瘢痕上差异有统计学意义(McNemar检验,P=0.000),且两组检查方法的一致性一般(Kappa值=0.392)。对照病理学检查结果发现,48.6%(36/74)的病灶可见大体中央瘢痕。CEUS及CEMRI分别与病理学检查结果对比显示中央瘢痕差异均有统计学意义(CEUSvs病理学检查结果,P=0.000;CEMRIvs病理学检查结果,P=0.002),两组检查方法显示中央瘢痕分别对照病理学检查结果的一致性均一般(CEUSvs病理学检查结果,Kappa值=0.516;CEMRIvs病理学检查结果,Kappa值=0.345)。本组CEUSvsCEMRI的诊断准确率差异无统计学意义[90.5%(67/74)vs87.8%(65/74),校正χ2检验,P=0.791]。CEUS与CEMRI误诊病灶见表3。

表1 CEUS与CEMRI显示FNH各时相的增强强度分布
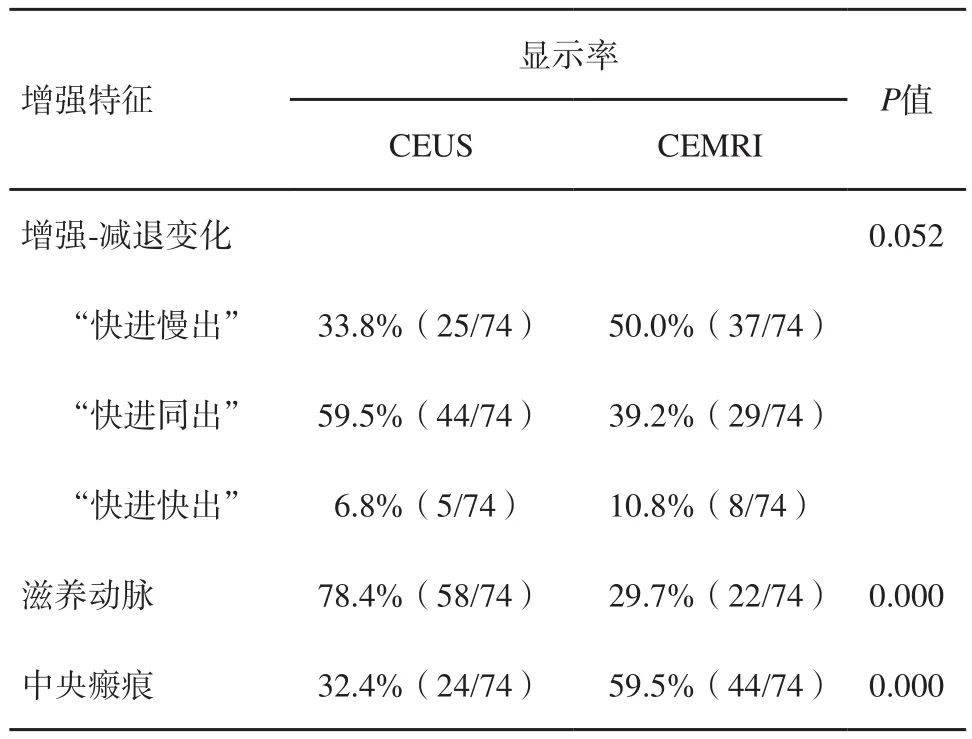
表2 CEUS与CEMRI显示FNH的增强特征对比
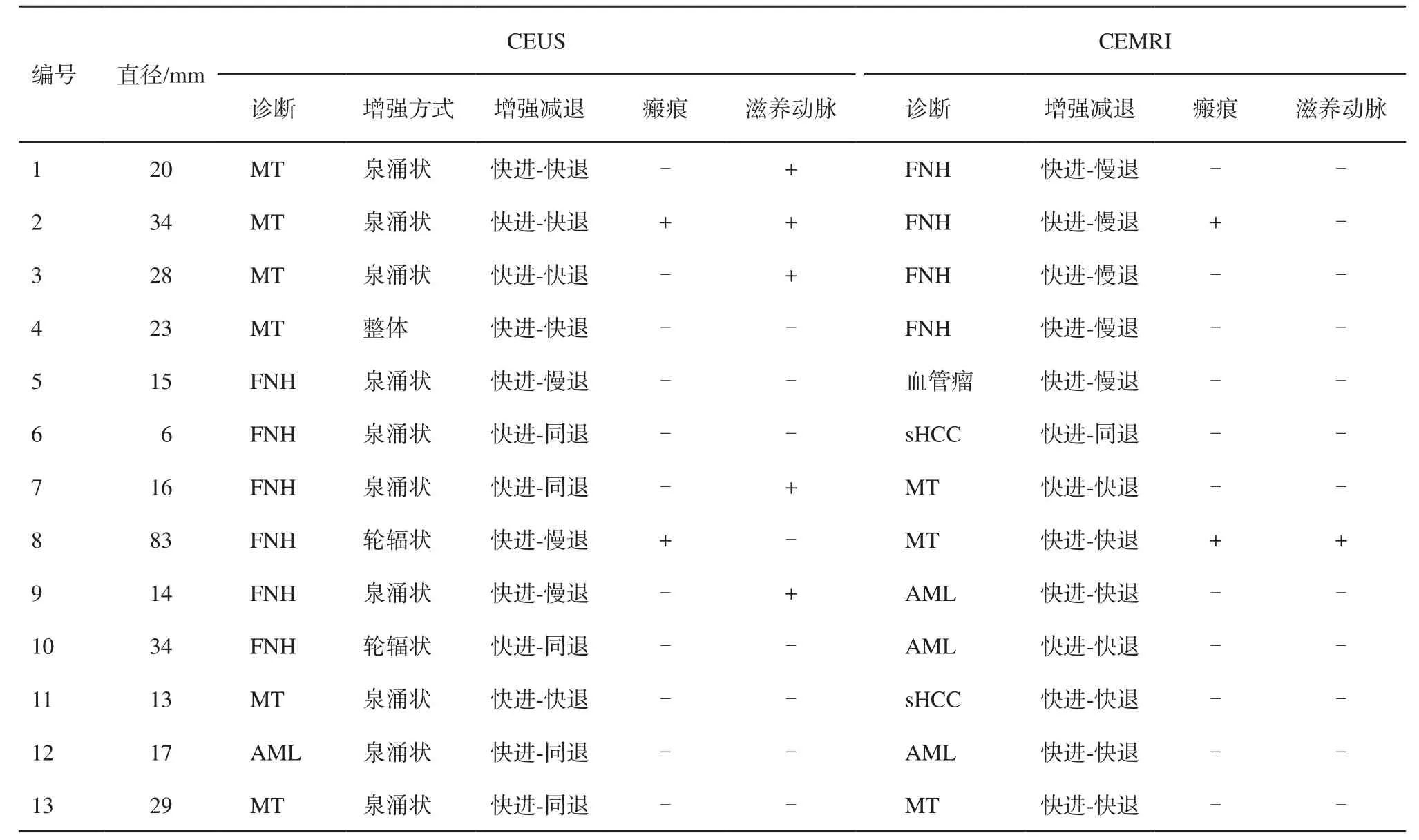
表3 CEUS与CEMRI的FNH误诊病灶对比
3 讨 论
3.1 CEUS与CEMRI在诊断FNH中的应用价值
肝脏FNH是仅次于肝血管瘤的第2位常见的肝脏良性占位性病变。该病在一般人群中的患病率达0.6%~3.0%,占肝脏原发性肿瘤的8%[1]。发病机制尚不清楚,目前认为是血管发育不良或血管内皮损伤导致的动脉高灌注,继而发生肝细胞结节状增生和胆管排列异常。病理学上FNH以中央星状纤维间隔向四周延伸并分隔实质呈结节状为特征,中央星状瘢痕包裹扭曲粗大的厚壁滋养动脉[4]。
目前,影像学检查是术前诊断FNH的主要手段,其中CEMRI诊断FNH有着较高的准确性,其灵敏度达93.9%,特异度达95.3%[5]。CEMRI因其具有无辐射、全容积扫查的优点,常作为非手术患者明确FNH诊断的检查。随着影像学技术的发展,CEUS也已成为当今临床医学的热点,在诊断FNH方面也达到与CEMRI相媲美的准确率,CEUS凭借其可以实时动态地显示肝肿瘤内部微循环血供的优势,对反映FNH的病理学结构特征有很大作用,从而准确诊断FNH。有研究表明,CEUS诊断FNH的灵敏度及特异度分别达80.9%、95.7%[6]。CEUS使用的造影剂为意大利Bracco公司的SonoVue造影剂,其特点是严格的血管内成像,因此被称为真正的“血池”造影剂,这为观察病灶内部的微循环血供特点提供了基础。
3.2 CEUS诊断FNH的优势
CEUS在观察肝脏病灶时具有实时性、动态性的优势,CEUS可以清晰地显示FNH的增强方式及内部的血供情况[7]。CEUS显示FNH的增强方式包括轮辐状增强、泉涌状增强、分支状增强及整体一致性增强,其中轮辐状增强在既往研究中描述最为全面,该增强方式与FNH放射状排列的纤维分隔的结构特征相关,文献报道CEUS检出率为17.9%~36.3%[8-11]。本组CEUS轮辐状增强检出率为21.6%,处于多数文献报道的范围之内。本组45.9%的病灶增强方式呈泉涌状增强,泉涌状增强是一种动态的影像学表现,病灶增强最先由病灶中央的粗大动脉开始,随后增强范围离心性扩大至整个病灶,国内学者将其形象地描述为泉涌征[10]。泉涌征亦与FNH的病理学结构特征相关,但由于该征象并未表现出放射状排列的粗大血管而与轮辐征相区分。以上两者增强方式在CEUS中均体现了FNH的结构特征,对诊断FNH有较高的特异度。需要指出的是,由于CEMRI的影像为三期单帧采集的图像,难以捕捉FNH病灶在早期动脉期的增强表现,也不能完全反映动脉期造影剂在病灶中的填充方式。因此,对于FNH这类富血供占位性病变,在比较CEMRI与CEUS的FNH影像学表现时,动脉期的增强方式缺乏可比性。
3.3 中央瘢痕及滋养动脉在CEUS和CEMRI显示情况
CEUS与CEMRI均有助于显示FNH的滋养动脉与中央瘢痕,本组FNH的中央瘢痕在CEUS与CEMRI的检出率分别为32.4%、59.5%,与文献报道的中央瘢痕检出率相近(CEUSvsCEMRI为17.9%~28.3%vs61.0%)[4-5,8,11]。对照大体病理学检查结果发现,本组48.6%的FNH肉眼可见中央瘢痕,与以往病理学研究的结果(49%)相一致[12]。中央瘢痕作为FNH的典型征象,对诊断FNH有很大的帮助,比较其检出能力则CEMRI>大体病理学检查>CEUS。但是,在一些较小或没有出现中央瘢痕的病灶中,CEMRI诊断FNH会有一定困难,只能通过结合无乙型肝炎的病史及延迟期持续增强等特征,以排除恶性可能,虽然CEUS对中央瘢痕的检出率较低,但是通过CEUS观察病灶增强方式的动态连续性,以发现更丰富的增强信息,可弥补对中央瘢痕发现的不足。本组FNH的滋养动脉在CEUS与CEMRI的检出率分别为78.4%、29.7%,与文献报道相近(CEUSvsCEMRI为67.1%~76.0%vs34.0%)[13-15]。可以看出CEUS对滋养动脉的检出能力较CEMRI或增强CT高。由于断层定帧扫描的原因,MRI较少发现滋养动脉,因此,滋养动脉仅作为诊断FNH的次要征象。CEUS可对肝脏局部动态连续地观察,因此有很大机会发现FNH的滋养动脉。滋养动脉作为FNH在CEUS最多见的征象,对诊断FNH有一定提示作用,但特异度不高。回顾本组患者发现,其滋养动脉多具有扭曲的表现,该表现与FNH的相关性有待与其他肝脏局灶性病变对比研究。
3.4 CEUS和CEMRI对诊断轻度“廓清”FNH的互补价值
不论在CEUS还是CEMRI上,本组FNH绝大多数病灶的增强曲线均表现为“快进慢出”或“快进同出”,与欧洲CEUS指南[2]及美国肝脏局灶性病变诊疗指南[16]中对良性病变的描述相符。然而,在本组患者中仍有9.5%的病灶在延迟期表现为低增强改变,由于几乎所有的病灶在动脉期都表现为快于肝实质的高增强,因此这部分病灶被判定存在“廓清”,与恶性肿瘤典型的“快进快出”表现相重叠。有研究表明,5.3%~13.6%的FNH病灶在CEUS或CEMRI存在“廓清”的恶性征象[9,17]。因此,FNH作为良性肝脏肿瘤仍有少数出现虚假的恶性征象。在对比本组误诊病灶的两种影像学表现时发现,“廓清”的表现并不是都同时在两种影像学检查中检出。因此,两种影像学检查在正确诊断FNH上可以起到相互补充的作用。
综上,CEUS在动态显示FNH的轮辐状及泉涌状增强方式方面优于CEMRI,而在显示FNH的中央瘢痕上CEMRI的灵敏度更高。个别FNH病灶会在CEUS或CEMRI检查中出现轻度“廓清”的恶性病变影像学表现,但是在结合两种检查方式后可互相参考从而排除误诊的可能性。CEUS与CEMRI在诊断FNH方面诊断能力相当,考虑到易用性、安全性及成本,CEUS应作为首选的检查方式。
