转移灶18F-FDG PET/CT代谢参数对初诊转移鼻咽癌患者预后预测价值
2020-09-05张雪芳智生芳郑巧兰黄晓红梁栩维
张雪芳,智生芳,黄 云,郑巧兰,张 纯,黄晓红,梁栩维
1. 南方医科大学附属东莞人民医院放疗科,广东 东莞 523059;
2. 南方医科大学附属东莞人民医院核医学科,广东 东莞 523059;
3. 中山大学公共卫生学院统计学系,广东 广州 510080;
4. 中山大学附属第三医院期刊中心,广东 广州 510630
鼻咽癌是一种侵袭性很强的恶性肿瘤,初诊患者中4%~10%已出现远处转移[1]。转移性鼻咽癌患者的2年生存率仅为10%~30%[2],但对部分患者给予积极治疗(包括化疗,原发灶、转移灶的放疗),其5年总体生存率(overall survival,OS)可提高20%[3]。如何筛选合适患者进行积极的治疗值得深入研究。自1995年“寡转移”的概念[4]被提出以来,肿瘤负荷对预后的影响越来越受到重视。18F-FDG PET/CT是一种在转移鼻咽癌的诊治中很有价值的检查方法[5],但临床上大多仅用于定性诊断,使用最多的指标是标准摄取值(standard uptake value,SUV),其他的代谢性指标如肿瘤代谢体积(metabolic tumor volume,MTV)、总病变糖酵解(total lesion glycolysis,TLG)等可直观地描述肿瘤的负荷,但其应用价值尚未被充分发掘。本研究拟通过回顾并分析85例初诊转移的鼻咽癌患者的各代谢参数与预后的关系,进而探讨以上指标的预测作用。
1 资料和方法
1.1 入组条件
患者纳入标准:① 鼻咽活检证实鼻咽未分化型非角化性癌;② 在南方医科大学附属东莞人民医院经全身PET/CT检查及其他检查,明确伴远处转移(颈部淋巴结除外);③ 抗肿瘤治疗前行PET/CT检查;④ 无伴活动性肺结核;⑤ 具有完整的临床资料及PET/CT数据。
1.2 一般临床资料
2010年5月—2018年1月在东莞市人民医院住院并满足纳入标准的患者共85例,其中男性70例,女性15例,年龄27~83岁,中位年龄53岁。其他临床资料详见表1。

表1 85例初诊转移鼻咽癌患者的临床特征
1.3 PET/CT检查方法
患者禁食至少6 h后注射放射性示踪剂,测定血糖水平正常后,静脉注射放射性示踪剂(18F-FDG)3.70~5.55 MBq/kg,饮5%~10%甘露醇500~1 000 mL,在安静房间静卧45~60 min,排尿后再饮5%~10%甘露醇300 mL,再休息30 min,采用德国Siemens公司的Biograph Series系统行数据采集。全身扫描范围从头部到双大腿上段,获得横轴面、矢状面及冠状面的PET图像、CT图像及PET/CT融合图像。PET/CT图像均由2名有15年以上工作经验的核医学科医师使用商业软件包(SYNGO.NM oncology)进行观察分析,诊断不一致时,讨论达成一致。
SUV=单位组织体积中的衰变校正活性(kBq/mL)/每单位质量注射的18F-FDG活性(kBq/g);分析图像选取原发灶或者转移灶的放射性浓聚最高的层面勾画感兴趣区,软件自动计算SUV的最大值(SUVmax)和SUV平均值(SUVmean)来表示该病灶18F-FDG的代谢活性。
MTV定义:在PET图像上选择每个病灶,使用SYNGO.NM oncology根据不同SUV阈值自动勾画病灶体积。选择2个阈值进行描述定义:① 计算绝对阈值的最大值为2.5,在SUV>2.5的情况下标记肿瘤组织,定义为MTV2.5。② 计算相对阈值的最大值为40%×SUVmax,在SUV>(40%×SUVmax)的组织标记肿瘤组织,定义为MTV40。用软件计算每个病灶的体积(MTV)和体积内平均SUV(SUVmean);详见图1。所有的转移灶总和分别为MMTV2.5和MMTV40,鼻咽和颈部肿瘤体积分别定义为NPMTV2.5/NPMTV40,NKMTV2.5/N K M T V 4 0,每个患者所有M T V之和为WBMTV2.5及WBMTV40。
每个病灶TLG=MTV×SUVmean,所有的转移灶总和分别为MTLG2.5/MTLG40,鼻咽和颈部肿瘤糖酵解分别定义为NPTLG2.5/NPTLG40,NKTLG2.5/NKTLG40,所有病灶的糖酵解之和为WBTLG2.5及WBTLG40。

图1 初诊转移鼻咽癌患者18F-FDG PET/CT使用不同上限勾画的MTV
1.4 统计学处理
计量资料用中位数(上、下四分位数)[M(QL,QU)]表示,计数资料用率(百分比)表示;用R软件(R 3.5.1)“survivalROC”[6]计算PET/CT各个代谢指标的时依性(2年生存率的)ROC,求各变量在不同时点预测结局的最佳截断值,将各个代谢指标按照上述最佳截断值转换成分级变量;将所有因素行Kaplan-Meier单因素分析,筛选出有意义的影响因素,并进行彼此间的相关性分析,相关性强的分别纳入不同模式行Cox回归模式分析。OS定义为获得病理学诊断至任何原因死亡时间。P<0.05为差异有统计学意义。
2 结 果
2.1 随访及生存情况
截止至2019年9月1日,随访时间中位数为19.15(6.95,22.93)个月,其中最长的随访时间为95.90个月;中位生存期为17.00个月(95%CI:13.72~20.28)。
2.2 各代谢参数的基数水平
不同部位的SUVmax:NPSUVmax为11.10(7.10,14.98),NKSUVmax为10.10(7.05,15.28),MSUVmax为7.35(5.40,12.15),转移灶的SUVmax较鼻咽和颈部淋巴结的SUVmax低。各参数的均值、上、下四分位数,以及通过R软件选取预测2年OS为终点的最佳截断值、曲线下面积如表2所示。
2.3 单因素分析
按照上述2年OS计算出的最佳截断值将PET/CT的各项代谢参数进行分组,将年龄、性别、T分期、N分期、转移部位、化疗周期、放疗剂量以及分组后的PET/CT的各项代谢参数进行的Log-rank单因素分析,结果显示,只有转移部位、化疗周期、放疗剂量、MSUVmax、NKMTV40、MTLG40、WBTLG40、MMTV2.5、WBMTV2.5是影响OS的因素(表3)。

表2 85例初诊转移鼻咽癌患者18F-FDG PET/CT各代谢指标的参数
2.4 多因素分析
对MSUVmax、NKMTV40、MTLG40、WBTLG40、MMTV2.5、WBMTV2.5进行相关性分析,发现MTLG40与MMTV2.5、WBTLG40与WBMTV2.5存在较强的相关性,MTLG40与MMTV2.5的相关系数r=0.73(P<0.000 1),WBTLG40与WBMTV2.5的相关系数r=0.80(P<0.000 1),其余代谢指标相关系数均小于0.7。将MMTV2.5、WBMTV2.5作为一组,MTLG40、WBTLG40作为另一组分别与转移部位、化疗周期、放疗剂量、MSUVmax、NKMTV40等因素行Cox多因素分析。多因素分析提示化疗>6周期、MTLG40>43.74 g、MMTV2.5>13.04 mL等是影响OS的独立预后因素(表4~5,图2~3)。

表5 85例初诊转移鼻咽癌患者的Cox模型多因素预后分析(基于TLG)

图2 基于MMTV2.5(以13.04 cm3为截点分组)的OS曲线
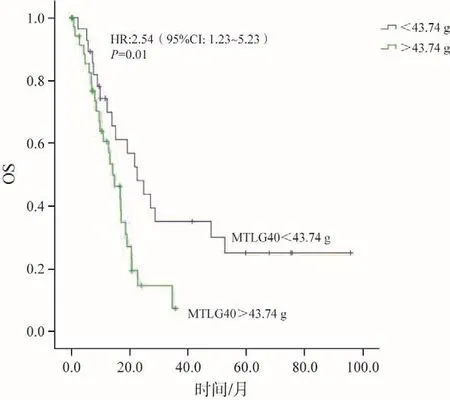
图3 基于MTLG40(以43.7 g为截点分组)的OS曲线
3 讨 论
恶性肿瘤出现远处转移一直被认为不可被治愈,临床上一般采用姑息化疗。随着“寡转移”概念的提出[4,7]和对恶性肿瘤转移机制的深入研究,发现肿瘤负荷与OS密切相关;寡转移的状态下,肿瘤转移能力受限,有相当比例的患者是可治愈的。Gomez等[8]发现系统治疗后病灶稳定的寡转移非小细胞肺癌患者中,局部的巩固放疗较维持化疗组、观察组明显延长了无进展生存期(progression-free survival,PFS;14.2个月vs4.4个月)和OS(41.2个月vs17.0个月)。在寡转移的乳腺癌[9]和结直肠癌[10]中也证实了局部治疗的价值,包括切除转移灶及立体定向放射治疗。初诊转移鼻咽癌亦可分为寡转移和广泛转移,应给予个体化治疗[11];对寡转移患者给予原发灶及转移灶的局部治疗,可大大改善其预后[3],患者甚至能长期生存[12]。
然而,目前对于“寡转移”并无精确的定义。合理利用临床、放射或生物学标志物来筛选此类患者,成为远处转移的恶性肿瘤治疗领域迫切需要解决的问题[13]。
Woff等[14]发现,治疗前18F-FDG PET/CT全身的MTV(WB-MTV)和全身TLG参数(WBTLG)可作为多激酶抑制剂治疗的化疗失败的远处转移结直肠癌患者的预后预测指标,高WBMTV和WB-TLG患者预后欠佳。后续研究证实了循环cfDNA和WB-MTV联合应用对该组患者的预测作用[15]。一项抗血管内皮生长因子靶向治疗转移性肾细胞癌的研究中,发现高钙血症、MTV和TLG均是影响PFS和OS的独立预后因素,高MTV组和TLG组的PFS和OS较差[16]。在转移性三阴性乳腺癌[17]、转移性难治性甲状腺癌[18]、去势治疗耐药应用多西他赛的转移性前列腺癌[19]中均证实了MTV、TLG与预后负相关。以上研究均提示18F-FDG PET/CT的代谢参数MTV、TLG有望为转移性恶性肿瘤的临床实践和研究试验中的风险分层提供有效的依据。
Li等[20]发表的一项Meta分析,结合了10项初步研究,包括941例鼻咽癌患者,发现SUVmax、MTV和TLG是鼻咽癌患者预后的重要预测指标,SUVmax、MTV、TLG增高与预后不良有关。但该文章中绝大部分研究对象为非转移的患者,以上参数主要聚焦于原发病灶鼻咽(MTV-T,TLG-T)及颈部淋巴结(MTV-LN,TLG-LN)。Sun等[21]发现颈部淋巴结SUVmax、转移灶的SUVmax以及治疗前EBDNA水平对初诊转移鼻咽癌的预后均有预测作用,治疗前EBDNA具有更强的预测作用;作者也发现转移灶的SUVmax具有预后预测作用[22]。但目前暂未见到18F-FDG PET/CT代谢参数对初诊转移鼻咽癌的预测作用的研究。初诊转移鼻咽癌的代谢参数除了原发病灶和颈部淋巴结,还有远处转移灶。转移灶所在器官、转移灶的个数对预后有重要的影响。Shen等[23]发现在单纯骨转移的转移性鼻咽癌中,少于3个转移灶、脊柱受累和联合放化疗的患者OS更长。Zou等[24]根据是否有肝转移、转移的数量将初诊远处转移的鼻咽癌患者分成M1、M2、M3这3个亚组,有肝转移、多个转移灶的患者预后较差。
本研究将初诊转移的鼻咽癌患者的代谢参数分成不同的部位进行比较。单因素分析发现转移部位、化疗周期、放疗剂量、MSUVmax、NKMTV40、MTLG40、WBTLG40、MMTV2.5、WBMTV2.5是影响OS的因素。即全身的代谢参数和转移灶的代谢参数与预后相关,鼻咽及颈部转移灶则与预后无关。多因素分析发现化疗大于6周期、MTLG40>43.74 g、MMTV2.5>13.04 mL等是影响OS的独立预后因素。目前,多数关于MTV和TLG与转移性恶性肿瘤的研究均提示全身的MTV和TLG与PFS或者OS相关[14-15,17-19,25]。本研究提示,加入转移灶的代谢参数经多因素分析,全身的相关指标与预后无关;因此我们认为相对全身的指标,转移灶的MTV/TLG对OS的影响更大;我们推断转移灶的细胞克隆相比原发灶具有更强的侵袭性和生长能力,对患者预后起着决定性作用。事实上,早在2010年,Idirisinghe等[26]发现乳腺癌的复发病灶和转移病灶的激素受体和CerbB-2受体的表达并不一致。因此,无论临床实践还是基础研究,对转移灶的深入研究可望增加对转移性恶性肿瘤的认识,提高该组患者的疗效,将不可治愈的肿瘤转变为可治愈。
在决定MTV阈值中,本研究分别使用SUVmax的40%,SUV的绝对值为2.5的标准。转移病灶的SUVmax中位数为7.35(5.40,12.15),较鼻咽及颈部淋巴结转移灶的SUVmax(11.10和10.10)低。相关文献对于18F-FDG PET/CT显示病灶SUVmax较低的患者采用SUV的绝对值为2.5的标准[27],更能准确反映病灶的体积。故本研究采用了以上两种标准,结果表明,评估MTV中,采用SUV的绝对值为2.5,而评估TLG时应用SUVmax的40%作为测量的标准更准确地反映了代谢指标与OS的关系。
综上所述,初诊远处转移的鼻咽癌18F-FDG PET/CT的转移灶的代谢参数MTV和TLG可预测患者的生存预后。但本研究样本量不大,为回顾性分析,入选的研究对象接受不同的治疗方式,可能导致某些偏倚。根据本研究结论设计前瞻性研究,统一治疗方式,应用18F-FDG PET/CT的代谢相关指标所评估的预后,可进一步验证以上影像学指标的预测作用。
