康宁木霉对龟裂链霉菌MY02诱导活性及其诱导组分的初步分析
2020-09-05魏溪垚于基成
魏溪垚, 刘 秋, 于基成
(大连民族大学 生命科学学院,辽宁 大连 116600)
提高放线菌次级代谢产物产量或获得新型抗生素是抗生素研究领域的研究热点。通常提高放线菌抗生素产量的技术包括诱变育种、原生质体融合、基因重组等。近年来,利用微生物间的协同作用提高微生物活性代谢产物的产量也日益受到关注。徐淑蓓等[1]报道红曲霉、红茶菌及其与鹿角灵芝菌复合发酵后对灵芝菌胞外多糖产量均有明显影响,红曲霉与鹿角灵芝菌复合发酵后,灵芝菌胞外多糖产量增加15%;不同红茶菌分离菌株对促进鹿角灵芝胞外多糖的产生影响有所不同。张凡凡[2]通过将纤维素分解菌与不同发酵类型乳酸菌作为复合菌剂发酵青贮玉米,以期利用微生物间的协同作用提质降耗。邹晓等[3]利用白黑粉菌(Ustilagoesculenta)与紫红曲霉(Monascusperpureuss)共同培养,在培养到第8天洛伐他汀产量提高了203%。但目前的诱导作用多是关于利用真菌诱导处理植物细胞培养物,进行混合培养,促进植物细胞大量合成次级代谢产物的报道。许建峰等[4]利用6种真菌诱导物对高山红景天细胞生长与红景天甙积累的影响,其中以黑曲霉诱导物效果最好。在细胞培养初期添加质量浓度为10 mg/L的黑曲霉诱导物能使培养细胞中红景天甙含量提高0.995%。前体与诱导物调控组合的运用,最终使红景天甙产量达到167.4 mg/L,是对照培养的3.5倍。而利用真菌诱导微生物积累次生代谢方面的研究却相对较少。随着细菌和真菌基因组研究的深入,人们发现通过某些小分子的刺激可激活胞内一些沉默途径,尤其是一些次级代谢产物合成的基因簇,从而获得比传统发酵更多的代谢产物[5]。因此,近年来有研究者在利用真菌诱导微生物生产次级代谢产物方面进行了大胆尝试,并在类胡萝卜素、海洋生物碱、灵芝多糖和灵芝酸、Monacolin K 和DMA 等方面取得了许多可喜成果[6-7]。本研究以真菌作为诱导菌株,评价其对放线菌龟裂链霉菌(Streptomycesrimosus)MY02活性的影响,并对其诱导条件进行优化。
1 材料与方法
1.1 材料
1.1.1 菌株 龟裂链霉菌(S.rimosus)MY02、黄瓜枯萎病菌(Fusariumoxysporumf sp.cucumarinum)、康宁木霉(Trichodermakoningii)、香菇真菌(Lentinusedodes)均来自大连民族学院功能微生物实验室。
1.1.2 培养基 ①菌株MY02发酵培养基:葡萄糖20 g, 蛋白胨20 g,MgSO4·7H2O 0.5 g, KH2PO42 g ,蒸馏水1 000 mL,pH自然;②PD培养基:马铃薯200 g,葡萄糖20 g,蒸馏水1 000 mL,pH自然;③PDA培养基:在PD培养基基础上添加18 g琼脂制备成固体培养基。
1.1.3 主要仪器与设备 高压蒸汽灭菌锅(5Y0264,日本三洋电子有限公司),天美多功能冷冻离心机(CT15RT,北京格瑞恩科技发展公司),全温培养摇床(211B,上海智城分析仪器制造有限公司),超净工作台(ZHJH-C1112C,上海智城分析仪器制造有限公司)。
1.2 方法
1.2.1 真菌对菌株MY02活性的诱导作用 分别以康宁木霉和香菇真菌作为诱导菌株,以放线菌龟裂链霉菌MY02作为被诱导菌株,采用间隔对峙培养方法,即制备PDA平板培养基,将PDA平板分为5个平行区域,分别将菌株MY02与康宁木霉间隔对峙培养,最中间区域密集涂布诱导菌,然后依次密集涂布菌株MY02和诱导菌(图1)。涂布完成后于28 ℃培养7 d。以黄瓜枯萎病菌作为指示菌,评价经诱导后菌株MY02的活性变化。对峙培养结束后,用打孔器取经过对峙培养后的菌株MY02菌块。将菌块分别置于含有指示菌的PDA固体平板上,28 ℃培养3 d,以未经对峙培养的菌株MY02菌块作为对照,十字交叉法测量抑菌圈直径,评价诱导菌株对菌株MY02活性的诱导作用。
1.2.2 康宁木霉诱导液的制备 将康宁木霉真菌(孢子浓度106个/mL)接种于PD培养液中,25 ℃,140 r/min 振荡培养6 d。发酵结束后,将发酵液于10 000 r/min 离心20 min,上清液即为康宁木霉诱导液,将制备的康宁木霉诱导液于4 ℃冰箱保存备用。
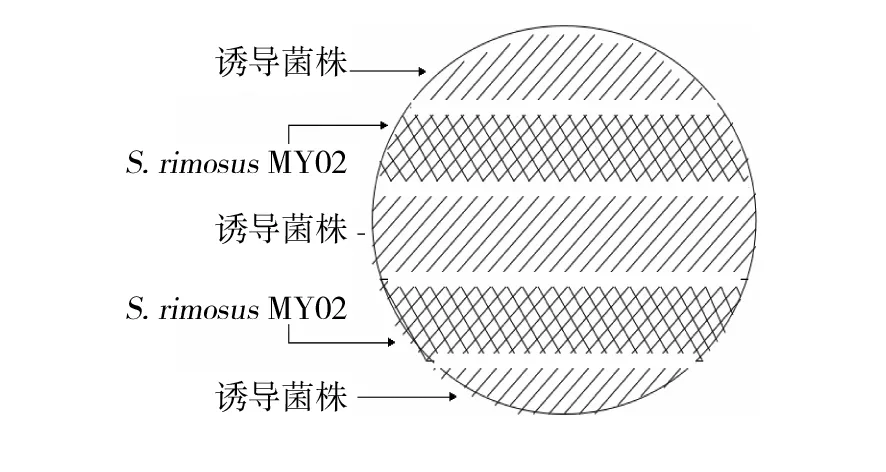
图1 菌株MY02与诱导菌间隔培养Fig.1 Isolated culture of actinomycetes and inducible bacteria
1.2.3 康宁木霉诱导液接种量对菌株MY02活性的影响 菌株MY02发酵至36 h,分别接入装液量的0.2%、2%、20%上述制备的康宁木霉诱导液,28 ℃,140 r/min继续发酵5 d。发酵结束后,测定菌株MY02的发酵液活性,以未添加诱导液的菌株MY02发酵液活性为对照,比较康宁木霉诱导液对菌株MY02活性的影响。
1.2.4 康宁木霉添加时间对菌株MY02活性的影响 在菌株MY02发酵的不同阶段(0、12、24、36、48 和60 h),分别按照2%的量添加培养6 d 的康宁木霉诱导液,以确定诱导液的最佳添加时间。
1.2.5 康宁木霉诱导菌株的诱导组分初步分离 取100 mL发酵6 d的康宁木霉诱导菌株的发酵物,采用以下方式分别得到诱导菌株的4种组分。用6层无菌纱布将菌丝体与发酵液分开,将过滤获得的菌丝体用无菌水洗涤3次,洗去表面培养基,8 000 r/min离心20 min,弃上清。将菌丝体沉淀置于50 mL离心管中,超声破碎后,12 000 r/min离心10 min,将上清液与沉淀分开,沉淀标记为组分Ⅰ;菌丝沉淀离心得到的上清为细胞破碎释放的内含物,标记为组分Ⅱ;纱布过滤后得到的发酵液再用0.22 μm滤膜除菌,标记为组分Ⅲ;组分Ⅲ经高温高压处理后标记为组分Ⅳ。
1.2.6 康宁木霉诱导菌株的诱导组分分析 将康宁木霉诱导菌株的发酵液真空浓缩,乙醇沉淀,8 000 r/min离心20 min,将沉淀与上清液分开,乙醇沉淀物于65 ℃烘干后,再用100 mL双蒸水复溶,标记为组分Ⅴ,主要成分为蛋白质及多糖;上清液真空浓缩除去乙醇,同样用100 mL双蒸水溶解,标记为组分Ⅵ,命名为FECS。组分Ⅴ采用Sevag试剂除蛋白4次,然后用透析袋除盐,得到的组分命名为EPS。
2 结果与分析
2.1 不同真菌对菌株MY02活性的诱导作用
当菌株MY02分别与香菇真菌和康宁木霉共培养时,均能显著提高菌株MY02的活性,其抑菌圈直径分别从对照(无诱导菌株)的18.2 mm增至27.0 mm和34.6 mm,可见两种真菌均对菌株MY02具有明显的活性诱导作用(图2)。其中康宁木霉对菌株MY02具有更高的诱导活性,因此,后续实验初步评价了康宁木霉不同组分对菌株MY02的诱导效果。
2.2 康宁木霉诱导液接种量对菌株MY02活性的影响
当接种量为2%时,共培养的混合发酵液中菌株MY02的活性最高,发酵液的抑菌圈直径为(31.3±0.1) mm。因此,2%为最佳诱导菌株接种量(图3)。
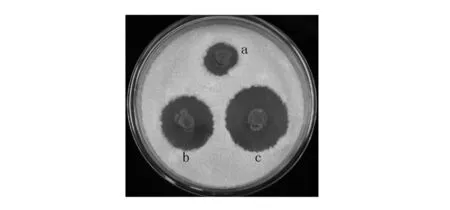
图2 不同真菌对菌株MY02活性的诱导作用Fig.2 Induction of MY02 activity by different Fungia:菌株MY02单独培养的抑菌活性;b:菌株MY02与香菇真菌共培养后的抑菌活性;c:菌株MY02与康宁木霉共培养后的抑菌活性a: Antifungal activity of S. rimosus MY02 cultured alone; b: Antifungal activity of S. rimosus MY02 co-cultured with Lentinus edodes; c: Antifungal activity of S. rimosus MY02 co-cultured with T. koningii
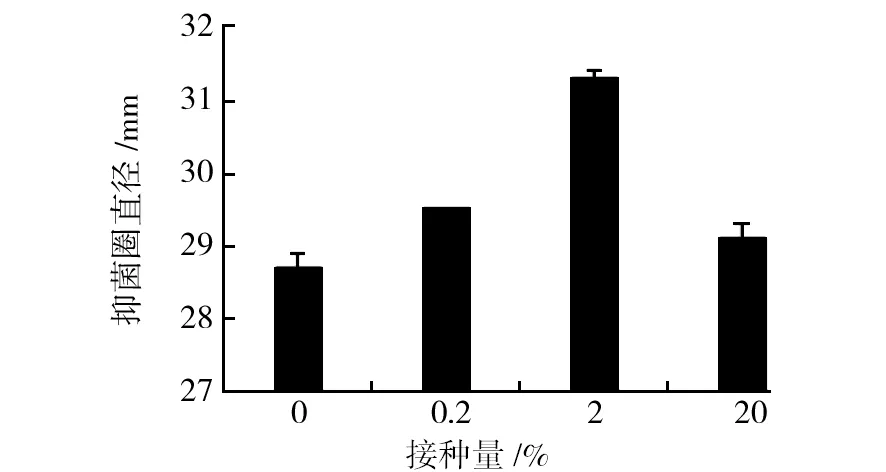
图3 诱导菌株接种量对菌株MY02抗真菌活性的影响Fig.3 Effect of induced strain inoculation quantity on antifungal activity of strain MY02
2.3 康宁木霉诱导菌的发酵液添加时间对菌株MY02活性的影响
由图4可知,诱导菌株发酵液接种时间在0~36 h时,随着诱导菌株发酵液接种时间的增长,抑菌圈直径随之增大,菌株MY02的活性也随之增强。当诱导菌株接种时间为菌株MY02发酵36 h时,发酵液活性最大,发酵液的抑菌圈直径为(31.3±0.1) mm。36 h后,随诱导菌株接种时间的延长,抑菌圈直径减小。因此,选择诱导菌株发酵液在菌株MY02发酵36 h时为最佳添加时间。
2.4 诱导菌株诱导组分的初步分析
按照1.2.5处理后分别得到4种康宁木霉诱导组分,由图5可知,4种诱导组分的诱导效果不尽相同。其中菌株MY02在分别添加诱导组分菌丝沉淀物(组分Ⅰ)和菌丝裂解液(组分Ⅱ)发酵后,菌株MY02抗真菌活性没有增加,说明康宁木霉菌丝及其裂解液没有诱导活性。处理方式Ⅲ和处理方式Ⅳ,即除掉菌丝的发酵液以及经过高温高压处理的除掉菌丝的发酵液添加到MY02培养基中,菌株MY02的抗真菌活性较对照组均有所提高。其中组分Ⅲ对MY02 抗真菌活性诱导作用最强(抑菌圈直径为(31.3±0.9) mm,说明康宁木霉对菌株MY02抗真菌活性的诱导组分在发酵液中,且诱导组分抗高温。
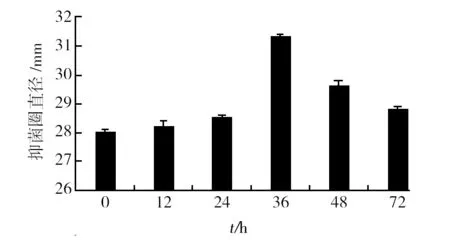
图4 诱导菌株接种时间对菌株MY02抗真菌活性的影响Fig.4 Effect of induced strain inoculation time on antifungal activity of strain MY02
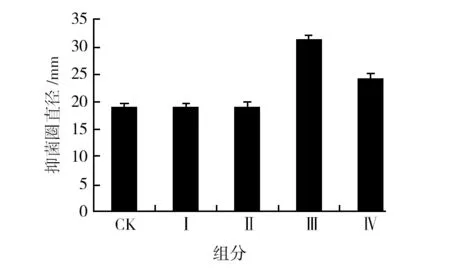
图5 诱导菌株发酵液不同组分对菌株MY02抗真菌活性的影响Fig.5 Effect of different components of induced fermentation broth on antifungal activity of strain MY02
由图6可知,在菌株MY02发酵36 h时,添加等浓度等体积的FECS和EPS对MY02抗真菌活性都有促进作用。FECS为菌株MY02发酵液的乙醇沉淀物,其组分包括蛋白和多糖大分子物质,EPS则是通过Sevag法去除蛋白,其主要组分为多糖类物质,由此可见,康宁木霉发酵产生的多糖类物质为主要诱导组分,能够明显诱导增强菌株MY02的抗真菌活性。
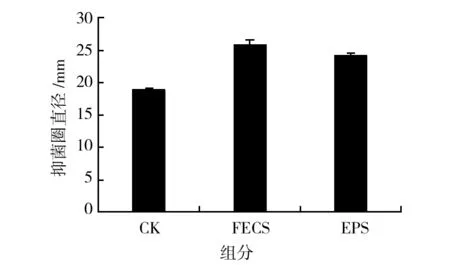
图6 诱导菌株发酵液不同组分对菌株MY02抗真菌活性的影响Fig.6 Effect of different components of induced strain fermentation broth on antifungal activity of strain MY02
3 讨 论
目前,关于真菌诱导子作用机制的研究多集中于对植物次级代谢产物的诱导活性上,利用真菌诱导微生物积累次生代谢方面的研究却相对较少,对真菌诱导子与微生物细胞间相互作用的研究也相对滞后。但是近年来很多人对其进行了研究。梁楚欣等[8]报道,真菌诱导子以其独有的优势, 成为提高长春花中萜类吲哚生物碱含量的其中一种重要手段。而王红[9]报道,采用3种真菌诱导子,即大丽花轮枝孢(Verticilliumdahliae)、葡枝根霉(Rhiczopusstolonifer)和束状刺盘孢(Colletotrichumdematium)分别处理青蒿,3种真菌诱导子对青蒿发根生长和青蒿素生物合成有明显正向诱导的影响。黄曲霉真菌诱导子[10]对长春花形成层分生组织细胞内萜类吲哚生物碱产生的影响。王亚洲等[11]报道,产黄青霉真菌和黑曲霉真菌制备的类似于丁醇的诱导子能有效促进纳他霉素的合成。Wang[12]研究了真菌诱导剂对纳他链霉菌HW-2理化及微生物响应的影响。结果表明,诱导子能使干细胞重量(DCW)降低17.7%,提高了葡萄糖的利用率。李文渊等[13]报道了生物和非生物诱导子对丹参有效成分次生代谢具有诱导和调控作用。
Charusanti等[14]提出和病原菌的竞争会诱导链霉菌发生适应进化,从而产生新的抗生素来抑制病原菌的假说,利用基于竞争的自适应进化策略筛选产生新化合物或提高己有化合物产量的突变株。
目前,人们对康宁木霉的研究多集中在其高产纤维素酶和木聚糖酶等机制及应用研究上[15],而对其诱导链霉菌活性提高的研究则鲜有报道。本研究评价了康宁木霉对龟裂链霉菌MY02的诱导活性及其诱导组分的初步分析。其结果显示,当以康宁木霉和香菇真菌作为诱导菌株时,发现二者对MY02的抗真菌活性均具有明显的正向诱导作用。当以康宁木霉作为诱导菌时,其最佳诱导条件为接种量为2%,发酵36 h时为最佳添加时间。同时,通过初步分析可知,康宁木霉的诱导组分为发酵产生的多糖类物质。