Zn2+对EGCG的结构和抑菌活性的影响
2020-09-05苗嘉桐侯兴栋夏思远邓忆美付维哲孙铁英
苗嘉桐, 侯兴栋, 夏思远, 邓忆美, 付维哲, 孙铁英 , 姜 涛*
(1. 大连医科大学基础医学院 生物技术系,辽宁 大连 116044;2.大连医科大学 附属第二医院,辽宁 大连 116044)
结核病是由结核分枝杆菌引起的呼吸道传染病。据统计,2017年全球因结核病死亡人数达到130万,新发病例数约100万[1]。因此,成功研发新一代抗结核药是目前需要解决的难题之一。表没食子儿茶素没食子酸酯(Epigallocatechin-3-gallate, EGCG)是茶多酚的主要成分[2],在抗衰老、抗菌以及防治癌症等多方面具有重要作用[3]。但受自身理化性质的限制,其生物活性不能充分发挥,存在脂溶性差、生物利用率低、生理环境下不稳定和体内吸收缓慢等问题,在医药领域应用中受到限制。因此,对EGCG进行分子修饰已势在必行。茶多酚具有大π键的共轭体系强配位的氧原子与合适的空间构型,可以作为金属离子的良好配体,为茶多酚的分子修饰提供了理想的结构基础。目前研究表明,金属离子对茶多酚的抗氧化活性、抗肿瘤作用具有一定影响[4-6]。近年来研究证实,中草药中的有机成分与金属离子结合后,其生物活性提高,甚至可以产生新的药理作用[7]。锌是人体生长发育不可缺少的金属元素,广泛参与细胞代谢,是许多酶发挥活性的必要辅助因子,具有稳定蛋白质高级结构的作用,也被用作生物抗氧化剂。EGCG与锌盐反应后生成的化合物可能兼有EGCG和Zn的双重生物活性,使其应用更为广泛。前期研究发现,EGCG能够抑制耻垢分枝杆菌(Mycobacteriumsmegmatismc2155)的生长[8]。本研究发现,EGCG与LB液体培养基相互作用,诱发EGCG代谢物的产生。进而拟用锌盐制备EGCG金属化合物,揭示锌盐对EGCG结构、理化特性和生物学活性的影响,为EGCG的进一步研究开发提供线索。
1 材料与方法
1.1 材料
1.1.1 菌株来源 耻垢分枝杆菌Mycobacteriumsmegmatismc2155菌株(本实验室保存)。
1.1.2 主要试剂 绿茶(购自陕西省商南县);EGCG标准品(购自浙江乾盛康药业有限公司);醋酸锌二水合乙酸锌(分析纯AR500 g,西陇化工化学试剂公司)。
1.1.3 仪器与设备 Binary HPLC Pump高压液相色谱仪(JEOL);Hypersill BDS C18色谱柱(Thermo);pHs-3C型精密pH计(上海精密科学仪器有限公司);GSKP01隔水式电热恒温培养箱(湖北省黄石市医疗器械厂);FD-1B-50低温真空冷冻干燥机(北京博医康);RE-52AA旋转蒸发仪(上海亚荣生化仪器厂)。
1.2 方法
1.2.1 EGCG处理前后耻垢分枝杆菌生长曲线的测定 挑取M.smegmatismc2155/pSMT1单菌落,接种在5 mL含40 μg/mL潮霉素的LB液体培养基中,37 ℃孵育24 h。以LB培养基为对照(control),以终浓度为20 μg/mL EGCG的LB培养基为处理组,按1∶100接种菌液并在37 ℃培养,从第10小时起每4 h取出菌液200 μL,加入2 μL 1%的十二奎醛作为细菌荧光素酶的底物,铺在白色不透明的96孔板中进行荧光检测,用M.smegmatis/pSMT1校正过的线性标准曲线处理数据,绘制野生型耻垢分枝杆菌和20 μg/mL的EGCG处理下的生长曲线[9]。
1.2.2 HPLC和LC/MS方法检测EGCG的含量和结构 野生型耻垢分枝杆菌中加入终浓度为20 μg/mL的EGCG,37 ℃培养48 h,每间隔6 h取6 mL菌液,其中5 mL菌液进行100 W 超声2 s,间隔2 s,共5次超声处理。分别进行8 000 g离心10 min,保留上清备用。利用Hypersill BDS C18色谱柱系统检测EGCG的含量。洗脱程序如下:流动相A,2%乙酸;流动相B,乙腈;检测波长280 nm;柱温35 ℃;流速0.8 mL/min;加样量10 μL。用LB培养基配制EGCG标准品作为对照,浓度0.02 mg/mL,0.22 μm微孔滤膜过滤后按HPLC洗脱程序进行操作。利用HPLC检测EGCG的含量,LC/MS方法鉴定耻垢分枝杆菌处理18 h后EGCG的结构变化。
1.2.3 EGCG-Zn2+的化学合成及紫外吸收分光光度法鉴定 将0.65 g的EGCG标准品溶于10 mL蒸馏水中,采用pHs-3C型精密pH计,加入1 mol/L的NaHCO3溶液调节pH为7[10],在磁力搅拌器搅拌下缓慢加入1.25 g锌盐,反应30 min,静置30 min,然后过滤,洗涤。洗涤后的上层清液用NaHCO3检验直至无沉淀生成,经抽滤过后,得到深红褐色产物,用玻璃棒小心剥离,烘干后得产物。通过化学试剂沉淀法,将所得到的深红褐色产物用稀H2SO4溶解后,取少量在试管中,加入NaHCO3溶液,观察试管中沉淀情况,进行初步鉴定。多酚类物质由于含有苯环结构,对其进行检测通常采用紫外吸收光谱法。将EGCG标准品和化学合成所得的深红褐色产物,分别以无水乙醇稀释,使其终浓度均为3×10-5mol/L,在200~300 nm之间,每隔10 nm测其吸光度,并绘制曲线。
1.2.4 纸片琼脂扩散法检测抑菌作用 将EGCG标准品和化学合成产物分别用甲醇配制成浓度为2 mg/mL的储存液,经0.22 μm滤器过滤除菌后,加入EP管中保存备用。然后在每个EP管中放入灭菌后的滤纸片,浸泡过夜,第2天放入烘箱烘干,于4 ℃保存备用。按1∶200稀释耻垢分枝杆菌菌液,取50 μL菌液滴于平板上,均匀涂抹,在平板上小心放入之前准备好的滤纸片,并进行相应标记。平板经室温放置5 min后,倒置于37 ℃恒温培养48 h,观察EGCG和EGCG-Zn2+作用下的抑菌圈大小,上述实验重复3次。
2 结果与分析
2.1 EGCG对耻垢分枝杆菌的抑制作用
由图1可知,与对照组(control)相比,20 μg/mL的EGCG处理组对耻垢分枝杆菌生长具有明显抑制作用,EGCG处理10 h后出现抑制作用,18 h抑制作用最为明显,18 h以后抑制作用明显减弱。
2.2 耻垢分枝杆菌培养基中EGCG含量变化
随着EGCG处理时间延长,耻垢分枝杆菌培养基上清中EGCG含量逐渐下降,直到30 h后,培养上清中不能检测到EGCG。EGCG处理耻垢分枝杆菌后30 min 培养上清中EGCG含量出现明显变化,推测EGCG可能与耻垢分枝杆菌细胞壁相互结合有关。利用超声处理方法,使其黏附于细胞壁上的EGCG重新释放到培养基中,再进行检测。分别取EGCG处理后6、18和24 h的样品进行超声处理后进行HPLC检测。结果表明, EGCG处理6 h后,超声处理前后培养上清中EGCG含量无明显变化; EGCG处理18 h后,超声处理导致培养基中EGCG含量明显变化(图2)。由此可见,培养基中EGCG含量的减少可能是因为EGCG黏附在细胞壁的表面,也可能经过代谢或与其他离子结合而使特定结构的EGCG含量减少[11]。
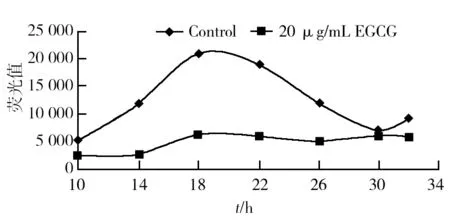
图1 EGCG处理的耻垢分枝杆菌的生长曲线
2.3 耻垢分枝杆菌培养基中EGCG的结构变化
EGCG的分子量为458.4。LC/MS结果表明,EGCG对照组在m/z为457 [M-H]-处出现明显峰值,与相应分子量的EGCG相对应。
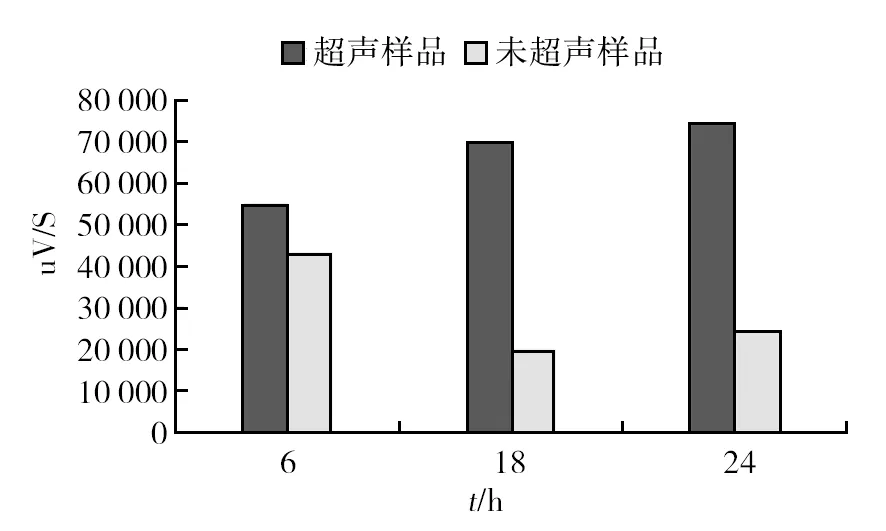
图2 超声处理前后的培养基中EGCG含量比较分析Fig.2 The comparative analysis of EGCG content in culture mediumbefore and after ultrasonic treatment
EGCG与耻垢分枝杆菌作用后,EGCG质谱图中,在1.18、3.35、3.53 min 三个时间点出现峰值分别进行质谱鉴定。与对照组相比,m/z出现127.8、199.1、382.9、453、473以及489特异性峰值。这些分子可能是EGCG与LB培养基中离子结合后的产物,如473[M+OH]-等,也有可能是EGCG的代谢产物。为验证EGCG的离子结合能力及其影响,选用锌离子做进一步研究。
2.4 EGCG-Zn2+的化学合成及分析
经一系列化学反应后,得到深红褐色产物,初步鉴定为EGCG-Zn2+,但其中含有大量白色固体,应为未反应的乙酸锌或碳酸锌。经分离称量,本研究中,EGCG-Zn2+合成率为16.3%。紫外吸收光谱法鉴定结果表明,高于200 nm处的较强吸收是由于芳环中π-π*跃迁引起的,是芳香化合物的特征吸收带,众多的酚羟基是影响EGCG紫外吸收的主要因素。EGCG分子结构中存在较多的酚羟基,它的λmax出现在波长200~300 nm。
EGCG标准品与EGCG金属化合物的最大吸收波长和吸收强度有所不同,但EGCG-Zn2+在紫外光区仍有明显的酚羟基吸收(图3)。研究结果表明,EGCG和EGCG-Zn2+的紫外吸收光谱明显不同,也证明了EGCG-Zn2+的合成。进一步HPLC分析显示,EGCG标准品的主要峰值保留时间为6.621 min,峰面积所占比例为46.98%;而EGCG-Zn2+主要峰值保留时间为9.079 min,峰面积所占比例为47.98%(图4)。所以,EGCG与Zn2+作用后,出峰时间明显变化。
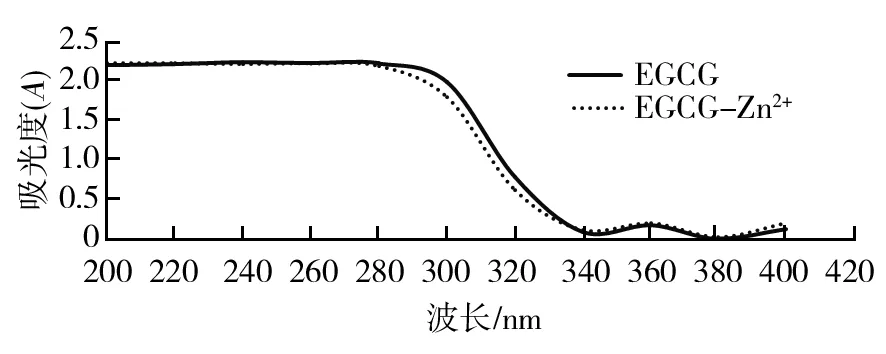
图3 EGCG和EGCG-Zn2+的紫外吸收光谱Fig.3 The ultraviolet absorption spectrum of EGCG and EGCG-Zn2+
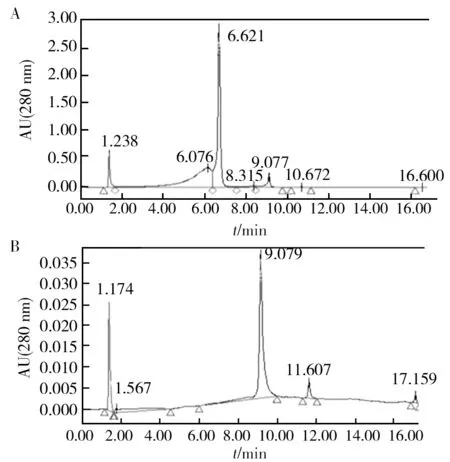
图4 EGCG和EGCG-Zn2+的HPLC分析
2.5 EGCG和EGCG-Zn2+抑菌作用的比较
采用纸片琼脂扩散法比较EGCG与EGCG-Zn2+对耻垢分枝杆菌抑菌作用。结果表明,2 mg/mL的EGCG标准品和2 mg/mL的EGCG-Zn2+均出现抑菌圈现象,抑菌圈直径分别为16 mm和12 mm。表明在该浓度下,EGCG-Zn2+对耻垢分枝杆菌具有一定的抑菌作用,但其抑菌作用明显弱于EGCG标准品。
3 讨 论
近年来,茶多酚的抗突变、抗肿瘤、抗病毒、抗炎和抗氧化等生物活性研究已被广泛报道,但EGCG金属化合物的生物学活性研究报道较少。最近研究发现,天然产物或药物经金属离子修饰后活性发生变化[12-13]。许多金属离子对于人体的正常生长发育是至关重要的,而天然产物或药物经金属离子修饰后可能兼顾两者的性质,达到更好的作用效果[14]。例如,纳豆激酶(Nattokinase,NK)是一种新型食源性纤溶酶,具有很强的溶血栓作用,实验证实,经Mg2+修饰,提高了纳豆激酶的活性,增强了其稳定性[15]。另外,金属离子修饰糖类化合物后可作为食品功能因子广泛应用于食品工业和农业,具有无污染、水溶性好、阴离子性等特性,是生物体金属补充剂的很好选择,具有重要生物意义[16]。
耻垢分枝杆菌是结核分枝杆菌的模式菌,具有相似的细胞壁结构。前期研究表明,绿茶粗提物及其主要成分EGCG能抑制耻垢分枝杆菌的生长[8]。本研究表明,EGCG的含量和结构容易受内外因素影响,在耻垢分枝杆菌培养液中,发现了EGCG的不同代谢物,在Zn离子作用下,EGCG出峰时间延长,说明其结构可能发生变化。而锌是一种重要的微量元素,正常人体内含锌约2~3 g,它对于人体正常成长和发育是必不可少的[15]。已有资料表明,锌盐已作为一种药物应用于临床[16]。将锌盐与EGCG结合形成新型EGCG来研究对耻垢分枝杆菌的抑菌作用将对EGCG的进一步开发利用提供参考。研究结果表明,EGCG-Zn2+对耻垢分枝杆菌具有抑菌作用,但该作用明显减弱。有文献报道,在体外抗氧化实验中,茶多酚锌的抗氧化能力明显强于茶多酚[17]。因此,锌盐虽然加强了EGCG的抗氧化能力,但却降低了其对耻垢分枝杆菌的抑菌作用,这些都为今后研究新型EGCG金属化合物,如EGCG-Ag+提供了思路。
1965年,Moyer研究发现硝酸银溶液对葡萄状球菌、链状球菌等有抗菌活性[18]。用途最广的是磺胺嘧啶银,它作为一种抗菌剂被广泛用于严重烧伤时的抗菌消毒以防止细菌感染[19-20]。霍正禄等[21]合成了新的外用抗菌药物氟哌酸银,它具有强大的广谱杀菌作用。因此,Ag离子可能会大大加强EGCG的抑菌作用,为将来研究新型抗结核病药物(EGCG-Ag+)制剂提供了宝贵的思路。