成人原发肾病综合征并发急性肾损伤危险因素分析
2020-09-04周燕琳杜晓刚
周燕琳,杜晓刚
重庆医科大学附属第一医院肾内科,重庆 400042
肾病综合征常常并发急性肾损伤(acute kidney injury,AKI)。研究显示儿童AKI发生率0.8%~58.6%[1],而成人AKI发生率也高达44.9%[2]。但事实上,由于既往诊断急性肾衰竭的标准遗漏掉AKI早期的部分患者,故根据改善全球肾脏病预后组织(Kidney Disease Improving Global Outcomes,KDIGO)指南,肾病综合征继发AKI的实际发病率可能会更高。一旦肾病综合征继发AKI,不仅可导致患者住院时长、医疗费用及死亡风险增加[3],而且可能会延缓肾病综合征达到完全缓解时间[4];此外,AKI也是导致肾病综合征进展成慢性肾脏病的独立危险因素[5]。关于肾病综合征患者继发AKI的机制尚不完全明确,目前认为AKI的发生可能与肾内缺血、肾间质水肿、肾小球本身病变、肾小管坏死、药物相关性间质性肾炎等因素有关[6],大部分研究为儿童患者。而儿童肾病综合征的临床特点与常见病理类型与成人区别很大,且成人肾病综合征合并AKI的风险与其肾脏的病理特征变化之间关系的报道较少。本研究回顾性分析本院成人原发性肾病综合征(primary nephritic syndrome,PNS)合并AKI患者的临床病理特点,进一步了解AKI发生的高危因素,为临床早期发现PNS继发AKI并及早防治提供指导。
对象和方法
对象回顾性搜集2013年1月1日至2018年12月31日在重庆医科大学附属第一医院肾内科出院诊断为PNS的患者,排除标准:(1)年龄<18岁或>80岁;(2)妊娠期女性;(3)合并恶性肿瘤;(4)未行肾活检明确病理类型;(5)继发性肾病综合征;(6)临床资料缺失过多。AKI的诊断标准:根据2012年KDIGO指南[7],符合以下任一标准即可诊断AKI。(1)48 h内血肌酐(serum creatinine,Scr)升高绝对值>26.5 μmol/L;(2)确认或推测7 d内Scr升高>基线值的1.5倍;(3)每小时尿量<0.5 ml/kg,且持续6 h以上。Scr基线值定义为入院前3个月的最小值,若无法获得,则取住院期间的最小值。AKI分级按照KDIGO标准:AKI 1级:Scr增加到基线值的1.5~1.9倍或增加量≥26.5 μmol/L;2级:Scr增加到基线值的2.0~2.9倍;3级:Scr增加到基线值的3倍以上或大于354 μmol/L或开始肾脏替代治疗。
临床资料(1)一般情况:住院号、姓名、年龄、性别。(2)基础疾病:高血压、糖尿病、既往心血管疾病(冠状动脉粥样硬化性心脏病、心力衰竭等)、肝脏疾病、有无感染等。(3)实验室指标:血红蛋白、随机尿蛋白、24 h尿蛋白定量、白蛋白、尿素氮、入院时Scr、基线Scr、住院期间Scr达到最高水平、尿酸、总胆固醇、三酰甘油、D-二聚体、纤维蛋白降解产物等。(4)发生AKI前用药史:血管紧张素转化酶或血管紧张素受体抑制剂类药物、利尿剂、中药、非甾体类抗炎药、质子泵抑制剂、抗生素(氨基糖苷类)、抗血小板药(阿司匹林、氯吡格雷及双嘧达莫等)、抗凝药(华法林、低分子肝素等)、免疫抑制剂(环孢素、他克莫司等)、造影剂等肾毒性药物。(5)病理类型及病理特点由解放军福州病理诊断中心诊断并报告。
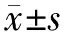
结 果
一般情况共收集185例原发性肾病综合征患者资料,其中51例继发AKI(27.6%),与非AKI组比较,PNS合并AKI组患者年龄差异无统计学意义(P=0.568);但AKI组的男性占80.4%,明显高于非AKI组(47.8%)(P=0.000)(表1)。
入院时临床特征纳入的全部患者临床上未合并休克、肾静脉血栓、脓毒血症、心力衰竭、肝衰竭等疾病。PNS患者合并AKI的分级显示,AKI 1级占16.8%,2级占4.3%,3级占6.5%。与非AKI组相比,AKI组合并高血压、感染的比例更高(P=0.035,P=0.000),但合并糖尿病的比例差异无统计学意义(P=0.064)。与非AKI组相比,AKI组患者入院时少尿及多浆膜腔积液表现更常见(P=0.002,P=0.000),且其血清白蛋白水平更低(P=0.015),随机尿蛋白定性(4+)比例更高(P=0.030),入院时的血肌酐、尿素氮及尿酸、三酰甘油水平均较高(P=0.000,P=0.000,P=0.000,P=0.006);但24 h尿蛋白定量、总胆固醇、血红蛋白、D-二聚体、纤维蛋白降解产物水平之间差异无统计学意义(P=0.133,P=0.437,P=0.348,P=0.123,P=0.272)(表1)。
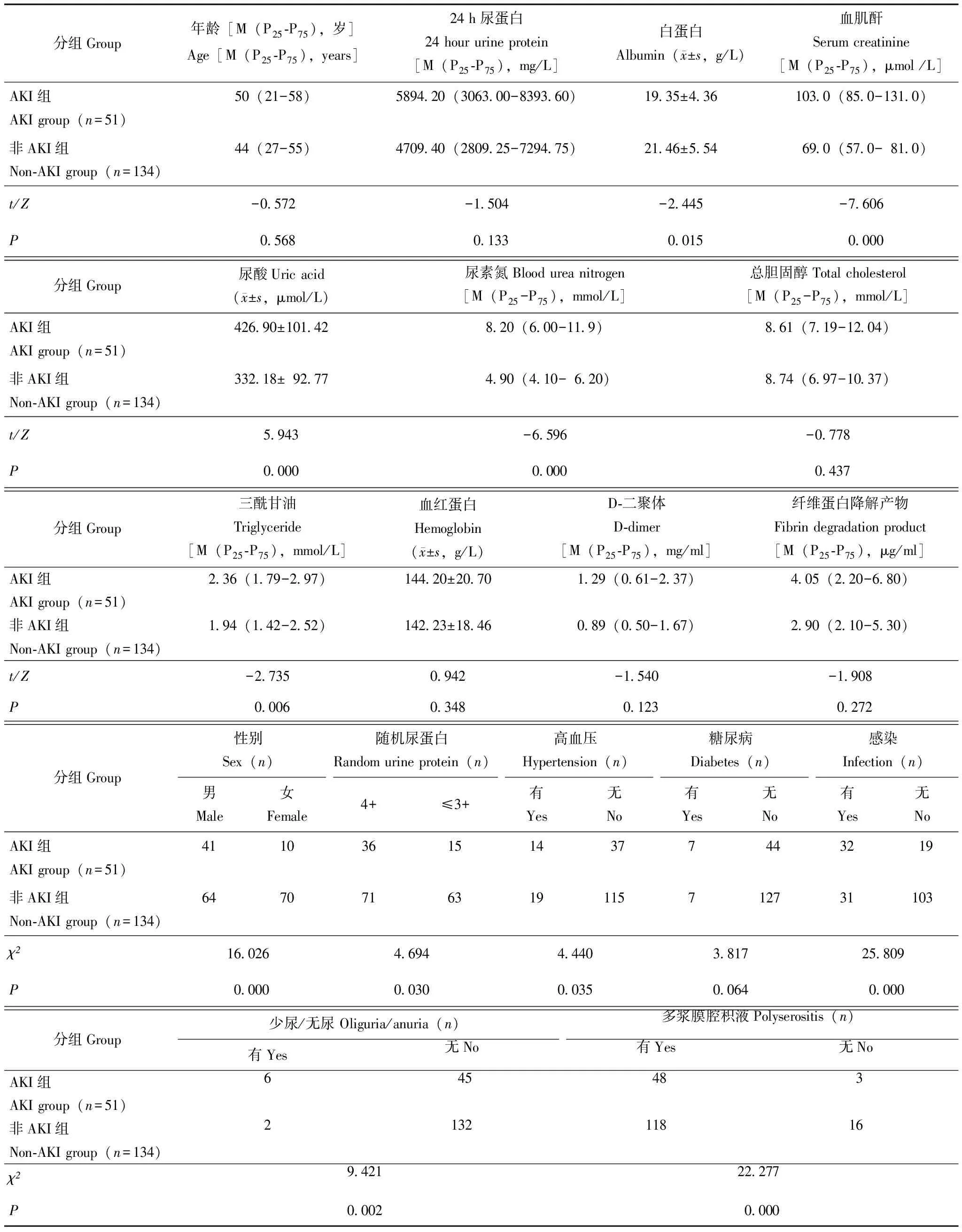
表1 PNS患者AKI组与非AKI组基础临床特点比较
AKI发生前用药情况所有PNS患者发生AKI前均无造影剂、中药、非甾体类抗炎药、氨基糖苷类等肾毒性药物使用;AKI组与非AKI组患者使用血管紧张素转化酶或血管紧张素受体抑制剂、质子泵抑制剂、环孢素及他克莫司等药物差异无统计学意义(P=0.134,P=0.225,P=0.686),但AKI组使用利尿剂、抗血小板药物的比例更高(P=0.018,P=0.017)(表2)。未发现AKI组患者使用华法林、低分子肝素等抗凝药物。

表2 AKI组AKI发生前与非AKI组用药情况比较(n)
肾脏病理特征发生AKI的病理类型依次为肾小球轻微病变(29.4%)、IgA肾病(25.5%)、膜性肾病(17.6%)(表3)。其中肾小球病变包括肾小球硬化、壁层细胞、足细胞、基膜、毛细血管丛病变等病理表现,AKI组与非AKI组差异无统计学意义(P均>0.05);此外,AKI组发生的肾小管间质病变包括肾小管萎缩、上皮细胞浊肿及玻璃小滴、肾间质纤维化、间质炎细胞浸润等情况的比例与非AKI组相比差异也无统计学意义(P均>0.05)。但是与非AKI组相比,AKI组出现肾小管蛋白管型、上皮细胞空泡变的比例更高(P=0.004,P=0.030)(表4)。
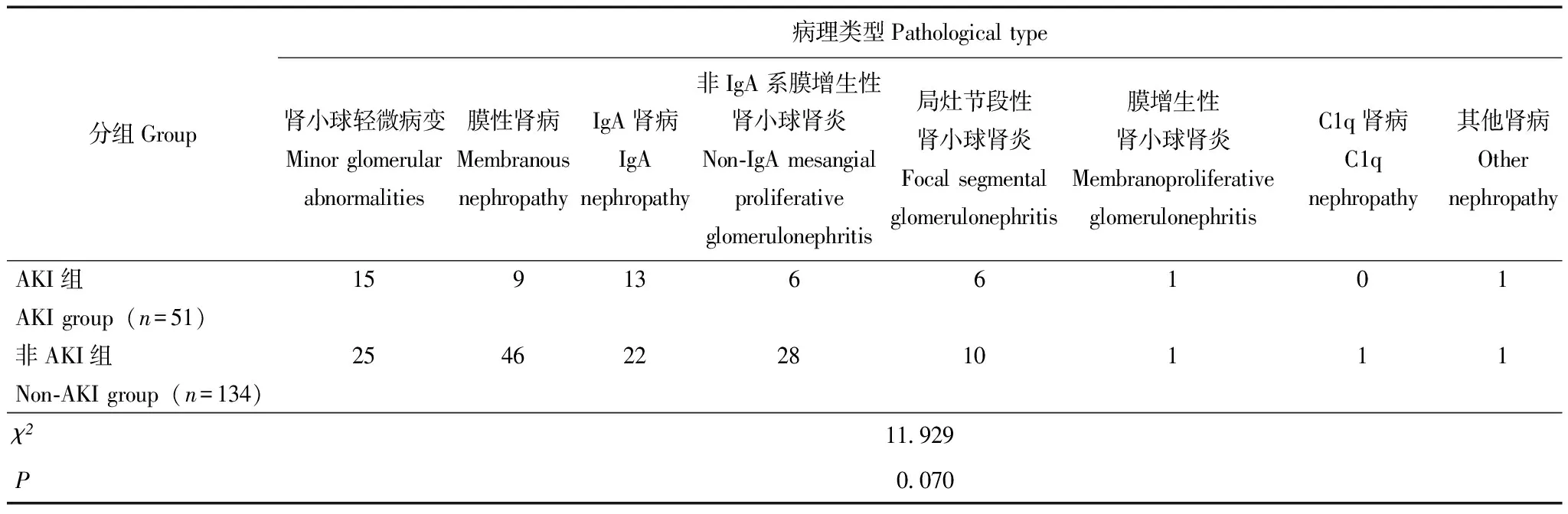
表3 PNS患者AKI组与非AKI组病理类型比较(n)

表4 PNS患者 AKI组与非AKI组病理特点比较(n)
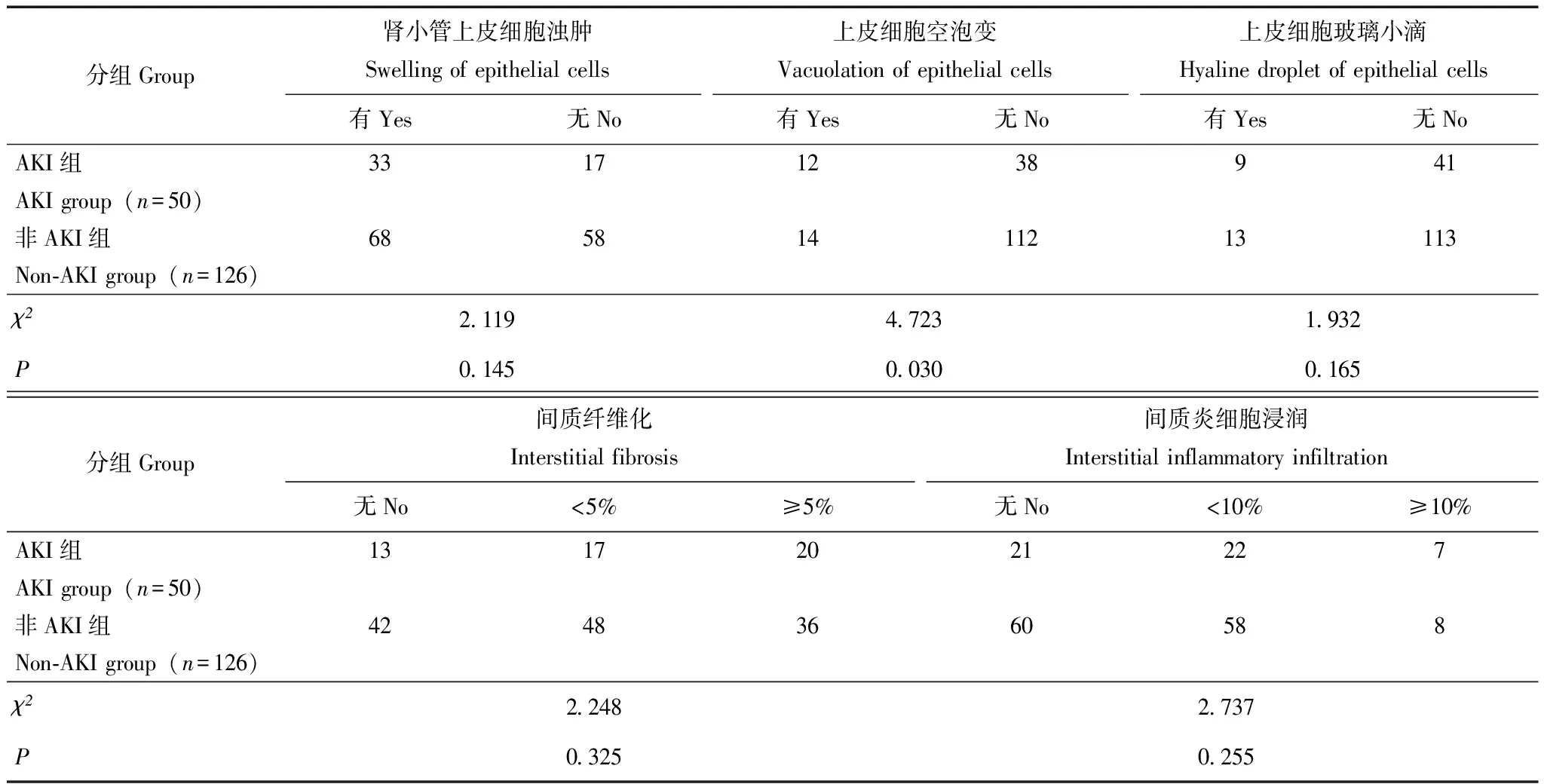
续表4
AKI组危险因素分析筛选单因素分析有统计学意义的自变量或者差异无统计学意义但临床上认为与因变量有关的自变量,将单因素分析的P值放宽至0.1。以是否合并AKI分组为因变量,最后共有性别、高血压、糖尿病、感染、少尿或无尿、多浆膜腔积液、随机尿蛋白、白蛋白、血肌酐、尿酸、尿素氮、三酰甘油、使用利尿剂、抗血小板药物、肾脏病理类型、肾小管蛋白管型、肾小管上皮细胞空泡样变等17项自变量,其中血白蛋白、血肌酐、尿酸、尿素氮、三酰甘油水平为连续变量,根据计算的截点转换为有序分类变量,截点分别为25 g/L、96 μmol/L、400 μmol/L、6.8 mmol/L、2.3 mmol/L;将上述17项自变量纳入多因素Logistics回归分析,采用逐步前进法,分析结果显示白蛋白(<25 g/L)、血肌酐(>96 μmol/L)、尿素氮(≥6.8 mmol/L)、尿酸(≥400 μmol/L)、糖尿病、感染、肾小管蛋白管型是影响AKI发生的独立危险因素(表5)。
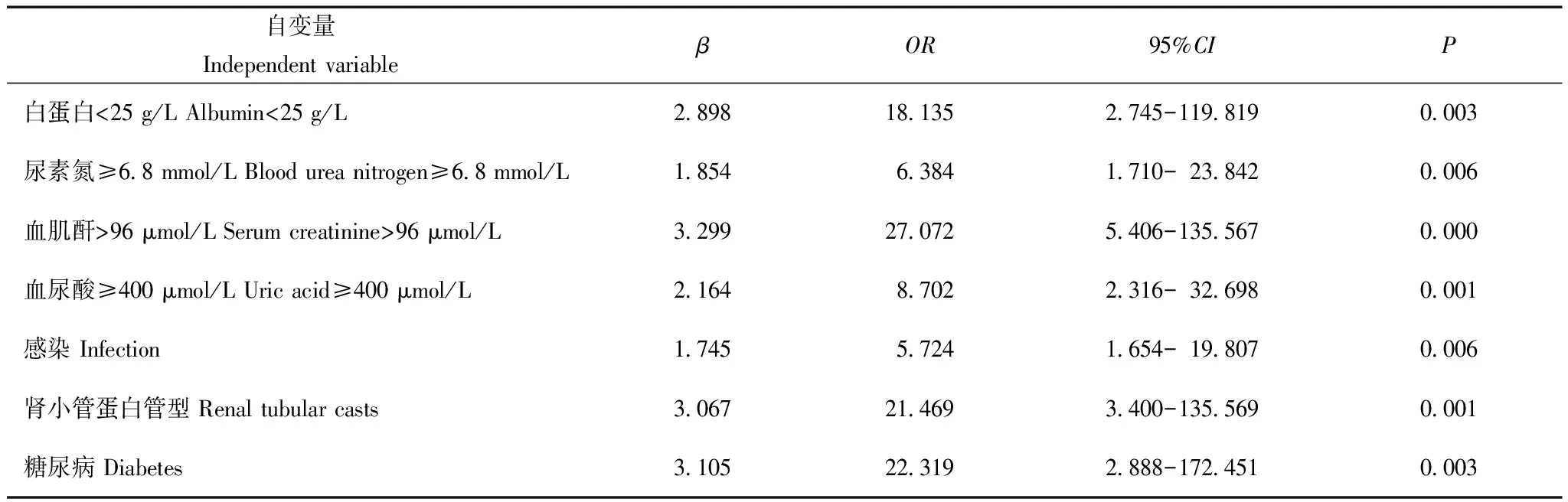
表5 PNS患者发生AKI的多因素Logistics回归分析
讨 论
AKI作为PNS常见的并发症之一,严重者可影响患者的预后[3- 5]。本研究纳入的成人PNS患者并发AKI占27.6%,提示成人PNS发生AKI的比例并不低。因此,及早发现PNS患者发生AKI的相关危险因素,对于早期诊断和防治PNS继发AKI具有重要价值。
关于性别对PNS继发AKI的影响,目前尚无定论。KDIGO指南认为,女性是医院获得性AKI的危险因素[7],但在Neugarten和Golestaneh[8]纳入的21篇关于医院获得性AKI文章的Meta分析中,发现男性比女生更易发生AKI。在成人PNS合并AKI的研究中发现,男性是独立危险因素[9- 10]。本研究也提示男性发生AKI比例更高,但并非其危险因素,故关于性别与AKI之间的关系需进一步探讨。
各种病理类型的PNS患者均可继发AKI。本研究显示发生AKI的常见病理类型依次为肾小球轻微病变(minimal change disease,MCD)(29.4%)、IgA肾病(25.5%)、膜性肾病(17.6%)。也有研究表明成人MCD最易发生AKI,发生率25%~35%[11]。Meyrier和Niaudet[12]总结1993至2017年发表的13篇关于MCD伴发AKI的文献,结果显示MCD患者AKI发生率为33%(235/716),是肾病综合征易于发生AKI最多的病理类型,与本研究报道结果较一致。本研究同时报道了不同病理类型的肾病综合征患者包括膜性肾病、系膜增生性肾小球肾炎、局灶节段性肾小球肾炎继发AKI的发生情况。目前关于具体肾脏病理特征与PNS继发AKI关系的研究仅有些零星报道,比如Meyrier和Niaudet[12]研究显示,病理损害存在肾小管缺血性坏死为AKI发生的危险因素。本研究肾脏病理分析显示肾小管蛋白管型为PNS继发AKI的独立危险因素,病理上发现有蛋白管型者,可使肾病综合征发生AKI风险增加21.469倍。
肾病综合征继发AKI病因主要包括新月体肾炎、急性肾小管坏死、急性间质性肾炎(主要为非甾体类抗炎药引起)、造影剂肾病、抗凝药物(华法林)相关性肾病、肾静脉血栓、肾毒性药物如钙调磷酸酶抑制剂、氨基糖苷类药物等[11]。在儿童肾病综合征患者中,肾毒性药物仍为重要危险因素[13- 14]。本研究进一步行Logistic回归分析显示,白蛋白<25 g/L、血肌酐>96 μmol/L、尿素氮≥6.8 mmol/L、尿酸≥400 μmol/L均为PNS继发AKI的危险因素。与血清白蛋白水平≥25 g/L的患者比较,白蛋白水平<25 g/L的PNS患者AKI发生风险增加18.135倍。Chen等[9]的研究也显示白蛋白水平每降低10 g/L,AKI风险增加4.97倍。PNS患者表现为严重的低蛋白血症,主要由于大量蛋白尿的漏出,而这些蛋白尿与肾功能损害密切相关,可增加AKI发生[15],其机制可能与尿蛋白可激活补体,促进趋化及细胞因子表达,引起内质网应激、细胞凋亡,损伤肾小管有关[16]。本研究显示AKI组与非AKI组之间24 h尿蛋白水平尽管差异无统计学意义,但AKI组出现肾小管蛋白管型比例更高,表明严重低蛋白血症的PNS患者由于有更多的蛋白尿及其蛋白管型,参与了AKI的发生。此外,PNS患者由于血容量相对不足、利尿剂使用、肾功能异常、脂代谢紊乱,常发生高尿酸血症[17- 19],而Meta分析也显示高尿酸血症可使非肾病综合征患者AKI发病风险增加2.24倍[20]。本研究进一步证实PNS患者入院时血清尿酸≥400 μmol/L是AKI发生的危险因素。高尿酸血症可激活肾素-血管紧张素-醛固酮系统影响肾脏血流动力学导致肾缺血,也可损伤内皮细胞及肾间质;此外,血尿酸水平急剧升高可在肾小管中形成尿酸结晶堵塞肾小管或压迫远端肾血管,均导致AKI发生[21]。
PNS患者临床合并症也与其AKI发生有关。首先,PNS患者常发生感染,这与患者细胞免疫缺陷、免疫球蛋白IgG及补体因子丢失相关[22]。本研究显示,感染也是PNS患者发生AKI的危险因素,可使PNS患者发生AKI风险增加5.724倍。PNS患者肾脏大部分处于水肿、缺血状态,在此基础上,感染可能通过免疫炎性反应、氧化应激损伤等过程进一步加重肾脏缺血缺氧、肾小管损伤、影响肾脏修复[23],促使PNS患者AKI发生。其次,研究证实高血压、糖尿病均为AKI发生的危险因素,糖尿病尤其糖尿病肾病为AKI的高危因素[24],但是对于PNS患者,高血压和糖尿病对AKI的影响目前尚不清楚。本研究首先采用单因素分析,结果显示AKI组高血压比例显著高于非AKI组(P=0.035);而两组之间糖尿病差异无统计学意义(P=0.064),此不排除样本量较小所致。因此,本研究在进一步采用多因素Logistics回归分析时,将P值放宽至0.1,扩大范围筛选可能的危险因素,结果证实糖尿病也是PNS患者发生AKI的独立危险因素(OR=22.319,95%CI=2.888~172.451)。高血糖可诱导肾脏细胞合成内皮素- 1增加,可进一步加重肾脏组织缺血[25],增加PNS患者AKI发生风险。基于上述多因素Logistic回归分析得出的独立危险因素,可为PNS患者早期发现、尽早干预及积极治疗AKI提供参考,对于改善患者预后具有较好的价值。
综上,本研究探讨成人PNS并发AKI的临床病理特征,结果显示入院时白蛋白、血肌酐、尿素氮及尿酸水平、糖尿病、感染、肾小管蛋白管型为其独立危险因素,对原发肾病综合征患者并发AKI发生风险的预测具有一定的临床价值。但本研究仍有一定的局限性,因纳入对象排除未行肾活检患者,导致AKI发生率与实际存在差异;且为单中心回顾性队列研究,预测模型还有待多中心大样本数据进一步验证;此外,本研究仅提取AKI发生前相关数据,未进行长期随访分析,对于AKI治疗方式选择及影响预后的危险因素需进一步研究。
