自体腹膜移植回肠浆肌扩大原位膀胱的重建
2020-09-04宋志强沈海山李春峰阮英卯李胜文
沈 俊,宋志强,沈海山,李春峰,阮英卯,李胜文
1贵州医科大学附属医院泌尿外科,贵阳 550004 2清华大学第一附属医院泌尿外科,北京 100016 3清华大学第一附属医院病理科,北京 100016
肠管是用于膀胱重建的主要组织材料,广泛应用于临床上。由于肠黏膜具有分泌和吸收功能,尿液与肠黏膜慢性相互作用,使得肠代膀胱术后仍然存在不同程度诸多并发症,比如代谢紊乱、肠黏液增多堵塞尿道及恶性肿瘤形成或复发等。为探求一种理想的肠代膀胱重建的方法,以减少肠代膀胱术后的并发症,本研究采用腹膜取代肠黏膜建立了自体腹膜移植回肠重建膀胱的小型猪实验模型,并对其进行形态学、动力学和病理组织学等方面的研究。
材料和方法
材料采用封闭饲养的成年(6~8个月)实验用小型猪6只,雌性,体重28~33 kg(由贵州医科大学动物实验中心提供,购于北京市琉璃河科兴实验动物养殖中心。又名:中华小型猪,北科源实验用小型猪。产地:北京房山。种系来源:贵州小型猪)。CAT307尿流率膀胱测压管(Medical Technologies Canada ULC),AQUARIUSXLT尿动力检查仪(加拿大Laborie公司),PLX5200可移动X光机(南京普朗医疗设备有限公司),JSM5510扫描电子显微镜(日本),TEM1010/JEM1010透射电子显微镜(日本)。一抗钙网膜蛋白、抗波形丝蛋白、CK7和UPK3鼠抗人单克隆抗体,二抗(抗兔和鼠IgG)及S-P试剂盒均为美国Jackson公司产品,购自北京中杉金桥生物技术有限公司。DAB酶底物显色试剂盒由清华大学第一附属医院病理科提供(购自中国五联化工厂,上海)。MASSON特染试剂盒:北京阜外医院病理科提供。
方法术前准备:术前24 h禁食,10 h禁饮;麻醉后备皮;同时建立耳背静脉通道,输液(生理盐水100 ml+头孢呋新0.75 g,术前/后各用1次,5%葡萄糖注射液500 ml);手术方法:长段回肠浆肌剥离术(约35 cm)+大面积自体腹膜移植术[约(15×10)cm2]+膀胱次全切除术+原位膀胱扩大重建术;术后12周处死动物之前,采集血、尿样与术前采样进行对比分析研究,行尿流动力学及膀胱造影检查,处死动物后取出膀胱标本进行常规、分子病理学检测、MASSON三色特染以及电镜观察。
统计学处理两组间样本计量资料比较采用配对t检验进行统计分析,实验数据采用Stata- 13.0数据处理软件进行统计分析,P<0.05为差异有统计学意义。
结 果
一般情况6只实验用小型猪手术顺利完成,无一只动物死亡。手术切口未出现明显感染迹象,观察饲养期间无需拆线,实验动物术后均未见肠梗阻、尿瘘、腹膜炎等并发症发生。术后第5天拔除双侧输尿管导管,第7天拔除气囊尿管,观察动物排尿情况,发现祛除尿管后,动物均出现尿频,每0.5~1.0小时约1次,3 d后逐渐有所缓解,从肉眼观察尿液黄清。
尿常规及尿沉渣测定结果手术后12周测定实验用小型猪的尿常规显示其中的白细胞、尿比重与手术前尿常规结果比较差异均无统计学意义(P均>0.05)(表1)。直视下穿刺膀胱收集尿液,将之混匀后吸取10 ml置入离心管,通过离心机旋转沉降分层(3000转/min,转子半径5 cm,离心15 min),弃掉上清液,电子天平称重,减去离心管的质量得到尿沉渣的质量,再与术前进行对比,结果显示术前与术后尿沉渣质量差异无统计学意义(P>0.05),术后新膀胱无肠黏液分泌,也无结晶形成。
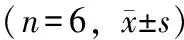
表1 术前与术后12周动物尿白细胞及尿比重比较
电解质、血清肌酐和尿素氮水平与手术前比较,手术后12周电解质、血清肌酐和尿素氨水平差异均无统计学意义(P均>0.05)(表2)。
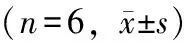
表2 术前与术后12周猪电解质、血清肌酐和尿素氮水平比较
手术前后动物膀胱造影经尿管注入200 ml碘海醇生理盐水稀释液(1∶1),拔除尿管,经阴道置入F26金属尿道探子(对比尿道长度),见正常膀胱充盈形态圆润光滑,尿道长约12 cm(距耻骨联合下方,尿道开口于阴道内);术后12周新膀胱充盈形态稍小,略显僵硬,顶部靠近前腹壁,可能与肠系膜牵拉有关,未见造影剂渗漏(图1)。
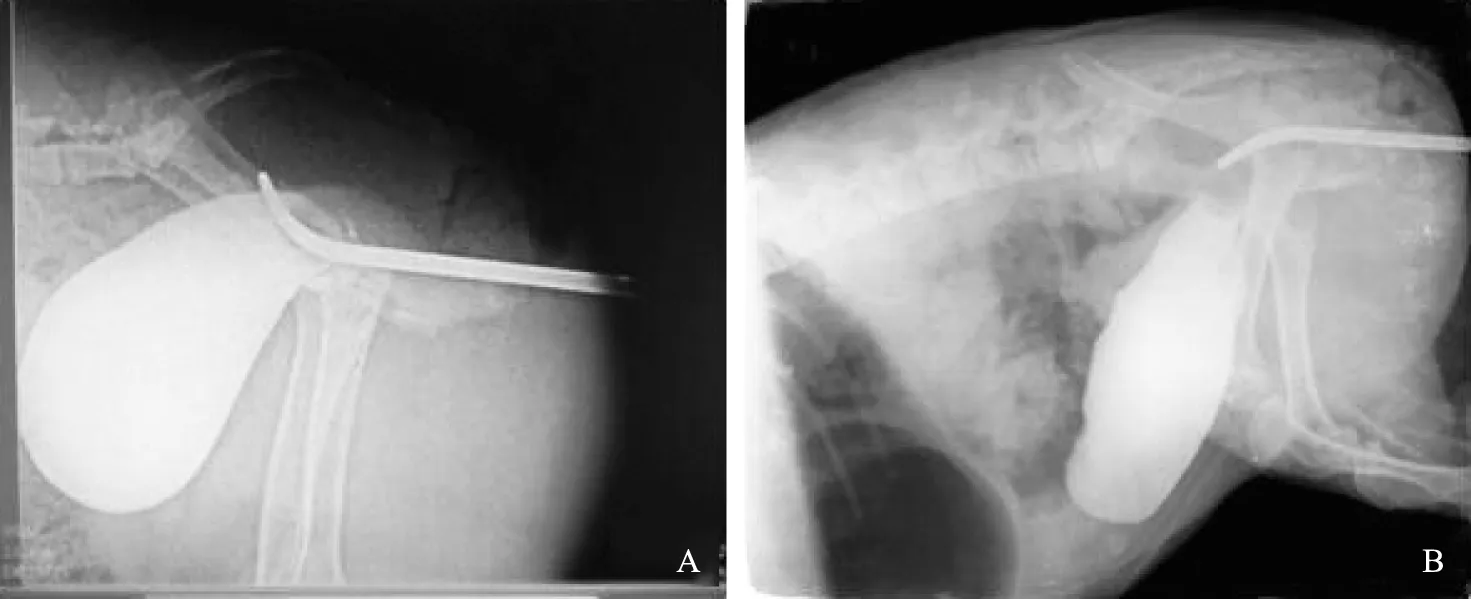
图1 手术前(A)与手术后12周(B)猪膀胱造影比较
手术前后动物膀胱压力容积术前动物膀胱容量平均为(587.17±22.31) ml,术后新膀胱平均容量(369.50±17.56)ml,两者比较差异有统计学意义(P=0.038),但膀胱顺应性却很接近(术前15.69±2.13比术后14.31±1.35,P=0.7173)(表3)。
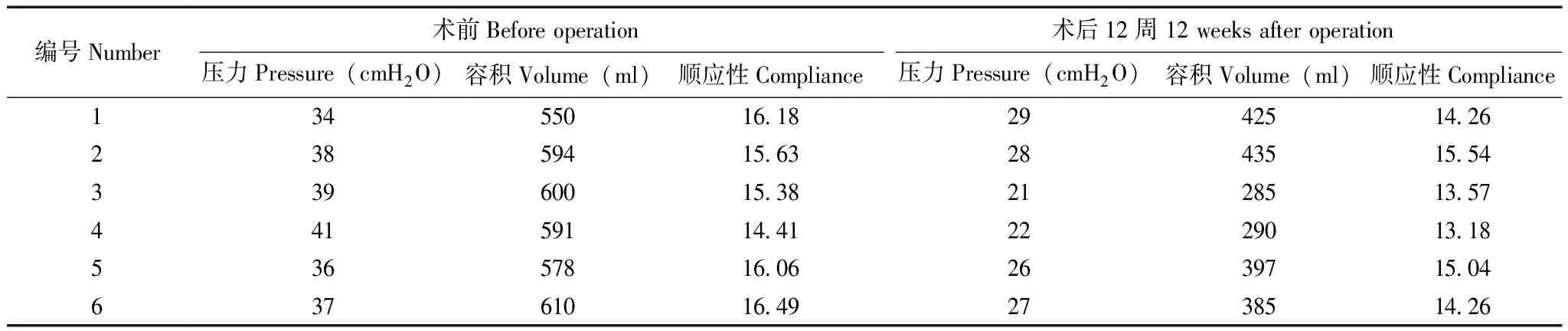
表3 手术前与手术后12周猪膀胱压力容积测定比较
病理显微组织观察结果术后12周分别麻醉处死6只动物,切除重建的新膀胱标本送检,结果显示HE染色后膀胱腔面表层上皮完整、连续,细胞层次排列有序,5~7层,与正常膀胱移行上皮类似,未见绒毛柱状上皮细胞及杯状细胞再生,黏膜下肌层结构清晰,可见新生毛细血管,未见明显中性粒细胞聚集;免疫组织化学反应显示未见自体移植腹膜;抗波形丝蛋白阴性表达,钙网膜蛋白阴性表达;而存活良好浆肌肠段上覆盖着5~7层膀胱尿路移行上皮细胞;上皮类特异抗体CK7染色强阳性,尿路移行上皮特异性抗体UPK3染色强阳性,上皮与肌层之间未见回肠黏膜上皮细胞与杯状细胞残留。MASSON染色显示平滑肌层结构清晰,腔面表层黏膜细胞呈复层移行上皮细胞,排列有序,连续性好,无断裂及错位,未见柱状或杯状细胞,肌层间未见明显胶原纤维增生(蓝绿色淡染),黏膜下可见毛细血管增生较明显(图2)。
电镜超微结构扫描电镜结果显示正常膀胱黏膜上皮细胞呈长梭形,边角圆润,细胞之间缝隙很小,排列致密(图3A)。术后12周新膀胱黏膜上皮整体结构完整,椭圆形的黏膜细胞,边角较圆钝,细胞个体之间的连接缝隙变小,排列整齐、疏松(图3B)。透射电镜观察显示,正常回肠平滑肌细胞呈梭形,细胞与细胞之间连接紧密,排列整齐,界限清楚,位于细胞中央的细胞核类似梭形,形态正常,点状致密斑清晰可见,基底膜完整,间质内仅见少许纤维细丝(图3C)。术后12周新膀胱肌纤维细胞的超微结构显示,平滑肌细胞呈梭形,排列整齐,未见明显肥大,基底膜和致密斑清晰可见,细胞浆成分无脱落,境界清,线粒体形态未见异常,无聚集,无肿胀,间质纤维丝无明显增生(图3D)。
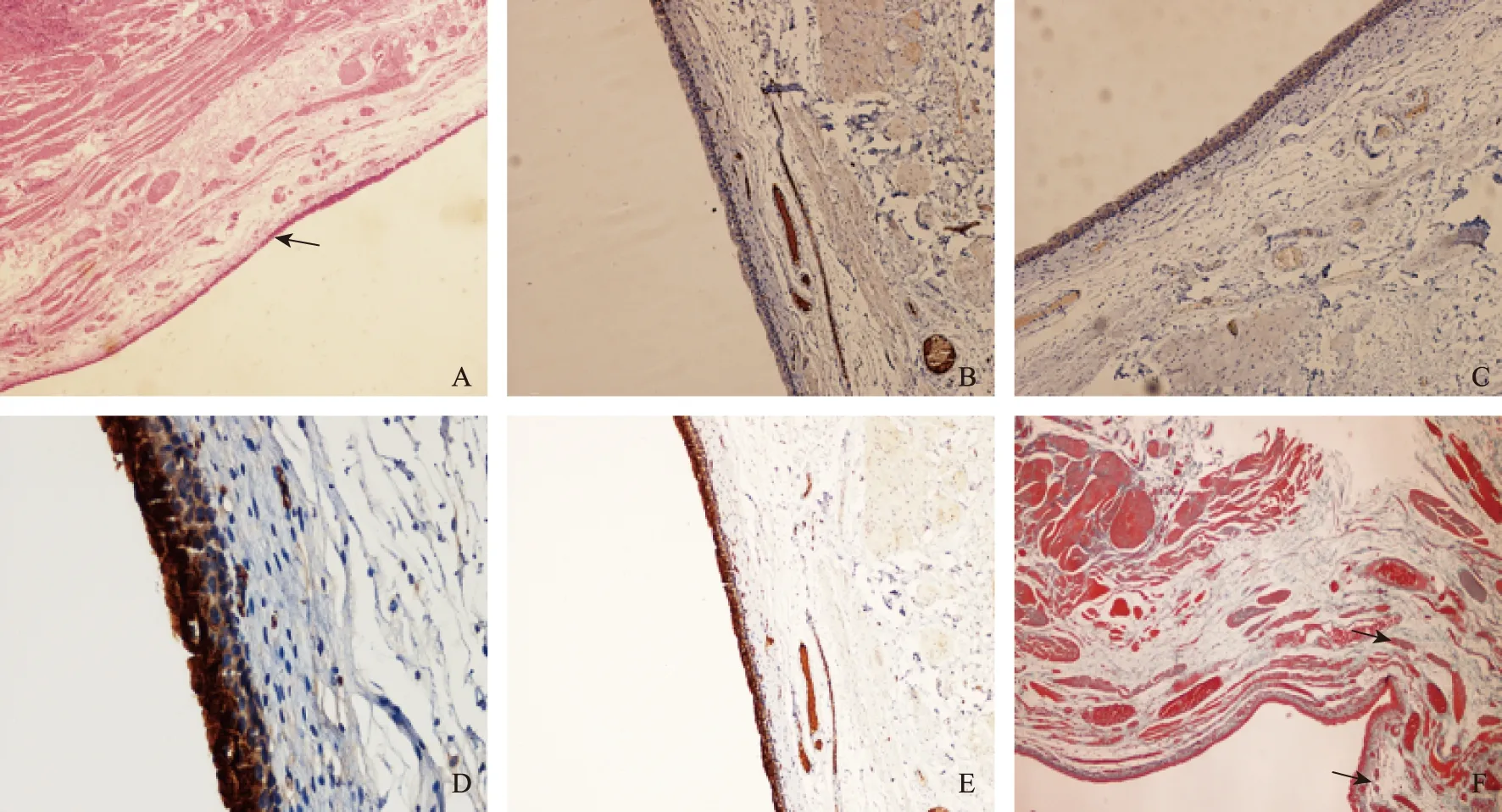
A.新膀胱黏膜上皮覆盖完整(箭头)(HE染色,×40);B.黏膜及黏膜下抗波形丝蛋白阴性表达(免疫组织化学,×100);C.黏膜及黏膜下钙网膜蛋白阴性表达(免疫组织化学,×100);D.CK7在新膀胱黏膜全层细胞强阳性表达(免疫组织化学,×200);E.UPK3在新膀胱黏膜表层细胞强阳性表达(免疫组织化学,×100);F.MASSON染色,黏膜下有毛细血管增生(箭头)(免疫组织化学,×40)

A.正常膀胱黏膜扫描电镜表现;B.术后12周新膀胱黏膜扫描电镜表现;C.正常回肠平滑肌细胞透射电镜表现;D.术后12周新膀胱平滑肌细胞透射电镜表现
讨 论
尽管原位肠代膀胱手术技巧日臻完善,但用来修复重建新膀胱的肠管本质未变,因而手术后与其相关的分泌及吸收所致并发症仍然困扰着临床医生与患者,尽管也有许多学者曾经想到破坏肠黏膜的方法,比如:用化学方法(酶/无水乙醇)破坏黏膜,或用机械方法刮除黏膜,以期减少肠黏膜的吸收与分泌,但效果均不尽如人意[1- 3]。相对于传统方式,本研究采用从腔外完整剥离回肠黏膜及黏膜下层,并用自体腹膜移植覆盖于回肠浆肌层制作成腹膜-回肠浆肌游离复合瓣修复扩大膀胱的方法,既可祛除术后相关并发症,又可保护剥离创面肌层免受尿液侵蚀与刺激,同时,重建新膀胱的形态及功能与变化差异不大。经同种动物实验研究显示,采用异体膀胱黏膜修复膀胱时,术后7周之内,移植黏膜存活良好,8周以后,移植物完全被自体膀胱黏膜替代[4]。同样,有学者在利用游离腹膜管重建长段黏膜剥脱输尿管的犬实验研究中发现,术后10周该腹膜组织被完整成熟的移行上皮替代[5]。因此,为安全起见,本研究选择术后12周作为后续实验检测及标本取出时间,病理及电镜观察结果显示术后12周新膀胱内移植腹膜消失(腹膜特异性抗体钙网膜蛋白和抗波形丝蛋白均阴性表达),被成熟的尿路移行上皮细胞完全爬行替代(尿路上皮特异性抗体UPK3与上皮类特异性抗体CK7均强阳性表达),扫描电镜也清晰看到表面覆盖的是几乎完全成熟的尿路移行上皮细胞。
临床上,对于原位可控回肠膀胱术后功能检测方面,不同的手术方式对术后新膀胱储尿功能的影响也不同。Tanaka等[6]在Studer 原位回肠新膀胱术后3个月~2年分别行尿流动力学检测显示,新膀胱容量约为(439±185)ml。Sevin等[7]在W形原位回肠新膀胱术后行尿流动力学检测显示,新膀胱容量约为(550±200)ml,最大膀胱压约为(26.4±15.0)cmH2O。Steven和Poulsen[8]在Kock原位回肠新膀胱术后行尿流动力学检测显示,新膀胱的最大膀胱压和容积相当稳定,术后6个月,新膀胱容量约为(456±255)ml,最大膀胱压约为(47±40)cmH2O;术后5年新膀胱容量约为(411±290)ml,最大膀胱压约为(50±30)cmH2O。本研究在术前对正常实验用小型猪进行膀胱压力容积测定,平均容量为587 ml,最大膀胱压为34~41 cmH2O,平均为37.5 cmH2O,顺应性平均为15.69,这与正常成人测定值相差不大。本研究采用的是半U形与膀胱三角区和膀胱颈吻合重建原位新膀胱,术后12周进行膀胱压力容积测定,平均容量为369.5 ml,最大膀胱压为21~29 cmH2O,平均为25.5 cmH2O,顺应性平均为14.31。术后动物膀胱的顺应性与术前相比差异无统计学意义(P>0.05),表明术后膀胱功能恢复较好,结合术后早期刚拔除尿管时明显尿频(1次/0.5~1 h)到术后12周排尿状况逐渐恢复,表明膀胱术后功能的恢复需要一个过程,其长短取决于腹膜覆盖回肠浆肌存活的时间以及被尿路移行上皮取代的快慢。只要覆盖腹膜存活,其下方肌层会自然舒展,恢复其延展性。本研究显示MASSON特染无明显的胶原纤维增生,透射电镜未观察到平滑肌细胞结构形态明显变化,纤维丝无增生,而且术后12周的膀胱造影显示新膀胱形态虽然较正常的膀胱偏小,但是和术中40 ml气囊的支撑容量相比明显恢复,尿流动力学检测结果更进一步证实移植腹膜对回肠平滑肌的保护作用,新膀胱的顺应性与正常膀胱相比差异无统计学意义(P>0.05)。这和国外Coleman等[4]与国内邹建华等[9]的研究结果一致。另外,术后的膀胱容量没有术前大是否跟术中取材偏少有关?膀胱压也较术前小,这是否和回肠肌层薄弱有关?这些还需要术后更长时间的观察比较才能明确。此时可以肯定的是新膀胱无纤维化挛缩变形,表明移植腹膜早期对新膀胱肌层覆盖保护有效。病理结果显示,术后12周对于一个扩大重建新膀胱来说,尿路移行细胞可以完全覆盖整个新膀胱腔面,移植腹膜完全被吸收消失,从而形成了一个具备完整移行上皮的真正代膀胱。根据尿流动力学检测结果,本研究动物术后的膀胱压力容积测定值都在其术前测定正常范围内,不仅可以对原位新膀胱做个参考,还可以为以后深入研究及其对照实验做好铺垫。
本研究设计扩大重建原位新膀胱的功能除了能够贮尿和排尿之外,还体现在能克服原来肠代膀胱所不能解决的与肠黏膜分泌和吸收相关的并发症。在临床上,根据患者渗透压、肾功能、所截取肠段的部位、肠段长度等决定了水电解质紊乱的严重程度和类型[10]。高血氨症、低钾、低钙等多见于回肠代膀胱,在各肠段中又以高氯性酸中毒最多见,常有超过2/3以上的发生率[11]。代谢性酸中毒在结肠代膀胱的发生率为10%~15%[12]。而上述这些与吸收相关的电解质代谢紊乱并发症在本研究设计重建的新膀胱里未发现,根据术后12周生化结果显示与术前正常动物相比,差异无统计学意义(P>0.05),表明新膀胱在祛除回肠黏膜及黏膜下层之后,在腹膜的覆盖保护下没有吸收功能;有学者研究显示肠代膀胱术后肿瘤发病率接近2%,结肠癌在一般人群中的发病率较低,在肠代膀胱术后,发生癌的概率可以提升100~500倍。如果年龄小于25岁经历尿流改道的患者,癌症发生率甚至可高达7000倍[13]。肿瘤具体位置多见于吻合部或邻近的肠上皮,即移行上皮与肠上皮交界处。对于这些肿瘤的发生机制,在医学界还没有统一的认识,但多数人普遍认为,肠上皮与尿路移行上皮的吻合是其发生的前提[14]。因为不管有无尿液刺激,只要二者接触,同样会发生肿瘤;肿瘤的发病率最高一定是在吻合交界处有粪便和尿液共同接触时,如果只有粪便或尿液其中一种接触,肿瘤的发病率就会明显降低[15]。泌尿系结石在肠代膀胱术后患者中的发病率升高,儿童肠膀胱扩大者结石发病率为40%左右,Kock膀胱结石为20%左右,回肠膀胱结石可高于30%[16]。本研究新膀胱里目前未发现肿瘤及结石,但这并不能表明以后就一定也没有,需要1年、2年或更长时间的观察才能知晓;肠上皮能够分泌黏液,肠膀胱术后,由于肠道本质未变,大量黏液栓生成,可以引起输出道梗阻,增加尿路感染的机会。肠代膀胱后,常见无症状性菌尿,在70%以上的尿常规中可发现较多细菌[17]。肠壁感染、缺血及黏液栓阻塞出口致膀胱过度扩张可使重建后新膀胱发生自发破裂[18]。本研究通过尿液的常规检查与尿沉渣的沉降分析显示未发现与肠黏液分泌有关的异常结果;尿中白细胞和比重与术前相比差异无统计学意义,尿液高速离心后提取尿沉渣称重与术前比较差异无统计学意义(P>0.05)。上述各种并发症的出现都是因为肠代膀胱中肠黏膜和黏膜下层的存在,几十年来很多专业学者都在思考和尝试去解决它们,也找到了很多办法,但效果都不太令人满意。本研究采用自体移植术将腹膜直接种植在回肠浆肌上扩大重建原位新膀胱的方法,解决了以往肠代膀胱术后难以克服的与肠黏膜吸收分泌相关的诸多并发症,但要把它真正用于临床还需要更深入的研究比较与更长远的观察。
