贝类中诺如病毒定性检测能力验证结果与分析
2020-09-03孙金红薛晓晶
王 晶 孙金红 芦 云 薛晓晶
(中国检验检疫科学研究院综合检测中心 北京 100123)
1 前言
诺如病毒是引起非细菌性急性肠胃炎和婴幼儿急性腹泻的主要病原体[1],全球约50%以上的病毒性肠胃炎是由诺如病毒引起的[2]。诺如病毒感染剂量低,传播速度快,传播途径多样,极易造成大规模群体事件,尤其易在幼儿园、中小学、养老院等抵抗力较低人员的密集场所暴发[3]。
感染人体的诺如病毒主要为GI型和GII型,检测方法以实时荧光逆转录聚合酶链式反应(实时荧光RT-PCR)为主[4-6]。检测结果的准确性直接反映实验室的技术水平,而参加能力验证是保证检测质量的重要方法[7]。中国检验检疫科学研究院实验室为了确认诺如病毒的检测能力,参加了青岛海关技术中心组织的“贝类中诺如病毒定性检测”能力验证(PT-FATA—2019—5)。检测方法参照 GB 4789.42—2016《食品微生物学检验 诺如病毒检验》[8]。
2 材料与方法
2.1 待测样品
PT-FATA—2019—5能力验证样品(青岛海关技术中心)。称取2.0 g贝类基质研磨样品,采用5 mL灭菌离心管盛放,共2份,编号分别为01947和01948。
2.2 主要试剂与仪器
试剂:MS2 噬菌体(ATCC15597-B1)(中国食品药品检定研究院);蛋白酶K(天根生化科技(北京)有限公司);QIAamp Viral RNA Mini Kit(德国 QIAGEN公司);Fast King一步法RT-PCR试剂盒(天根生化科技(北京)有限公司);诺如病毒GI和GII型阳性核酸(Thermo Fisher公司合成);引物、探针(Thermo Fisher公司合成)。
仪器:落地恒温振荡器(HZQ-311C,上海一恒科学仪器有限公司);离心机(5424,德国Eppendorf公司);荧光定量 PCR 仪(Quant Studio 6 Flex,美国AB公司)。
2.3 检测方法
2.3.1 样品前处理
按照能力验证要求,将每管样品作为一个整体进行检测。将MS2噬菌体作为过程控制病毒,在装有样品的离心管中加入10 μL预先增菌培养的MS2噬菌体,再加入2.0 mL蛋白酶K溶液,混匀。放入恒温振荡器中,在37℃条件下,以320次/min的速度振荡60 min。之后将离心管置于60℃水浴锅中,放置15 min,在室温下以3 000 r/min的转速离心5 min,将上清液转移至干净离心管中,用于后续RNA提取。
2.3.2 RNA提取和实时荧光RT-PCR
RNA提取:将过程控制病毒MS2噬菌体RNA和含有MS2噬菌体的样品RNA,用MS2的引物、探针进行扩增;外加扩增控制RNA和含有MS2噬菌体的样品RNA,用诺如病毒GI和GII型的引物、探针进行扩增。
RT-PCR 反应体系(25 μL):吸取 Fast King 一步法RT-PCR试剂盒中的2X反应预混液12.5 μL,25X酶 1 μL,引物和探针各 1 μL,模板 5 μL,水 4 μL,在42℃下逆转录 30 min,95℃下预变性 3 min,94℃下变性 30 s,60℃下退火 30 s,72℃下延伸 30 s,45 个循环,72℃下延伸5 min,用荧光定量PCR仪进行扩增。
3 结果与分析
3.1提取效率
将10 μL过程控制病毒MS2噬菌体RNA进行4次10倍梯度稀释,以RNA浓度的对数值为X轴,以其反应管内荧光信号达到设定阈值时所经历的循环数Ct为Y轴,建立标准曲线。试验标准曲线R2=0.9904,2个样品的提取效率分别为1.49%和1.34%,2个指标均满足标准要求。提取效率详见表1,MS2噬菌体基因扩增曲线详见图1,标准曲线详见图2。
3.2 抑制指数
通过外加扩增控制RNA,计算扩增抑制指数,作为扩增控制。抑制指数=(含过程控制病毒样品RNA+外加扩增控制RNA)Ct值-(无RNase超纯水+外加扩增控制RNA)Ct值。本次试验2个样品诺如病毒GI型扩增的抑制指数分别为-2.743和-0.592,GII型扩增的抑制指数分别为-11.152和-1.065,均满足标准要求,扩增曲线详见图3~图6,检测结果详见表 2、表 3。
3.3 检测结果
在提取效率和抑制指数均满足标准要求的前提下,样品01947检出诺如病毒GI型和GII型,样品01948未检出诺如病毒GI型,检出诺如病毒GII型,扩增曲线详见图3~图6,检测结果详见表2、表3。

表1 提取效率结果
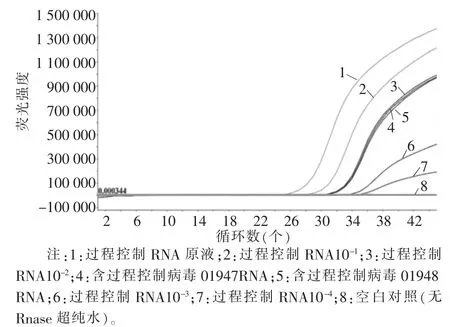
图1 MS2噬菌体基因扩增曲线

图2 MS2噬菌体基因标准曲线

图3 样品01947诺如病毒GI型扩增曲线

图4 样品01948诺如病毒GI型扩增曲线
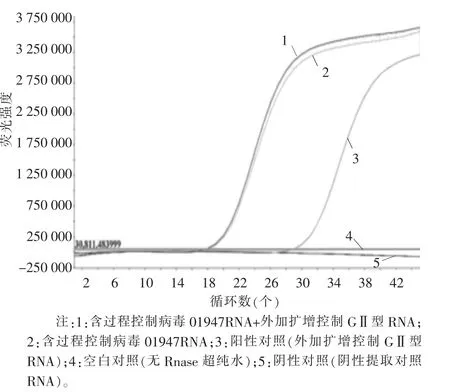
图5 样品01947诺如病毒GII型扩增曲线

图6 样品01948诺如病毒GII型扩增曲线

表2 诺如病毒GI型结果
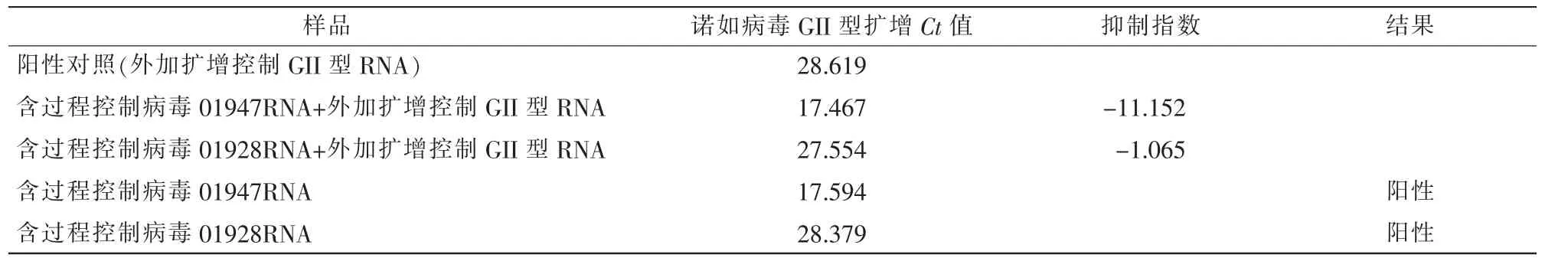
表3 诺如病毒GII型结果
4 讨论
本次能力验证项目是检测贝类中的诺如病毒,要求鉴定出其基因型(GI或GII型)。诺如病毒的检测方法大多是RT-PCR方法,其中,GB 4789.42—2016对RNA提取和PCR扩增环节都有严格的质控要求。
样品前处理过程除了按照标准方法操作外,也要遵照能力验证作业指导书的要求。诺如病毒是RNA病毒,在提取RNA的过程中要注意防止RNA酶的污染。在试验过程中使用专用的移液器和耗材,配制溶液所使用的超纯水要经过焦磷酸二乙酯(DEPC)处理。在整个试验过程中需要加入过程控制病毒,本试验选择MS2噬菌体来监控假阴性结果。另外,在扩增过程中引入抑制指数,可以有效地监控RT-PCR扩增过程,用以判断RNA模板的纯度和浓度是否满足需要。
5 结语
实验室2个测试样品结果与样品指定值完全一致,能力验证结果均满意。本次能力验证表明,试验室人员、仪器、方法和环境均满足检测食品中诺如病剂制备工艺研究[J].农药学学报,2018(4):514-522.
