苗药红禾麻提取物在离体人肠道菌群中的代谢研究
2020-09-02薛寸吴耽巩仔鹏陈思颖唐娟李月婷王爱民李勇军兰燕宇王永林
薛寸 吴耽 巩仔鹏 陈思颖 唐娟 李月婷 王爱民 李勇军 兰燕宇 王永林
中图分类号 R969.1 文献标志码 A 文章编号 1001-0408(2020)14-1683-08
DOI 10.6039/j.issn.1001-0408.2020.14.04
摘 要 目的:探索苗药红禾麻提取物在离体人肠道菌群中的代谢特征。方法:取红禾麻药材,以70%乙醇回流提取,经浓缩、正丁醇萃取、干燥后,得红禾麻提取物。将0.05 g/mL红禾麻提取物溶液1 mL与离体人肠道菌液10 mL混合后,在厭氧环境下共同培养36 h(同时设置不含药物或人肠道菌液的空白对照),模拟该提取物在人体肠道内的代谢过程。采用超高效液相色谱-四极杆-飞行时间质谱联用技术(UPLC-Q-TOF/MS)对厌氧反应后的代谢产物进行检测。色谱柱为Agilent Eclipse Plus C18 RRHD,流动相为0.01%甲酸水溶液-0.01%甲酸乙腈溶液(梯度洗脱),柱温为40 ℃,流速为0.25 mL/min,进样量为1 ?L;采用电喷雾离子源(ESI),以负离子模式(ESI-)扫描,毛细管电压为4.5 kV,离子源温度为120 ℃,碰撞能为15~32 V,扫描范围为m/z 50~1 000。采用MassLynx V4.1软件中的“Strip”模块分析获得红禾麻提取物反应液与空白对照的差异图谱。根据质谱数据和UNIFI软件进行代谢产物的相对分子量和分子式预测,结合对照品信息和相关文献报道,推测红禾麻提取物在离体人肠道菌群中的代谢产物结构及其可能的生物转化途径。结果与结论:红禾麻提取物经离体人肠道菌群代谢后,共检出3个原型产物(芦丁、槲皮苷、山柰酚-3-O-芸香糖苷)和22个代谢产物(主要为槲皮素、单咖啡酰基奎宁酸、异槲皮苷等的代谢产物),其主要生物转化途径是以还原、氧化、水解为主的Ⅰ相反应。
关键词 红禾麻;离体人肠道菌群;代谢;超高效液相色谱-四极杆-飞行时间质谱联用技术;鉴定
Study on Metabolism of Miao Medicine Laportea bulbifera Extract in Isolated Human Intestinal Flora
XUE Cun1,WU Dan2,GONG Zipeng1,CHEN Siying1,TANG Juan3,LI Yueting1,WANG Aimin1,LI Yongjun1, LAN Yanyu1,WANG Yonglin1(1. Guizhou Provincial Key Laboratory of Pharmaceutical preparations/School of Pharmacy, Guizhou Medical University, Guiyang 550004, China; 2. Key Laboratory of Natural Products Chemistry of Guizhou Provincial Science City, Guiyang 550014, China; 3. Phase Ⅰ Ward, the Affiliated Hospital of Guizhou Medical University, Guiyang 550004, China)
ABSTRACT OBJECTIVE: To explore the metabolic characteristics of Miao medicine Laportea bulbifera extract in isolated human intestinal flora. METHODS: L. bulbifera was extracted with 70% ethanol reflux extraction. After concentration, extraction with n-butanol and drying, L. bulbifera extract was obtained. Taking 0.05 g/mL L. bulbifera extract 1 mL mixed with isolated human intestinal flora fluid 10 mL and cultured for 36 h in anaerobic environment (setting up blank control without drugs or human intestinal bacterial solution), so as to simulate the metabolic process of the extract in human intestine. The metabolites were detected by UPLC-Q-TOF/MS. The determination was performed on Agilent Eclipse Plus C18 RRHD column with mobile phase consisted of 0.01% formic acid water solution-0.01% formic acid acetonitrile solution (gradient eluetion) at the flow rate of 0.25 mL/min. The column temperature was set at 40 ℃, and the sample size was 1 ?L. ESI detection was adopted and scanned by negative ion mode (ESI-); the capillary voltage was 4.5 kV, the ion source temperature was 120 ℃, the collision energy was 15-32 V, and the scanning range was m/z 50-1 000. The “Strip” module of MassLynx V4.1 software was used to analyze the differential chromatograms between the reaction solution and the blank control of L. bulbifera extract. Mass spectrum data and UNIFI software were used to predict relative molecular weight and formula; based on the information of substance control and related literature reports, the structure and biotransformation pathway of L. bulbifera metabolites in isolated human intestinal flora were predicted and analyzed. RESULTS & CONCLUSIONS: A total of 3 prototype products (rutin, quercetin, kaempferol-3-O-rutinoside) and 22 metabolites(mainly the metabolites of quercetin,mono- caffeoylquinic acid,isoquercitrin,etc.) were detected after metabolized in isolated human intestinal flora. Its biotransformation pathway is phase Ⅰ reaction, which mainly consisted of reduction, oxidation and hydrolysis.
KEYWORDS Laportea bulbifera; Isolated human intestinal flora;Metabolism;UPLC-Q-TOF/MS; Identification
红禾麻为荨麻科艾麻属植物珠芽艾麻[Laportea bulbifera(Sieb. et Zucc.)Wedd.]的新鮮或干燥全草,又名红活麻、野绿麻、华中艾麻等,为贵州苗族常用药材,具有祛风除湿、活血化瘀之功效,对风湿麻木、类风湿性关节炎、风湿性关节炎、跌扑损伤以及骨折等症有独特疗效[1-2]。根据有关文献报道,红禾麻中主要含有黄酮类、内酯类、糖类及鞣质等成分,具有抗炎、镇痛、免疫抑制、抗类风湿性关节炎等药理作用[3-7]。本课题组前期考察了红禾麻提取物在大鼠体内的原型入血成分,结果发现其主要为黄酮类和酚酸类:5个黄酮类原型成分为芦丁、槲皮苷、异槲皮苷、木犀草苷、山柰酚-3-O-芸香糖苷,3个酚酸类原型成分为3-O-咖啡酰基奎宁酸、4-O-咖啡酰基奎宁酸、5-O-咖啡酰基奎宁酸;进一步的药动学与药效学研究显示,上述入血成分的药效发挥时间均滞后于其血药浓度达峰时间,分析原因可能是入血的原型成分在大鼠体内发生了生物转化,其代谢产物与原型成分共同发挥了药理作用[8]。
人体肠道中栖息着最主要和最多样的微生物,这些微生物被统称为肠道菌群。肠道菌群作为人体“隐形器官”,在药物的药效、毒性、生物利用度及代谢方面发挥着重要作用[9-10]。传统中药大多数是通过口服吸收而发挥药效,而药物在生物体内不可避免地会与肠道菌群接触[11],因此中药的药效成分可能在吸收入血之前就已经在肠道内与肠道菌群发生了相互作用,这可能导致其成分活性、毒性以及生物利用度的改变等[12-13]。基于此,本课题组在前期研究的基础上,将苗药红禾麻提取物与离体人肠道菌群共同进行厌氧培养,模拟该提取物在人体肠道中的代谢过程;同时,通过超高效液相色谱-四极杆-飞行时间质谱联用技术(UPLC-Q-TOF/MS)对代谢后的产物进行定性分析,以明确红禾麻提取物的代谢产物及代谢途径,旨在为阐明该药材中各化学成分在肠道中的代谢规律提供依据。
1 材料
1.1 仪器
G2-XS Q-TOF型UPLC-Q-TOF/MS仪,包括四元梯度泵、真空脱气机、自动进样器、柱温箱、电喷雾四极杆串联飞行时间质谱仪、MassLynx V4.1质谱工作站(美国Waters公司);DK-98-ⅡA型恒温水浴锅、CDH6000BⅡ型电热恒温培养箱(天津市泰斯特仪器有限公司);Allegra 64R型低温高速离心机(美国Beckman Coulter公司);EL204 型电子分析天平[梅特勒-托利多仪器(上海)有限公司];DZF-6050型真空干燥箱(上海一恒科学仪器有限公司);Buchi R-200型旋转蒸发仪(瑞士 Buchi 公司);KQ-2200DE型超声波清洗机(昆山舒美超声仪器有限公司);AnaeroPack-Anaero型厌氧产气袋、厌氧培养罐(日本MGC公司);MTN-2800D型氮吹浓缩装置(天津奥特塞恩斯仪器有限公司);YXQ-LS-18SI型手提式压力蒸汽灭菌器(上海博迅实业有限公司)。
1.2 药品与试剂
红禾麻药材于2017年采收自贵州地区,经贵阳中医学院药学院生药学教研室孙庆文副教授鉴定为荨麻科艾麻属植物珠芽艾麻[L. bulbifera(Sieb. et Zucc.)Wedd.]的干燥全草;芦丁、异槲皮苷、木犀草苷、山柰酚-3-O-芸香糖苷、槲皮苷对照品(中国食品药品检定研究院,批号分别为100080-201610、112007-201602、111720-201408、111809-201403、111538-201606,纯度均不低于98%);5-O-咖啡酰基奎宁酸、3-O-咖啡酰基奎宁酸、4-O-咖啡酰基奎宁酸对照品(江西佰草源生物科技有限公司,批号分别为BCY-0921、BCY-0414、BCY-0920,纯度均不低于98%);亮氨酸脑啡肽液(美国Waters公司,批号:W29061508);厌氧培养液粉末(青岛高科技工业园博海生物技术有限公司,批号:20161025);氯化钠注射液(贵州科伦药业有限公司,规格:250 mL ∶ 2.25 g;作生理盐水用);乙腈、甲酸均为色谱纯,其余试剂均为分析纯,水为纯净水。
1.3 人体粪便
人体粪便均来自于贵州医科大学附属医院招募的健康成年志愿者的新鲜粪便样本。
2 方法与结果
2.1 红禾麻提取物的制备
根据文献方法[14],称取红禾麻药材5 kg,先后加入10、8、8倍量(L/kg,下同)70%乙醇加热回流提取,每次分别提取2、1.5、1.5 h,滤过;合并滤液,水浴下减压旋转蒸发浓缩至无醇味。将上述醇提物浓缩液用水稀释至1 g/mL(以原药材量计),加入等体积水饱和正丁醇萃取,共萃取3次;合并正丁醇萃取液,水浴下减压旋转蒸发回收正丁醇,残留物进行真空干燥,得红禾麻正丁醇萃取物,即为红禾麻提取物(以原药材质量计算其提取率为4.03%)。
2.2 红禾麻提取物在离体人肠道菌群中的代谢反应
2.2.1 红禾麻提取物药液制备 取“2.1”项下所制备的红禾麻提取物1 g,加入50%甲醇100 mL,超声(功率:100 W,频率:40 kHz,下同)30 min使充分溶解,然后以8 000 r/min离心5 min,取上清液,水浴挥干,粉碎,得挥干物固体粉末0.6 g(转移率约为60%)。称取该挥干物粉末适量,用生理盐水制备成质量浓度为0.05 g/mL(以挥干物质量计)的红禾麻提取物药液,备用。
2.2.2 对照品溶液制备 分别精密称取5-O-咖啡酰基奎宁酸、3-O-咖啡酰基奎宁酸、4-O-咖啡酰基奎宁酸、芦丁、异槲皮苷、木犀草苷、山柰酚-3-O-芸香糖苷、槲皮苷对照品适量至量瓶中,加甲醇适量,超声溶解后并以甲醇定容,混匀,制成各单一对照品贮备液,于-20 ℃避光保存。临用前,分别取各贮备液适量,以甲醇适当稀释后即得。
2.2.3 厌氧培养液制备 取厌氧培养液粉末9 g,加至水1 L中,超声溶解后,在121 ℃下高压蒸汽灭菌20 min,备用。
2.2.4 人肠道菌液制备 取人体粪便样本适量,加入4倍量生理盐水,混匀,涡旋混合3 min,以6 000 r/min离心5 min,取上清液,即得。
2.2.5 分组代谢反应 取“2.2.4”项下人肠道菌液1 mL,加至“2.2.3”项下厌氧培养液9 mL中,混匀后迅速置于厌氧培养罐中,加入1个厌氧产气袋后盖上培养罐盖,置于37 ℃恒温培养箱中培养24 h,使人肠道菌液中的细菌充分生长。试验分为给药组、空白对照A组、空白对照B组。给药组:将厌氧培养24 h后的人肠道菌液10 mL与红禾麻提取物溶液1 mL混合均匀,立即置于厌氧培养罐中,加入1个厌氧产气袋后迅速盖上培养罐盖,置于37 ℃恒温培养箱中培养36 h;空白对照A组:将厌氧培养24 h后的人肠道菌液10 mL(不加红禾麻提取物),按给药组“立即置于厌氧培养罐……培养36 h”步骤同法操作;空白对照B组:将厌氧培养液10 mL和红禾麻提取物溶液1 mL混合,按给药组“立即置于厌氧培养罐……培养36 h”步骤同法操作。各组均平行3份样品操作。将培养完毕的培养液转移至50 mL EP管中,于 -20 ℃条件下保存,备用。所用器具均经121 ℃高压蒸汽灭菌20 min。
2.3 红禾麻提取物在离体人肠道菌群中代谢反应样品的测定
参照文献方法[8,14],采用UPLC-Q-TOF/MS技术测定分组代谢产物。
2.3.1 色谱条件 色谱柱:Agilent Eclipse Plus C18 RRHD(100 mm×2.1 mm,1.8 μm);流动相:0.01%甲酸水溶液(A)-0.01%甲酸乙腈溶液(B),梯度洗脱(0~1.5 min,5%B;1.5~6 min,5%B→9%B;6~9 min,9%B;9~11 min,9%B→12%B;11~13 min,12%B→15%B;13~25 min,15%B→20%B;25~26 min,20%B→70%B;26~27 min,70%B→95%B;27~28 min,95%B;28~30 min,95%B→5%B;30~32 min,5%B);柱温:40 ℃;流速:0.25 mL/min;进样量:1 ?L。
2.3.2 质谱条件 离子源:电喷雾离子源(ESI);扫描方式:负离子模式(ESI-);扫描范围:m/z 50~1 000;扫描方式:MS Continuum模式;毛细管电压:4.5 kV;离子源温度:120 ℃;雾化气(N2)压力:1.2 bar;去溶剂气温度:300 ℃;脱溶劑气流量:600 L/h;锥孔气流量:50 L/h;碰撞能:15~32 V。采用外标亮氨酸脑啡肽(m/z 554.262 0
[M-H]-,Lock SprayTM模式)进行实时采集校正;采用MassLynx V4.1工作站进行质谱数据采集及处理。
2.3.3 代谢反应样品的预处理及测定 取“2.2.5”项下各组反应样品,室温解冻后同组混匀,取一半混合液分别转移至50 mL离心管中,加入等体积乙酸乙酯,涡旋3 min后再超声8 min进行萃取,然后以8 000 r/min离心5 min,取上清液;下层再按同样的步骤提取1次,离心后取上清液;再向下层中加入等体积水饱和正丁醇,同法萃取,共萃取2次;合并4次萃取液,于37 ℃下以N2吹干。残渣加入50%甲醇500 ?L,涡旋混匀,超声使其溶解,以13 000 r/min离心10 min,取上清液,按“2.3.1”“2.3.2”项下色谱和质谱条件进样分析。
2.4 红禾麻提取物在离体人肠道菌群中的代谢产物鉴定分析
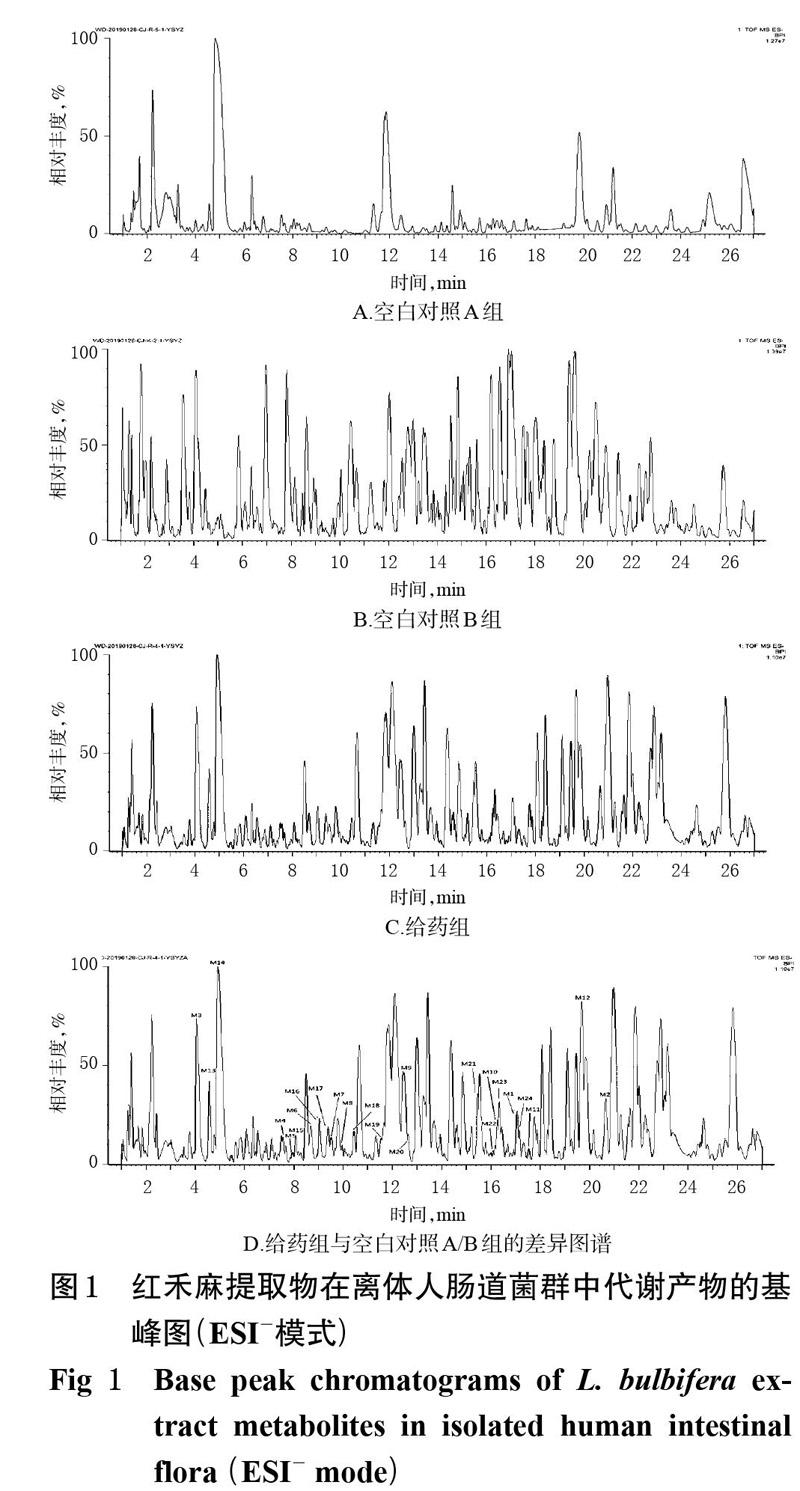
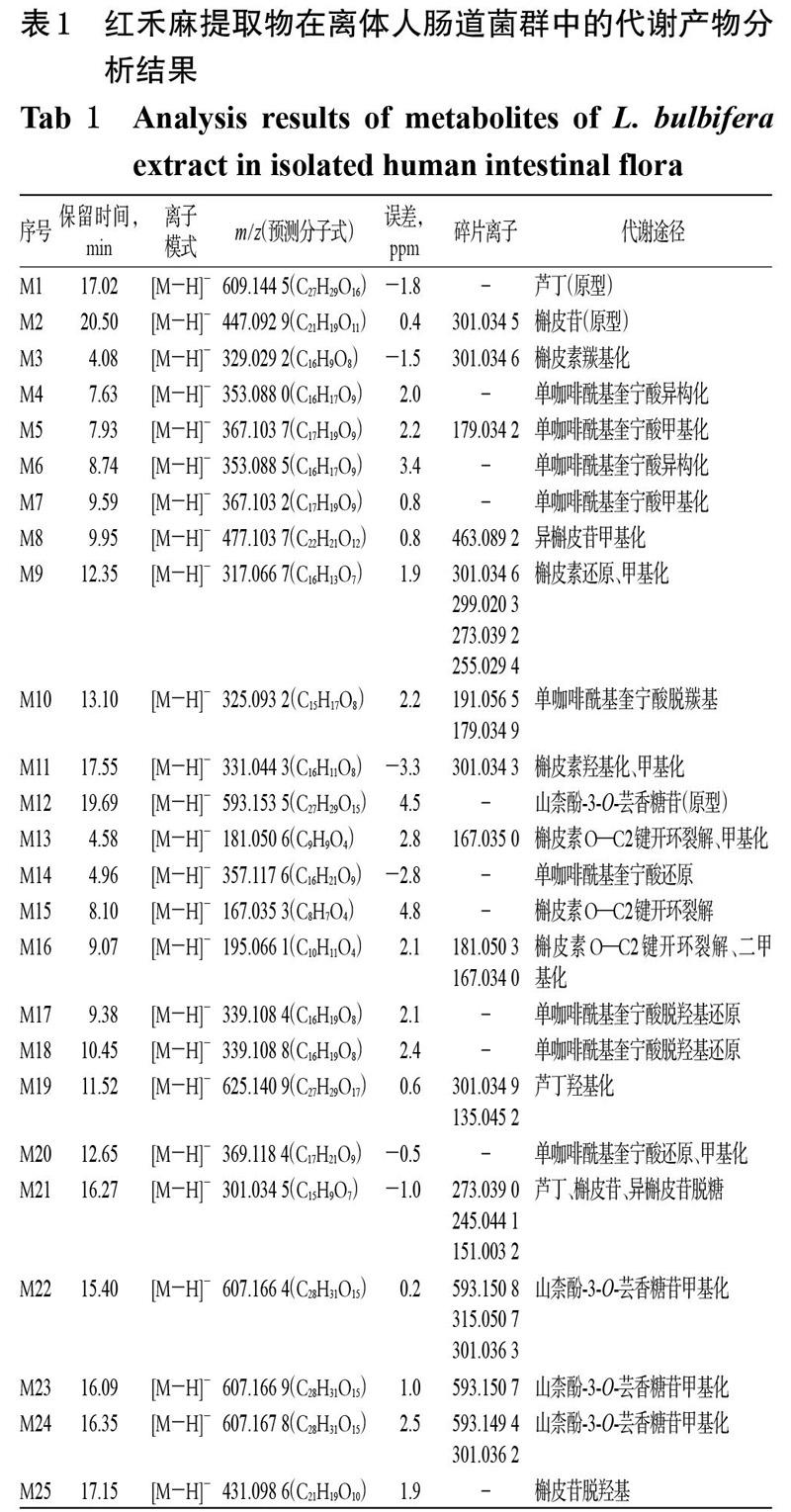
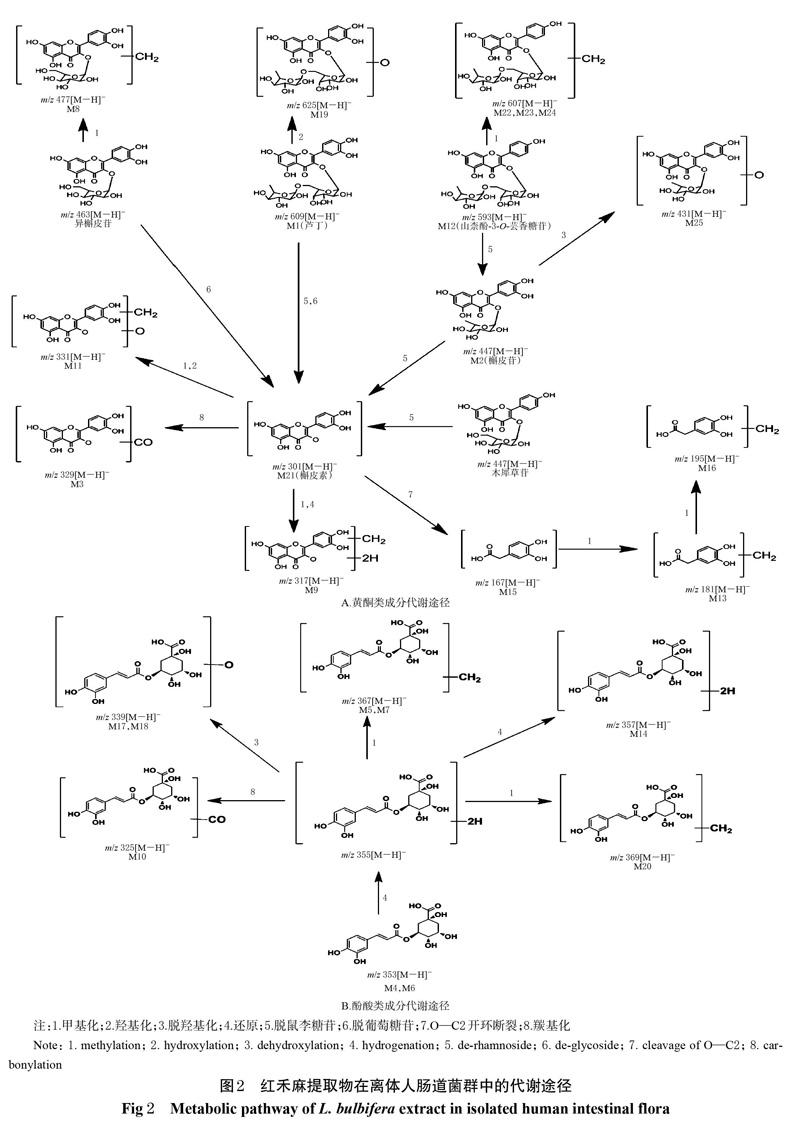
经UPLC-Q-TOF-MS技术测得的红禾麻提取物在离体人肠道菌群中代谢产物的基峰图见图1A~1C,采用MassLynx V4.1工作站软件获得准分子离子高分辨质量数及其碎片离子信息;采用MassLynx V4.1软件中的“Strip”模块进行差异图谱分析,得基峰图,见图1D。根据得到的质谱数据结合 UNIFI 软件进行代谢产物预测、筛查[15-16],再通过与已知对照品比对保留时间、相对分子量、碎片离子来确定原型成分;利用高分辨质谱数据及其误差值、保留时间、原型成分的裂解规律及相关文献[8,17-19]进行代谢物推测分析。结果,从红禾麻提取物的反应液中鉴定出3个原型成分和22个代谢产物,其分析结果见表1,其代谢途径见图2。
2.5 原型产物解析
M1、M2、M12:分别在保留时间17.02、20.50、19.69 min处,出现准分子离子m/z 609.144 5[M-H]-、m/z 447.092 9[M-H]-、m/z 593.153 5[M-H]-,通过Mass- Lynx V4.1工作站软件(下同)预测其分子式为C27H29O16、C21H19O11、C27H29O15,与芦丁、槲皮苷、山柰酚-3-O-芸香糖苷对照品的相对分子量和保留时间均一致,由此确定M1为芦丁、M2为槲皮苷、M12为山柰酚-3-O-芸香糖苷。
2.6 代谢产物解析
M3:在保留时间4.08 min处,出现准分子离子m/z 329.029 2[M-H]-,通过软件预测分子式为C16H9O8;出现碎片离子m/z 301.034 6[M-H]-(预测分子式为C15H9O7,下同),相对分子量较其准分子离子m/z 329.029 2少了28,根据软件推测此准分子离子可能是由槲皮素羰基化而得;再结合相关文献[8,17],推测M3是槲皮素羰基化的代谢产物。
M9:在保留时间12.35 min处,出现准分子离子m/z 317.066 7[M-H]-,通过软件预测其分子式为C16H13O7;出现碎片离子m/z 301.034 6[M-H]-(C15H9O7)、m/z 299.020 3[M-H]-(C15H7O7)、m/z 273.039 2[M-H]-(C14H9O6)、m/z 255.029 4[M-H]-(C14H7O5),其中碎片离子m/z 301.034 6的相对分子量较其准分子离子m/z 317.066 7少了16,而碎片离子m/z 299.020 3、273.039 2、255.029 4为槲皮素的特征碎片离子[17],故推测M9是槲皮素还原、甲基化的代谢产物。
M13、M15:在保留时间4.58、8.10 min处,分别出现准分子离子m/z 181.050 6[M-H]-、m/z 167.035 3[M-H]-,通过软件预测其分子式为C9H9O4、C8H7O4;出现碎片离子m/z 167.035 0[M-H]-(C8H7O4),相对分子量较其准分子离子m/z 181.050 6少了14,故推测化合物M13为化合物槲皮素O—C2键开环裂解、甲基化的代谢产物;结合相关文献[14]和相对分子量分析,M15可能是槲皮素O—C2键开环裂解的代谢产物。
M16:在保留时间9.07 min处,出现准分子离子m/z 195.066 1[M-H]-,通过软件预测其分子式为C10H11O4;出现碎片离子m/z 181.050 3[M-H]-(C9H9O4)、m/z 167.034 0[M-H]-(C8H7O4),分别与M13、M15的准分子离子对应,再根据软件推算分子式并推测准分子离子可能的代谢途径为槲皮素O—C2键开环裂解、二甲基化,故推测M16可能是化合物槲皮素O—C2键开环裂解、二甲基化的代谢产物。
M11:在保留时间17.55 min处,出现准分子离子m/z 331.044 3[M-H]-,通过软件预测其分子式为C16H11O8;出现碎片离子m/z 301.034 3[M-H]-(C15H9O7),相对分子量较其准分子离子m/z 331.044 3少了30,故推测M11可能是槲皮素羟基化、甲基化的代谢产物。
M21:在保留时间16.27 min处,出现准分子离子m/z 301.034 5[M-H]-,通过软件预测其分子式为C15H9O7;出现碎片离子m/z 273.039 0[M-H]-(C14H9O6)、m/z 245.044 1[M-H]-(C13H9O5)、m/z 151.003 2[M-H]-(C8H7O3),均为槲皮素特征碎片离子[17],通过软件推测此准分子离子可能是由芦丁、槲皮苷、异槲皮苷脱糖而得;结合相关文献[8,18],推测M21可能是芦丁、槲皮苷、异槲皮苷脱糖的代谢产物槲皮素。
M25:在保留时间17.15 min处,出现准分子离子m/z 431.098 6[M-H]-,通过软件预测其分子式为C21H19O10。此准分子离子的相对分子量较槲皮苷准分子离子m/z 447.092 9少了16,故推测M24可能是槲皮苷脱羟基的代谢产物。
M8:在保留时间9.95 min處,出现准分子离子m/z 477.103 7[M-H]-,通过软件预测其分子式为C22H21O12;出现碎片离子m/z 463.089 2[M-H]-(C21H19O12),相对分子量较其准分子离子m/z 477.103 7少了14;结合相关文献[18],推测M8是异槲皮苷甲基化的代谢产物。
M19:在保留时间11.52 min处,出现准分子离子m/z 625.140 9[M-H]-,通过软件预测其分子式为C27H29O17;出现碎片离子m/z 301.034 9[M-H]-(C15H9O7)、135.045 2[M-H]-(C8H7O2)。由于其准分子离子的相对分子量较芦丁准分子离子m/z 609.144 5多了16,而2个碎片离子m/z 301.03 4、135.045 2为芦丁特征碎片离子[18],故推测M19是芦丁羟基化的代谢产物。
M14:在保留时间4.96 min处,出现准分子离子m/z 357.117 6[M-H]-,通过软件预测其分子式为C16H21O9。根据质谱数据并结合相关文献[19]推测,该准分子离子的相对分子量较单咖啡酰基奎宁酸准分子离子m/z 353多了4,故推测M14可能是单咖啡酰基奎宁酸还原的代谢产物。
M4、M6:在保留时间7.63、8.74 min处,分别出现准分子离子m/z 353.088 0[M-H]-(C16H17O9)、m/z 353.088 5
[M-H]-(C16H17O9)。结合相关文献[19],两者的相对分子量与单咖啡酰基奎宁酸准分子离子m/z 353[M-H]-相等,但保留时间与3-O-咖啡酰基奎宁酸、4-O-咖啡酰基奎宁酸、5-O-咖啡酰基奎宁酸[8]均不同,故推测M4、M6可能是单咖啡酰基奎宁酸异构化的代谢产物。
M5:在保留时间7.93 min处,出现准分子离子m/z 367.103 7[M-H]-,通过软件预测其分子式为C17H19O9;出现碎片离子m/z 179.034 2[M-H]-(C9H7O4)。其中,其准分子离子的相对分子量较单咖啡酰基奎宁酸准分子离子m/z 353少了14,其碎片离子m/z 179.034 2为单咖啡酰基奎宁酸的特征碎片离子[19],故推测M5可能是单咖啡酰基奎宁酸甲基化的代谢产物。
M10:在保留时间13.10 min处,出现准分子离子m/z 325.093 2[M-H]-,通过软件预测其分子式为C15H17O8;出现碎片离子m/z 191.056 5[M-H]-(C7H11O6)、m/z 179.034 9[M-H]-(C9H7O4),均为单咖啡酰基奎宁酸裂解的特征碎片离子[19];同时,结合相关文献[19],其准分子离子的相对分子量较单咖啡酰基奎宁酸准分子离子m/z 353[M-H]-少了28,故推测M16可能是单咖啡酰基奎宁酸脱羰基的代谢产物。
M17、M18:在保留时间9.38、10.45 min处,分别出现准分子离子m/z 339.108 4[M-H]-(C16H19O8)、m/z 339.108 8[M-H]-(C16H19O8)。结合相关文献[19],两者的相对分子量均较单咖啡酰基奎宁酸准分子离子m/z 353[M-H]-少了14,故推测化合物M17、M18可能是单咖啡酰基奎宁酸脱羟基还原的代谢产物。
M7:在保留时间9.59 min处,出现准分子离子m/z 367.103 2[M-H]-,通过软件预测其分子式为C17H19O9。此准分子离子的相对分子量较单咖啡酰基奎宁酸准分子离子m/z 353[M-H]-[19]多了14,故推測M7可能是单咖啡酰基奎宁酸甲基化的代谢产物。
M20:在保留时间12.65 min处,出现准分子离子m/z 369.118 4[M-H]-,通过软件预测其分子式为C17H21O9。结合相关文献[19],此准分子离子的相对分子量较单咖啡酰基奎宁酸准分子离子m/z 353[M-H]-多了16,根据软件可推测此准分子离子可能是由单咖啡酰基奎宁酸还原、甲基化而得,故推测M20可能是单咖啡酰基奎宁酸还原、甲基化的代谢产物。
M22、M23、M24:在保留时间15.40、16.09、16.35 min处,分别出现准分子离子m/z 607.166 4[M-H]-(C28H31O15)、m/z 607.166 9[M-H]-(C28H31O15)、607.167 8 [M-H]-(C28H31O15);出现碎片离子m/z 593.150 8[M-H]-(C27H29O15)、m/z 593.150 7[M-H]-(C27H29O15)、m/z 593.149 4[M-H]-(C27H29O15)、m/z 315.050 7[M-H]-(C16H11O7)、m/z 301.036 3[M-H]-(C15H9O7)、m/z 301.036 2[M-H]-(C15H9O7)。其中,碎片离子m/z 593.150 8与山柰酚-3-O-芸香糖苷准分子离子m/z 593.153 5一致,相对分子量均较上述准分子离子m/z 607.166 4、607.166 9、607.167 8少了14,推测上述准分子离子可能是由山柰酚-3-O-芸香糖苷甲基化而得,故推测M21、M22、M23可能是山柰酚-3-O-芸香糖苷甲基化的代谢产物。
3 讨论
本文采用UPLC-Q-TOF/MS技术检测了苗药红禾麻提取物在离体人肠道菌群中的代谢产物,为该药材提取物体内过程的定性分析提供了一种高效、灵敏、快速的分析方法[13]。该方法在32 min内即可完成对复杂生物样品的检测,具有高效、检测模式多样、分析速度快等优点;同时,本研究通过数据软件处理,对生物样品中的代谢产物进行了分析鉴定,初步揭示了红禾麻提取物在离体人肠道菌群中的代谢途经。
本研究以离体人肠道菌群为代谢模型,模拟并考察红禾麻提取物在人肠道中的代谢过程。结果,共检测到3个原型成分和22个代谢产物,主要为酚酸类和黄酮类化合物。其中,酚酸类成分的代谢途径主要为单咖啡酰基奎宁酸发生还原、脱羟基还原、异构化、甲基化等反应;黄酮类成分的代谢途径主要为槲皮素发生羰基化、还原、甲基化、羟基化、去羟基化、O—C2键开环裂解,异槲皮苷发生甲基化,芦丁、槲皮苷、异槲皮苷发生脱糖,芦丁发生羟基化,山柰酚-3-O-芸香糖苷发生甲基化等反应。本次试验在离体人肠道菌群反应液中仅检测到了3种原型成分,其余大部分均为代谢产物,说明红禾麻提取物吸收进入体内可能会发生明显的生物转化过程。研究显示,红禾麻提取物中的单咖啡酰基奎宁酸(5-O-咖啡酰基奎宁酸、3-O-咖啡酰基奎宁酸、4-O-咖啡酰基奎宁酸)和黄酮类成分(芦丁、异槲皮苷、木犀草苷、山柰酚-3-O-芸香糖苷、槲皮苷)很容易与肠道菌群中的酶类结合,发生水解、还原、异构化等反应[20-23],与本试验结果相符合,推测该药材提取物在体内发挥药效的活性成分除了原型成分外,还可能包括其代谢产物。前期研究发现的8个入血成分中,仅有木犀草苷既未检测出原型,也未检测出代谢产物,其原因可能是木犀草苷在肠道中代谢为与其他黄酮类成分代谢产物相同的成分而未能被区分;也有可能是由于本次采样的红禾麻药材中木犀草苷含量较低,又或者被代谢成其他化合物后含量低于本试验分析方法检测限而未能检出。
综上,红禾麻提取物在离体人肠道菌群中代谢后的产物主要为3个原型产物(芦丁、槲皮苷、山柰酚-3-O-芸香糖苷)和22个代谢产物(主要为槲皮素、单咖啡酰基奎宁酸、异槲皮苷等的代谢产物),其主要生物转化途径是以还原、氧化、水解为主的Ⅰ相反应。本研究可为红禾麻进一步的药效物质基础及作用机制研究提供参考。但由于本次试验是在离体人肠道菌群中进行的代谢研究,无法全面反映红禾麻中有效成分在体内的代谢过程,因此后续还需通过分析血液、胆汁、尿液、粪便等样品对红禾麻有效成分在体内的代谢过程进行深入研究,并比较体内外代谢产物的差异和相关性,进一步为该药材及其相关中药复方的相互作用规律和药效物质基础研究提供科学依据。
参考文献
[ 1 ] 贵州省药品监督管理局.贵州省中药材、民族药材质量标准[S].贵阳:贵州科技出版社,2003:187.
[ 2 ] 国家中医药管理局《中华本草》编委会.中华本草:苗药卷[M].贵阳:贵州科技出版社,2005:283-284.
[ 3 ] 汪石丽.红禾麻抗炎镇痛物质基础及质量控制研究[D].贵阳:贵阳医学院,2015.
[ 4 ] 苏志强,赵增宇,谢胜男,等.红活麻提取物镇痛抗炎和免疫抑制活性研究[J].中国药理学通报,2009,25(4):559-560.
[ 5 ] 马琳,梁冰,朱珠,等.民族药珠芽艾麻醇提物镇痛药理作用的研究[J].贵阳中医学院学报,2012,34(1):24-26.
[ 6 ] HOU WR,SU ZQ,PI HF,et al. Immunosuppressive constituents from Urtica dentate Hand[J]. J Asian Nat Pro Res,2010,12(8):707-713.
[ 7 ] YANG MC,CHOI SZ,LEE SO,et al. Flavonoid constituents and their antioxidant activity of Laportea bulbifera Weddell[J]. Korean J Pharm,2003,34(1):18-24.
[ 8 ] 吴耽,李莹,陈思颖,等.基于UHPLC-Q-TOF-MSE技术研究红禾麻提取物在大鼠类粪便中的代谢产物[J/OL].中国中药杂志,2020. DOI:10.19540/j.cnki.cjcmm.202004- 11.202.
[ 9 ] Human Microbiome Project Consortium. Structure,function and diversity of the healthy human microbiome[J]. Nature,2012,486(7402):207-214.
[10] 陈玉艳,王荣,张娟红,等.肠道菌群对药物代谢影响的研究进展[J].中国药理学通报,2019,35(2):168-172.
[11] 门薇,陈颖,李玉洁,等.肠道菌群对中药有效成分的生物转化研究进展[J].中国实验方剂学杂志,2015,21(2):229-234.
[12] 杨宝,范真,周联,等.大鼠肠道菌群对紫丁香苷体外代谢转化研究[J].中草药,2015,46(9):1333-1337.
[13] ZENG J,CAI HL,JIANG ZP,et al. A validated UPLC- MS/MS method for simultaneous determination of imatinib,dasatinib and nilotinib in human plasma[J]. J Pharm Anal,2017,7(6):374-380.
[14] 唐娟,吴耽,陈思颖,等.基于UPLC-ESI-Q-TOF-MS的红禾麻提取物化学成分分析[J].中国实验方剂学杂志,2018,24(24):67-72.
[15] 陈瑞.降糖化合物ZG02与 DKS26的药物代谢动力学研究[D].贵阳:贵州医科大学,2019.
[16] LECOMPTE Y,ROSSET M,RICHEVAL C,et al. UPLC- ESI-Q-TOF-MSE identification of urinary metabolites of the emerging sport nutrition supplement methoxyisoflavone in human subjects[J]. J Pharm Biomed Anal,2014,96(3):127-134.
[17] 李宇航,戴海学,汪明明,等.槲皮素的电喷雾离子阱质谱分析[J].质谱学报,2009,30(6):374-378.
[18] 伍明江,吴晓磊,张德芹,等. UPLC-Q-TOF/MS鉴定芦丁在大鼠体内的代谢产物[J].中国实验方剂学杂志,2017,23(17):91-97.
[19] 鞏仔鹏,吴林霖,伍萍,等.羊耳菊提取物在大鼠粪便中的代谢物分析[J].中国实验方剂学杂志,2017,23(24):100-105.
[20] TOMAS-BARBERAN F,GARC?A-VILLALBA R,QU- ARTIERI A,et al. In vitro transformation of chlorogenic acid by human gut microbiota[J]. Mol Nutr Food Res,2014,58(5):1122-1131.
[21] 李云,周明眉,邢丽娜,等.绿原酸的肠道菌群代谢研究进展[J].中草药,2015,46(4):610-614.
[22] TANG L,FENG Q,ZHAO J,et al.Involvement of UDP- glucuronosyltranferases and sulfotransferases in the liver and intestinal first-pass metabolism of seven flavones in C57 mice and humans in vitro[J]. Food Chem Toxicol,2012,50(5):1460-1467.
[23] 黎娜,杨淑婷,陆苑,等.利用超高效液相色谱质谱联用分析羊耳菊7种成分在大鼠尿液中的排泄过程[J].中国药学杂志,2019,54(21):1797-1803.
(收稿日期:2020-02-01 修回日期:2020-05-28)
(编辑:段思怡)
