不同品种及采收期党参药材中5种有效成分含量的比较研究
2020-09-02刘付松陈翠莎孙佩刘莎韦中兰刘小琪吴发明
刘付松 陈翠莎 孙佩 刘莎 韦中兰 刘小琪 吴发明
中圖分类号 R917 文献标志码 A 文章编号 1001-0408(2020)14-1677-06
DOI 10.6039/j.issn.1001-0408.2020.14.03
摘 要 目的:建立同时测定党参药材中党参炔苷、丁香苷、苍术内酯Ⅰ、苍术内酯Ⅱ和苍术内酯Ⅲ含量的方法,并比较不同品种及采收期党参药材中上述5种成分的含量。方法:采用高效液相色谱法(HPLC)。色谱柱为Inertsil ODS-3,流动相为乙腈-水(梯度洗脱),检测波长为210 nm(党参炔苷)、220 nm(苍术内酯Ⅱ、苍术内酯Ⅲ、丁香苷)、276 nm(苍术内酯Ⅰ),流速为0.8 mL/min,柱温为30 ℃,进样量为20 μL。结果:党参炔苷、丁香苷、苍术内酯Ⅰ、苍术内酯Ⅱ和苍术内酯Ⅲ检测质量浓度的线性范围为44.30~886.00 μg/mL(r=0.999 7)、6.50~130.03 μg/mL(r=0.999 6)、4.47~89.46 μg/mL(r=0.999 5)、2.53~50.50 μg/mL(r=0.999 4)、5.64~112.80 μg/mL(r=0.999 5);定量限分别为2.446 0、0.168 0、0.248 1、0.065 7、0.099 8 μg/mL,检测限分别为1.352 0、0.067 2、0.005 4、0.006 3、0.007 3 μg/mL;精密度、稳定性(24 h)、重复性、耐用性试验的RSD均小于2%;加样回收率分别为98.87%~100.62%(RSD=0.73%,n=6)、98.46%~101.54%(RSD=1.15%,n=6)、98.32%~101.12%(RSD=1.19%,n=6)、96.83%~104.16%(RSD=2.62%,n=6)、97.87%~100.99%(RSD=1.07%,n=6)。含量分别为33.78~431.82、0~20.60、0.44~3.68、0~10.83、0.27~73.40 μg/g。党参炔苷含量由高到低为党参>川党参>素花党参>洛党参;丁香苷为党参>素花党参>川党参,在洛党参中未检出;苍术内酯Ⅰ为素花党参>洛党参>党参>川党参;苍术内酯Ⅱ为党参>素花党参,在川党参和洛党参中未检出;苍术内酯Ⅲ为党参>素花党参>洛党参>川党参。6~10月采收的党参药材中均以党参炔苷含量最高;6~10月苍术内酯Ⅰ含量均较低;8月苍术内酯Ⅱ未检出;9月苍术内酯Ⅰ、苍术内酯Ⅱ含量较低,且丁香苷、苍术内酯Ⅱ在部分样品中未检出。结论:所建HPLC法操作简单、准确、灵敏度高、重复性好,可用于同时测定党参药材中5种有效成分的含量;不同品种及采收期党参药材中5种有效成分含量存在较大差异。
关键词 党参;党参炔苷;丁香苷;苍术内酯Ⅰ;苍术内酯Ⅱ;苍术内酯Ⅲ;高效液相色谱法;品种;采收期;含量测定
Comparative Study on Contents of 5 Active Ingredients in Different Varieties and Harvesting Periods of Codonopsis Radix
LIU Fusong1,CHEN Cuisha1,SUN Pei2,LIU Sha1,WEI Zhonglan1,LIU Xiaoqi1,WU Faming1(1. College of Pharmacy, Zunyi Medical University, Guizhou Zunyi 563003, China; 2. Industrial Crop Research Institute, Sichuan Academy of Agriculture Sciences, Chengdu 610300, China)
ABSTRACT OBJECTIVE: To establish a method for simultaneous determination of the contents of codonopatin, syringin, atractylenolide Ⅰ, atractylenolide Ⅱ and atractylenolide Ⅲ, and to compare the contents of above 5 components in different varieties and harvesting periods of Codonopsis Radix. METHODS: HPLC method was used. The column was Inertsil ODS-3 with mobile phase consisted of acetonitrile-water (gradient elution) at the flow rate of 0.8 mL/min. The detection wavelengths were 210 nm (codonopatin), 220 nm (syringin, atractylenolide Ⅱ, atractylenolide Ⅲ), 276 nm (atractylenolideⅠ). The column temperature was set at 30 ℃, and the sample size was 20 μL. RESULTS: The linear range of codonopatin, syringin, atractylenolide Ⅰ, atractylenolide Ⅱ and atractylenolide Ⅲ were 44.30-886.00 μg/mL (r=0.999 7), 6.50-130.03 μg/mL (r=0.999 6), 4.47-89.46 μg/mL (r=0.999 5), 2.53-50.50 μg/mL (r=0.999 4), 5.64-112.80 μg/mL (r=0.999 5); the limits of quantification were 2.446 0, 0.168 0, 0.248 1, 0.065 7, 0.099 8 μg/mL, and detection limits were 1.352 0, 0.067 2, 0.005 4, 0.006 3, 0.007 3 μg/mL; RSDs of precision, stability (24 h), repeatability and durability tests were all less than 2%; the recoveries were 98.87%-100.62% (RSD=0.73%, n=6), 98.46%-101.54% (RSD=1.15%, n=6), 98.32%-101.12% (RSD=1.19%, n=6), 96.83%-104.16% (RSD=2.62%, n=6), 97.87%-100.99% (RSD=1.07%, n=6). The average contents were 33.78-431.82,0-20.60,0.44-3.68,0-10.83,0.27-73.40 μg/g. The content of codonopatin was in descending order was as follows as Codonopsis pilosula>C. tangshen>C. pilosula Nannf. var. modesta (Nannf.) L. T. Shen>ecotypic variety of C. tangshen. The content of syringin in descending order was C. pilosula>C. pilosula Nannf. var. modesta (Nannf.) L. T. Shen>C. tangshen, but it was not detected in ecotypic variety of C. tangshen. The content of atractylenolide Ⅰ in descending order was C. pilosula Nannf. var. modesta (Namf.) L. T. Shen>ecotypic variety of C. tangshen>C. pilosula>C. tangshen. The content of atractylenolide Ⅱ in C. pilosula was higher than C. pilosula Nannf. var. modesta (Nannf.) L. T. Shen, but was no detected in C. tangshen and ecotypic variety of C. tangshen. The content of atractylenolide Ⅲ in descending order was C. pilosula>C. pilosula Nannf. var. modesta (Nannf.) L. T. Shen>ecotypic variety of C. tangshen>C. tangshen. In Codonopsis Radix collected from Jul. to Oct., the content of codonopatin was the highest; the content of atractylenolide Ⅰ was lower in sample collected from Jun. to Oct.; atractylenolide Ⅱ was not detected in sample collected in Aug.; the contents of atractylenolide Ⅰ and atractylenolide Ⅱ were the lower in sample collected in Sept., and syringin and atractylenolide Ⅱ were not detected in some samples. CONCLUSIONS: The established HPLC method is simple, accurate, highly sensitive and reproducible. It can be used to simultaneously determine 5 active ingredients contents of Codonopsis Radix; there are great difference in contents of 5 active ingredients in different varieties and harvesting periods of Codonopsis Radix.
KEYWORDS Codonopsis Radix; Codonopatin; Syringin; Atractylenolide Ⅰ; Atractylenolide Ⅱ; Atractylenolide Ⅲ; HPLC; Variety; Harvesting period; Content determination
党参(Codonopsis Radix)为桔梗科植物党参[Codonopsis pilosula(Franch.)Nannf.]、素花党参[C. pilosula Nannf. var. modesta(Nannf.)L. T. Shen]或川党参[C. tangshen Oliv.]的干燥根[1];洛党参(Ecotypic variety of C. tangshen)为桔梗科植物川党参(C. tangshen Oliv.)生态型变种的干燥根,是党参药材的重要地方栽培品种之一[2]。党参是我国常用的传统补益类中药,味甘、性平,具有补中益气、健脾益肺、除烦止渴之功效,可用于治疗脾肺虚弱、气短心悸、食少便溏、内热消渴等症[1]。该药主要含有糖类、半萜内酯类、聚炔类、苷类及萜类等化学成分[3-6]。现代药理研究表明,党参具有调节血糖、促进造血功能、抗缺氧、抗应激、抗疲劳、增强机体免疫力、延缓衰老、调节胃收缩、保护胃肠道黏膜及抗溃疡等作用[7-9]。聚炔类成分党参炔苷为党参的指标性成分,常用于评价党参质量[10];苷类成分丁香苷具有一定的体内外抗肿瘤活性[11];半萜内酯类成分苍术内酯Ⅰ~Ⅲ为党参的特征性成分,具有明显的抗炎活性[12]。
党参营养丰富、应用广泛,具有极大的食用和药用价值[13]。但因无序采挖,其野生资源面临枯竭,目前市场上流通的党参多为人工栽培品种[14]。有研究表明,由于基原、产地、采收期的不同以及栽培、产地加工的不规范,使得党参药材中各种有效成分的含量存在较大差异,从而导致其质量受到严重影响[15-19]。2015年版《中国药典》(一部)仅对党参进行了定性鉴别[1],且方法简单,无法满足现代产业发展的质量控制要求。虽然,有学者对党参中有效成分的含量进行了检测[10-12],但指标较少。根据中医理论,中药药效的发挥是多种成分共同作用的结果,其含量高低将直接影响中药疗效,因此仅以2~3种有效成分为指标并不能全面反映党参的整体质量[20-21]。为此,本研究采用高效液相色谱法(HPLC)同时测定了不同品种及采收期党参药材中党参炔苷、丁香苷、苍术内酯Ⅰ、苍术内酯Ⅱ和苍术内酯Ⅲ的含量,旨在为其质量控制提供科学依据。
1 材料
1.1 仪器
1260型HPLC仪,包括二元泵、自动进样器、二极管阵列紫外检测器(美国 Agilent 公司);ME-204E型万分之一电子分析天平、XPE-26型十万分之一电子分析天平(瑞士Mettler-Toledo公司);SK250H型超声波清洗机(上海科导超声仪器有限公司);Milli-Q Advantage A10 型超纯水仪(美国Millipore公司)。
1.2 药品与试剂
丁香苷对照品(四川省维克奇生物科技有限公司,批号:wkq16060805,纯度:98.00%);党参炔苷对照品(批号:MUST-16062207,纯度:98.88%)、苍术内酯Ⅰ对照品(批号:MUST-17030201,纯度:99.99%)、苍术内酯Ⅱ对照品(批号:MUST-17030202,纯度:99.99%)、苍术内酯Ⅲ对照品(批号:MUST-16032203,纯度:99.99%)均由成都曼斯特生物科技有限公司提供;甲醇、乙腈为色谱纯,其余试剂均为分析纯,水为纯化水。
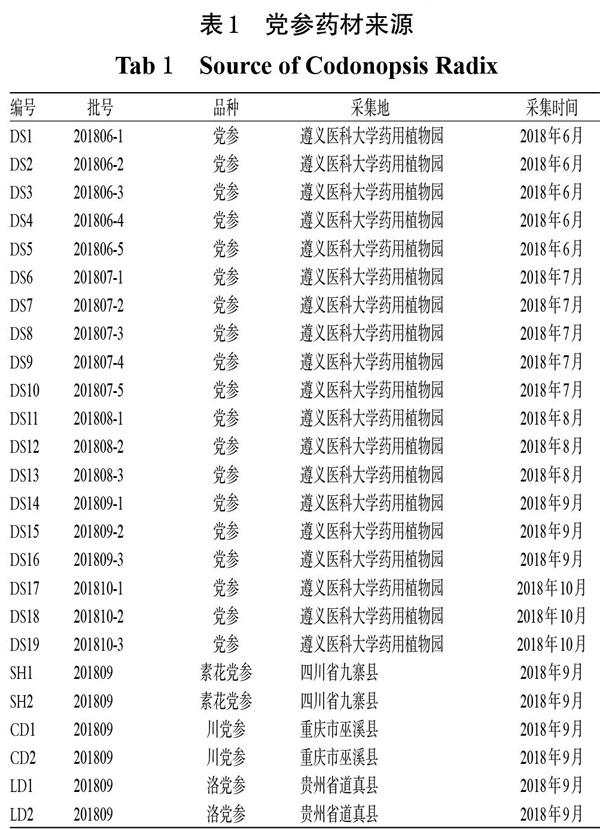
25批党参药材(编号:DS1~DS19、SH1~SH2、CD1~CD2、LD1~LD2)经遵义医科大学药学院姚秋阳副教授鉴定,分别为桔梗科植物党参[C. pilosula(Franch.)Nannf.)]、素花党参[C. pilosula Nannf. var. modesta(Nannf.)L. T. Shen]、川党参(C. tangshen Oliv.)以及栽培品种洛党参(Ecotypic variety of C. tangshen)的干燥根。党参药材来源见表1。
2 方法与结果
2.1 色谱条件
色谱柱:Inertsil ODS-3(250 mm×4.6 mm,5 μm);流动相:乙腈(A)-水(B),梯度洗脱(0~3 min,3.5%A;3~20 min,3.5%A→14%A;20~35 min,14%A→23%A;35~60 min,23%A→72%A;60~76 min,72%A→95%A);检测波长:210 nm(党参炔苷)、220 nm(苍术内酯Ⅱ、苍术内酯Ⅲ、丁香苷)、276 nm(苍术内酯Ⅰ);流速:0.8 mL/min;柱温:30 ℃;进样量:20 μL。
2.2 溶液的制备
2.2.1 混合对照品溶液 精密称取党参炔苷、丁香苷、苍术内酯Ⅰ、苍术内酯Ⅱ、苍术内酯Ⅲ对照品各适量,分别置于5 mL量瓶中,加30%甲醇溶解并稀释至刻度,得各单一对照品贮备液。精密量取上述各单一对照品贮备液适量,置于同一10 mL量瓶中,加30%甲醇稀释至刻度,制得上述5种成分质量浓度分别为886.00、130.03、89.46、50.50、112.80 μg/mL的混合对照品溶液。
2.2.2 供试品溶液 取党参药材适量,粉碎。精密称取上述粉末约1.0 g,置于50 mL具塞锥形瓶中,精密加入30%甲醇30 mL,密塞,稱定质量,超声(功率:400 W,频率:50 kHz)处理30 min,放冷,再次称定质量,用30%甲醇补足减失的质量,摇匀,经0.45 μm 微孔滤膜滤过,取续滤液,即得。
2.2.3 空白对照溶液 以30%甲醇为空白对照溶液。
2.3 系统适用性试验
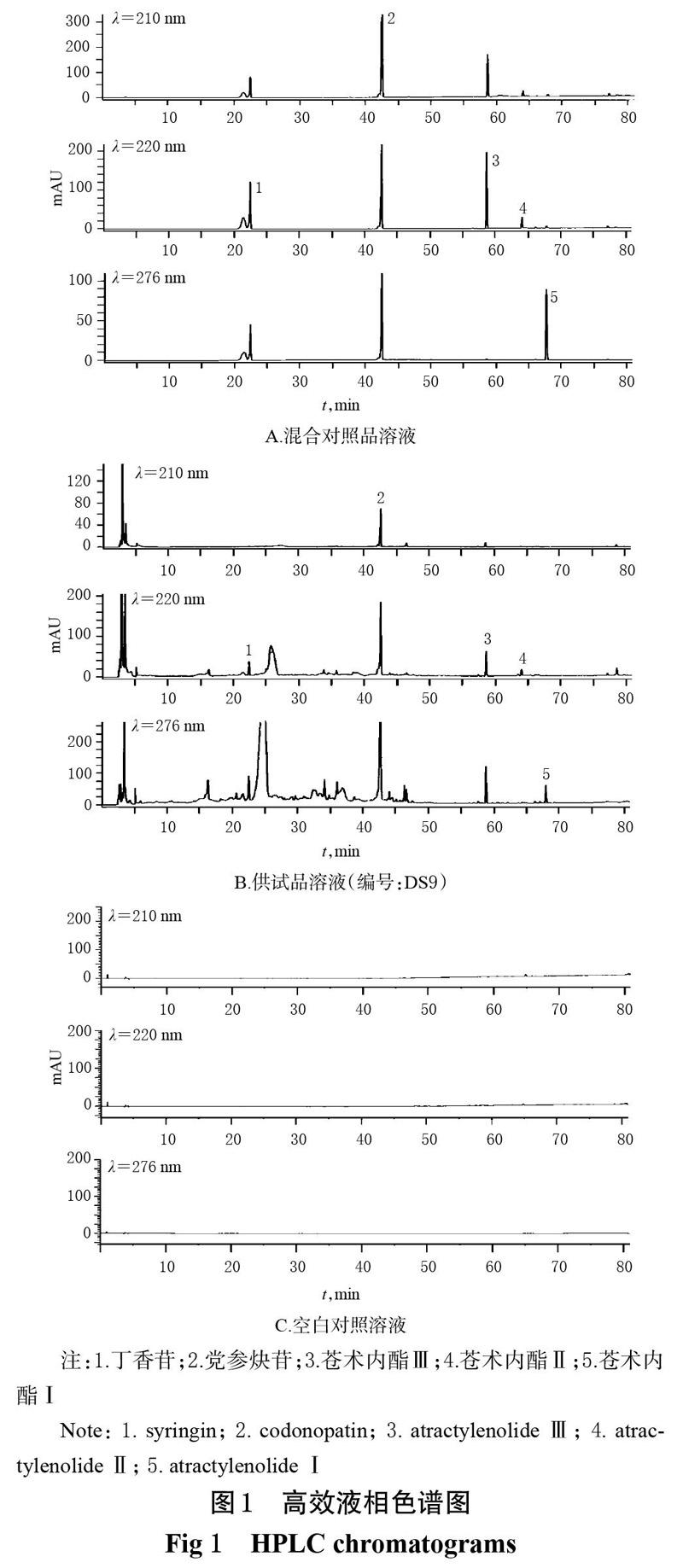
取“2.2”项下混合对照品溶液、供试品溶液、空白对照溶液适量,按“2.1”项下色谱条件进样测定,记录色谱图。结果,各成分理论板数按苍术内酯Ⅲ计均不低于3 000,分离度均大于3,空白对照对测定无干扰,详见图1。
2.4 线性关系考察
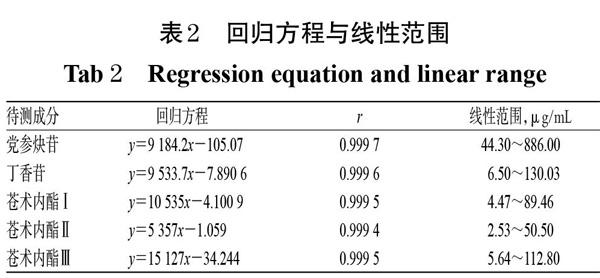
精密量取“2.2.1”项下混合对照品溶液0.25、1.0、2.0、3.0、4.0 mL,分别置于5 mL量瓶中,加入30%甲醇稀释并定容,得5个不同质量浓度的系列线性工作溶液,另取“2.2.1”项下混合对照品溶液,按“2.1”项下色谱条件进样测定,记录峰面积。以各待测成分质量浓度(x,μg/mL)为横坐标、峰面积(y)为纵坐标进行线性回归,结果见表2。
2.5 定量限与检测限考察
精密量取“2.2.1”项下混合对照品溶液适量,用甲醇倍比稀释,按“2.1”项下色谱条件进样测定,以信噪比10 ∶ 1、3 ∶ 1分别计算定量限、检测限。结果,党参炔苷、丁香苷、苍术内酯Ⅰ、苍术内酯Ⅱ、苍术内酯Ⅲ的定量限分别为2.446 0、0.168 0、0.248 1、0.065 7、0.099 8 μg/mL,检测限分别为1.352 0、0.067 2、0.005 4、0.006 3、0.007 3 μg/mL。
2.6 精密度试验
取“2.2.1”项下混合对照品溶液2.0 mL,置于5 mL量瓶中,加入30%甲醇稀释并定容,制得党参炔苷、丁香苷、苍术内酯Ⅰ、苍术内酯Ⅱ、苍术内酯Ⅲ质量浓度分别为354.40、52.01、35.78、20.20、45.12 μg/mL的溶液,按“2.1”项下色谱条件连续进样测定6次,记录峰面积。结果,上述5种成分峰面积的RSD分别为0.35%、0.18%、1.03%、0.64%、1.11%(n=6),表明仪器精密度良好。
2.7 稳定性试验
取“2.2.2”项下供试品溶液(编号:DS9)适量,分别于室温下放置0、2、4、8、12、16、24 h时按“2.1”项下色谱条件进样测定,记录峰面积。结果,党参炔苷、丁香苷、苍术内酯Ⅰ、苍术内酯Ⅱ和苍术内酯Ⅲ峰面积的RSD分别为0.15%、0.29%、1.81%、0.54%、0.21%(n=7),表明供试品溶液于室温下放置24 h内稳定性良好。
2.8 重复性试验
取党参药材(编号:DS9)粉碎,精密称取上述粉末适量,共6份,按“2.2.2”项下方法制备供试品溶液,再按“2.1”项下色谱条件进样测定,记录峰面积并按标准曲线法计算样品中5种成分的含量。结果,党参炔苷、丁香苷、苍术内酯Ⅰ、苍术内酯Ⅱ和苍术内酯Ⅲ的平均含量分别为335.54、11.87、3.01、8.02、24.41 μg/g,RSD分别为0.41%、0.98%、1.15%、0.84%、1.32%(n=6),表明方法重复性良好。
2.9 加样回收率试验
精密称取已知含量的党参药材(编号:DS9)粉末适量,共6份,精密加入已知含量的党参炔苷、丁香苷、苍术内酯Ⅰ、苍术内酯Ⅱ和苍术内酯Ⅲ各单一对照品适量,按“2.2.2”项下方法制备供试品溶液,再按“2.1”项下色谱条件进样测定,记录峰面积并计算加样回收率,结果见表3。
2.10 耐用性试验
取党参药材(编号:DS9)粉碎,精密称取上述粉末适量,按“2.2.2”项下方法制备供试品溶液,再按“2.1”项下色谱条件分别以不同流速(0.6、0.8、1.0 mL/min)、不同柱温(25、30、35 ℃)进样测定,记录峰面积并按标准曲线法计算样品中5种成分的含量。结果,5种成分含量的RSD均小于3%,表明方法耐用性良好。
2.11 样品含量测定
取25批党参药材粉碎,精密称取上述粉末适量,按“2.2.2”项下方法制备供试品溶液,再按“2.1”项下色谱条件进样测定,记录峰面积并按标准曲线法计算样品中5种成分的含量。每批样品平行测定3次,结果见表4(表中,“-”表示未检出)。
2.12 不同品种党参药材中5种有效成分含量的动态变化
不同品种党参药材中5种有效成分的含量存在差异。黨参炔苷含量由高到低为党参>川党参>素花党参>洛党参;丁香苷为党参>素花党参>川党参,在洛党参中未检出;苍术内酯Ⅰ为素花党参>洛党参>党参>川党参;苍术内酯Ⅱ为党参>素花党参,在川党参和洛党参中均未检出;苍术内酯Ⅲ为党参>素花党参>洛党参>川党参,详见图2(因党参炔苷含量过大,约为其他成分的20倍,可能会影响整体视图效果,故将该成分含量缩小20倍,缩小后不影响其含量变化趋势)。
2.13 不同采收期党参药材中5种有效成分含量的动态变化
6~10月采收的党参药材中均以党参炔苷含量最高;6~10月苍术内酯Ⅰ含量普遍较低;8月苍术内酯Ⅱ未检出;9月苍术内酯Ⅰ、苍术内酯Ⅱ含量较低,且丁香苷(LD1~LD2)、苍术内酯Ⅱ(SH1、CD1~CD2、LD1~LD2)在部分样品中未检出,详见图3(因党参炔苷含量过大,约为其他成分的15倍,在图中会影响整体视图效果,故将党参炔苷含量缩小15倍,缩小后不影响含量变化趋势)。
3 讨论
本课题组在前期预试验中,对5种待测成分在200~400 nm全波长范围内进行了紫外光谱扫描。结果发现,党参炔苷在210 nm,苍术内酯Ⅱ、苍术内酯Ⅲ、丁香苷在220 nm,苍术内酯Ⅰ在276 nm波长处均有较强吸收,且对应色谱峰峰形、分离度均较好,故选择多波长进行检测。本课题组分别对甲醇-水、乙腈-水等不同流动相体系进行了考察。结果显示,以乙腈-水为流动相进行梯度洗脱时,流动相洗脱能力强,各成分分离效果较好,基线平稳,出峰稳定且峰形尖锐,故选择乙腈-水为流动相。同时,本课题组还对不同提取溶剂(30%甲醇、70%甲醇、甲醇)进行了考察。结果显示,以30%甲醇为提取溶剂时,各成分色谱峰峰面积均高于其他提取溶剂,故选择30%甲醇为提取溶剂。此外,本课题组还对不同超声提取时间(30、45、60 min)进行了考察。结果发现,超声60 min时的峰面积低于超声30、45 min,而超声30、45 min提取时的峰面积差异不大,故考虑到节约时间和成本,本研究最终选择超声提取时间为30 min。
不同品种党参药材中5种有效成分含量存在较大差异,党参中党参炔苷、丁香苷、苍术内酯Ⅱ和苍术内酯Ⅲ的含量整体高于其他品种,素花党参中苍术内酯Ⅰ含量较高。究其原因可能与不同产地和不同来源党参受品种、气候、生长环境、土壤、水分、施肥及栽培方式等多种因素的影响有关[22-23]。6~10月采收的党参药材中均以党参炔苷含量最高;6~10月苍术内酯Ⅰ含量较低,8月苍术内酯Ⅱ未检出,9月丁香苷、苍术内酯Ⅱ含量较低。究其原因可能与不同采收期环境中生态因素(如土壤温度、空气温度、空气湿度、光合有效辐射等)会发生不同程度的变化等有关[24-25]。
综上所述,本研究所建HPLC法操作简单、准确、灵敏度高、重复性好,可用于同时测定不同品种及采收期党参药材中5种有效成分的含量;不同品种及采收期党参药材中5种有效成分的含量存在较大差异,基原和采收期可能是影响党参质量的因素之一。
参考文献
[ 1 ] 国家药典委员会.中华人民共和国药典:一部[S].2015年版.北京:中国医药科技出版社,2015:281-282.
[ 2 ] 刘春叶,张盈,廖国会,等.贵州道真县洛党参主要病害发生动态及防控对策[J].中国植保导刊,2018,38(9):53- 57.
[ 3 ] 朱斌,曾淼,刘林,等.党参中水溶性多糖研究进展[J].安徽农业科学,2016,44(19):109-110、118.
[ 4 ] WAKANA D,KAWAHARA N,GODA Y. Two new pyrrolidine alkaloids,codonopsinol C and codonopiloside A,isolated from Codonopsis pilosula[J]. Chem Pharm Bull:Tokyo,2013,61(12):1315-1317.
[ 5 ] TSAI TH,LIN LC. Phenolic glycosides and pyrrolidine alkaloids from Codonopsis tangshen[J]. Chem Pharm Bull:Tokyo,2008,56(11):1546-1550.
[ 6 ] 黄圆圆,张元,康利平,等.党参属植物化学成分及药理活性研究进展[J].中草药,2018,49(1):239-250.
[ 7 ] ZHANG P,HU L,BAI R,et al. Structural characterization of a pectic polysaccharide from Codonopsis pilosula and its immunomodulatory activities in vivo and in vitro[J]. Int J Biol Macromol,2017. DOI:10.1016/j.ijbiomac.
[ 8 ] LIU C,CHEN J,LI E,et al. The comparison of antioxidative and hepatoprotective activities of Codonopsis pilosula polysaccharide(CP)and sulfated CP[J]. Int Immunopharmacol,2015,24(2):299-305.
[ 9 ] 劉美霞,戚进,余伯阳.党参药理作用研究进展[J].海峡药学,2018,30(11):36-39.
[10] 张丽芬,戴晖.高效液相色谱法测定党参中党参多糖、党参炔苷的含量[J].临床合理用药杂志,2016,9(28):91- 92.
[11] 胡春阳,戴迪,穆希琼,等.以党参炔苷和紫丁香苷为指标成分的纹党与白条党的鉴别[J].时珍国医国药,2018,29(8):1882-1885.
[12] 贡东军,陈培云,庞艳苹,等.党参中党参炔苷和苍术内酯Ⅲ含量的反相高效液相色谱法同时测定[J].时珍国医国药,2015,26(1):70-72.
[13] 予辑.药食同源原料目录:2017版[J].口腔护理用品工业,2017,27(6):24-28.
[14] 郭宏波.野生与栽培党参遗传多样性及其保存和保护策略研究[D].上海:复旦大学,2007.
[15] 李家宇.不同基原党参异性分析和甜度评价方法构建[D].长沙:湖南中医药大学,2018.
[16] 陈前锋,侯鹏,刘巧,等.红外光谱法快速鉴别不同产地中药党参的研究[J].西南大学学报(自然科学版),2016,38(6):188-194.
[17] 于玲,范罗嫡,胡明华,等.甘肃不同产地党参HPLC指纹图谱研究[J].海峡药学,2018,30(10):38-40.
[18] 李富云,戴迪,穆希琼,等.纹党生长期内不同月份多糖含量变化研究[J].时珍国医国药,2018,29(5):1206-1208.
[19] 周刚,王停,何燕萍.中药新药研发中药材研究需关注的问题[J].中国中药杂志,2014,39(16):3192-3195.
[20] 王欣,覃瑶,王德江,等.一测多评法在中药质量控制中的应用进展[J].中成药,2016,38(2):395-402.
[21] 李婷婷,王新芳,马玲,等.谱效关系与一测多评相结合全面提升中药材质量控制标准[J].中国实验方剂学杂志,2014,20(19):225-228.
[22] 孟祥才,陈士林,王喜军.论道地药材及栽培产地变迁[J].中国中药杂志,2011,36(13):1687-1692.
[23] 孟祥才,黄璐琦,陈士林,等.论中药材栽培主产区的形成因素及栽培区划[J].中国中药杂志,2012,37(21):3334- 3339.
[24] 张甜,程林,杨林林,等.生态因子及关键酶基因表达对秋季黄芩采收期主要药效成分合成的影响[J].中草药,2019,50(4):936-944.
[25] 黄林芳,李文涛,王珍,等.濒危高原植物羌活化学成分与生态因子的相关性[J].生态学报,2013,33(24):7667- 7678.
(收稿日期:2019-09-13 修回日期:2020-05-30)
(编辑:陈 宏)
