枸杞子中甜菜碱含量测定方法的建立和提取方法的优化
2020-09-02黄钰馨马玲李苗郑国保马小荣
黄钰馨 马玲 李苗 郑国保 马小荣

中圖分类号 R927.2 文献标志码 A 文章编号 1001-0408(2020)14-1700-04
DOI 10.6039/j.issn.1001-0408.2020.14.07
摘 要 目的:建立枸杞子中甜菜碱的含量测定方法,并优化其提取方法。方法:采用高效液相色谱法测定枸杞子中甜菜碱的含量,色谱柱为Waters Spherisorb NH2,流动相为乙腈-0.01 mol/L磷酸二氢钾水溶液(75 ∶ 25,V/V),流速为0.7 mL/min,检测波长为195 nm,柱温为30 ℃,进样量为10 μL。以甜菜碱含量为指标,在单因素试验的基础上,采用L9(34)正交试验设计对枸杞子中甜菜碱超声提取的甲醇体积分数、提取时间、料液比进行筛选并进行验证。测定10批枸杞子中甜菜碱的含量,并与2015年版《中国药典》收录的薄层色谱法测定结果进行比较。结果:甜菜碱检测质量浓度的线性范围为2.035~2 035.04 μg/mL(R 2=0.999 3);检测限、定量限分别为0.410、2.051 μg/mL,平均加样回收率为97.41%~98.86%(RSD为0.8%~1.4%,n=3),精密度、重复性、稳定性(24 h)试验的RSD均不大于1.2%。最优提取方法为料液比1 ∶ 30(g/mL)投料、甲醇超声提取45 min。3次验证试验所得提取液中甜菜碱的平均含量为2.30%(RSD=0.43%, n=3)。10批枸杞子中甜菜碱的含量为1.91%~2.55%,与薄层色谱法的测定结果(1.88%~2.60%)无明显差异(相对误差为-1.92%~2.7%)。结论:成功建立了枸杞子中甜菜碱的含量测定方法,并优化了其提取工艺。
关键词 枸杞子;甜菜碱;高效液相色谱法;含量测定;提取方法
Establishment of the Content Determination Method of Betaine in Lycium barbarum and Optimization of the Extraction Method
HUANG Yuxin1,MA Ling1,LI Miao2,ZHENG Guobao2,MA Xiaorong1(1. Ningxia Hui Autonomous Region Institute of Drug Control, Yinchuan 750002, China; 2. Agricultural Biotechnology Research Center of Ningxia Academy of Agricultural and Forestry Sciences, Yinchuan 750002, China)
ABSTRACT OBJECTIVE: To establish the content determination method of betaine in Lycium barbarum, and to optimize the extraction method. METHODS:HPLC method was used to determine the content of betaine in L. barbarum. The determination was performed on Waters Spherisorb NH2 column with mobile phase consisted of acetonitrile-0.01 mol/L monopotassiun phosphate aqueous solution (75 ∶ 25, V/V) at the flow rate was 0.7 mL/min. The detection wavelength was 195 nm, and column temperature was 30 ℃. The sample size was 10 μL. Using the content of betaine as index, on the basis of single factor tests, L9(34) orthogonal test design were used to select the methanol volume fraction, extraction time and solid-liquid ratio of betaine in L. barbarum by ultrasonic extraction. The contents of betaine in 10 batches L. barbarum were determined, and compared with the results of TLC included in 2015 edition of Chinese Pharmacopeia. RESULTS: The linear range of betaine was 2.035-2 035.04 μg/mL(R2=0.999 3). The limits of detection and quantification were 0.410 μg/mL and 2.051 μg/mL, respectively. The average recovery were 97.41%-98.86% (RSDs were 0.8%-1.4%, n=3). RSDs of precision, reproducibility and stability (24 h) tests were not higher than 1.2%. The optimal extraction method included solid-liquid ration of 1 ∶ 30 (g/mL), ultrasonic extraction with methanol for 45 min. The average content of betaine in the extract from the three validation tests was 2.30% (RSD=0.43%, n=3). The contents of betaine in 10 batches L. barbarum were 1.91%-2.55%, which was no significantly different from the results of TLC (1.88%-2.60%)(RE were -1.92%-2.79%). CONCLUSIONS: The content determination method of betaine in L. barbarum was established successfully, and the extraction process was optinized.
KEYWORDS Lycium barbarum; Betaine; HPLC; Content determination; Extraction method
枸杞子为茄科植物宁夏枸杞(Lycium barbarum L.)的干燥成熟果实[1],是我国传统中药材,具有治疗糖尿病[2]、保护视网膜[3]、抗氧化[4]等作用。甜菜碱是枸杞果实、叶、柄中主要的生物碱类成分,在人体内起甲基供体的作用[5],具有促进脂肪代谢、调节渗透压、抗应激等功效[6-8],被认为是枸杞子的主要活性物质之一[9]。目前,2015年版《中国药典》(一部)记载的枸杞子中甜菜碱含量测定方法为薄层色谱法[1],该方法操作繁琐、人为因素影响较大、灵敏度低、分离效果和重现性较差。高效液相色谱法(HPLC)作为一种现代分离分析技术,已被广泛应用于中药化学成分的分离分析和含量测定中[10-12]。已有研究报道,采用HPLC法测定甜菜碱提取物的含量,但多使用蒸发光散射检测器,且柱前衍生等样品处理和提取方法较为复杂[13-16],使得上述方法的精密度或准确性均受影响。在此基础上,本研究建立了测定枸杞子中甜菜碱含量的HPLC法;并以甜菜碱含量为指标,采用单因素试验和正交试验对其提取方法进行了筛选;同时,将所建HPLC法与《中国药典》方法进行了比较,旨在为枸杞子的质量控制和甜菜碱的提取提供方法支持。
1 材料
1.1 仪器
1260型HPLC仪(美国Agilent 公司);XS205DU型电子天平[梅特勒-托利多仪器(上海)有限公司];CQ- 200B-DST型超声波清洗器(上海跃进医用光学器械厂);800Y型粉碎机(永康市铂欧五金制品有限公司)。
1.2 药品与试剂
甜菜碱对照品(中国食品药品检定研究院,批号:110894-201604,纯度:99.2%);10批枸杞子药材(批号:NKY01~NKY10)采自宁夏银川市贺兰县项目实验基地,由宁夏农林科学院农业生物技术研究中心郑国保副研究员鉴定为宁夏枸杞(L. barbarum L.)的成熟果实;甲醇、乙腈为色谱纯,磷酸二氢钾等其余试剂均为分析纯,水为纯化水。
2 方法与结果
2.1 甜菜碱含量测定方法的建立
2.1.1 对照品溶液制备
精密称取甜菜碱对照品适量,置于15 mL量瓶中,加入甲醇溶解、稀释并定容,制成质量浓度为5.087 6 mg/mL的对照品贮备液。精密量取上述对照品贮备液1 mL,置于5 mL量瓶中,用甲醇稀释至刻度,摇匀,制成质量浓度為1 017.5 μg/mL的对照品溶液。
2.1.2 供试品溶液制备
取枸杞子样品,于50 ℃烘干后,冷冻,粉碎,过二号筛,精密称取粉末1.0 g,按一定方法提取后,用0.45 μm滤膜滤过,取续滤液作为供试品溶液。
2.1.3 色谱条件
色谱柱:Waters Spherisorb NH2(250 mm×4.6 mm,5 μm);流动相:乙腈-0.01 mol/L磷酸二氢钾水溶液(75 ∶ 25,V/V);流速:0.7 mL/min;检测波长:195 nm;柱温:30 ℃;进样量:10 μL。取对照品溶液、供试品溶液(批号:NKY01)和空白溶剂(甲醇)各适量,进样测定,记录色谱图,详见图1。
2.1.4 标准曲线绘制
精密量取“2.1.1”项下对照品贮备液0.002、0.01、0.1、0.5、1.0、1.5、2.0 mL,分别置于5 mL量瓶中,加入甲醇稀释至刻度,得系列工作溶液。按“2.1.3”项下色谱条件进样测定,记录峰面积。以甜菜碱的质量浓度(x,μg/mL)为横坐标、峰面积(y)为纵坐标进行线性回归,得回归方程为y=2 848x+13.10(R 2=0.999 3),甜菜碱检测质量浓度的线性范围为2.035~2 035.04 μg/mL。
2.1.5 检测限和定量限考察
精密量取“2.1.1”项下对照品贮备液适量,用甲醇逐级稀释,分别以信噪比为3 ∶ 1、10 ∶ 1计算检测限、定量限。结果,甜菜碱的检测限为0.410 μg/mL,定量限为2.051 μg/mL。
2.1.6 精密度试验
精密量取“2.1.1”项下质量浓度为1 017.5 μg/mL的对照品溶液适量,按“2.1.3”项下色谱条件连续进样测定6次,记录峰面积。结果,甜菜碱峰面积的RSD为0.5%(n=6),表明仪器精密度良好。
2.1.7 重复性试验
精密称取枸杞子样品(批号:NKY01),共6份,按“2.1.2”项下方法制备供试品溶液,再按“2.1.3”项下色谱条件进样测定,记录峰面积,按外标法计算甜菜碱的含量。结果,甜菜碱含量的RSD为1.0%(n=6),表明该方法重复性良好。
2.1.8 稳定性试验
精密量取“2.1.2”项下供试品溶液(批号:NKY01)适量,分别于室温下放置0、4、8、12、16、20、24 h时按“2.1.3”项下色谱条件进样测定,记录峰面积。结果,甜菜碱峰面积的RSD为1.2%(n=7),表明供试品溶液在室温下放置24 h内稳定性良好。
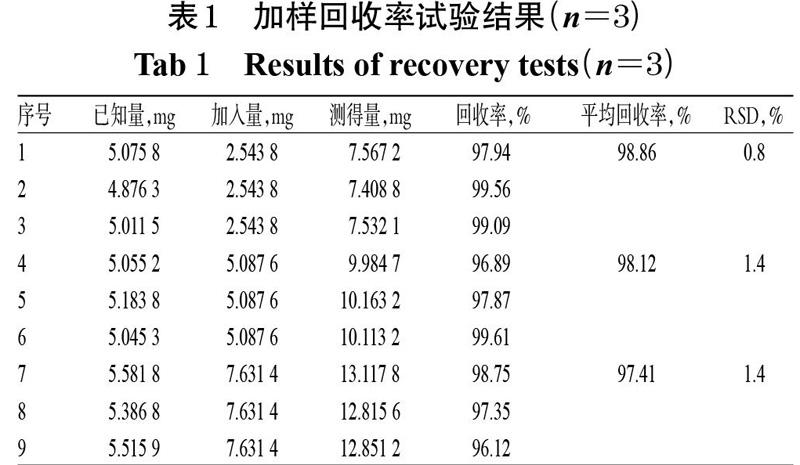
2.1.9 加样回收率试验
精密称取已知含量的枸杞子样品(批号:NKY01),粉碎,取粉末9份,置于具塞锥形瓶中,分别精密加入“2.1.1”项下对照品贮备液0.5、1.0、1.5 mL,按“2.1.2”项下方法制备供试品溶液,再按“2.1.3”项下色谱条件进样测定,记录峰面积并计算加样回收率,结果见表1。
2.2 甜菜碱提取方法筛选
2.2.1 单因素试验
(1)提取方法:精密称取干燥后的枸杞子样品(批号:NKY01)6份,每份1.0 g,分别置于具塞锥形瓶中,精密加入甲醇30 mL,称定质量。取3份超声(功率:250 W,频率:33 kHz,下同)提取60 min,另外3份加热回流提取60 min,均冷却至室温,再次称定质量,用甲醇补足减失的质量,摇匀,用0.45 μm滤膜滤过,取续滤液,按“2.1.3”项下色谱条件进样测定,记录峰面积并按外标法计算甜菜碱含量。结果,超声提取和加热回流提取的提取液中甜菜碱的平均含量分别为2.20%和2.19%(n=3),兩种方法所得甜菜碱的含量相似。故综合考虑实际操作和人为影响,最终选择超声提取作为枸杞子中甜菜碱的提取方法。
(2)提取溶剂:精密称取干燥后的枸杞子样品(批号:NKY01)7份,每份1.0 g,分别置于具塞锥形瓶中,精密加入甲醇、80%甲醇、70%甲醇、60%甲醇、50%甲醇、水和0.1 mol/L盐酸溶液各30 mL,称定质量,超声处理40 min,冷却至室温,再次称定质量,用相应提取溶剂补足减失的质量,摇匀,用0.45 μm滤膜滤过,取续滤液,按“2.1.3”项下色谱条件进样测定,记录峰面积并按外标法计算甜菜碱含量。结果,上述溶剂提取液中甜菜碱的含量分别为2.21%、2.10%、1.95%、1.82%、1.80%、1.51%、1.43%,其中含量较高的溶剂依次为甲醇、80%甲醇、70%甲醇。
(3)提取时间:精密称取干燥后的枸杞子样品(批号:NKY01)8份,每份1.0 g,分别置于具塞锥形瓶中,精密加入甲醇30 mL,称定质量,分别超声提取20、25、30、35、40、45、50、55 min,冷却至室温,再次称定质量,用甲醇补足减失的质量,摇匀,用0.45 μm滤膜滤过,取续滤液,按“2.1.3”项下色谱条件进样测定,记录峰面积并按外标法计算甜菜碱含量。结果,上述提取时间提取液中甜菜碱的含量分别为1.68%、1.85%、2.02%、2.10%、2.13%、2.20%、2.21%、2.19%。可见,当提取时间超过45 min后,甜菜碱含量的变化不大。
(4)料液比:精密称取干燥后的枸杞子样品(批号:NKY01)5份,每份1.0 g,分别置于具塞锥形瓶中,精密加入甲醇10、20、30、40、50 mL,即料液比分别为1 ∶ 10、1 ∶ 20、1 ∶ 30、1 ∶ 40、1 ∶ 50(g/mL),称定质量,超声提取45 min,放至室温,再次称定质量,用甲醇补足减失的质量,摇匀,用0.45 μm滤膜滤过,取续滤液,按“2.1.3”项下色谱条件进样测定,记录峰面积并按外标法计算甜菜碱含量。结果,上述料液比提取液中甜菜碱含量分别为1.85%、1.92%、2.20%、2.21%、2.19%。可见,当料液比为1 ∶ 30、1 ∶ 40、1 ∶ 50时甜菜碱含量较高,且差异不大。
2.2.2 正交试验
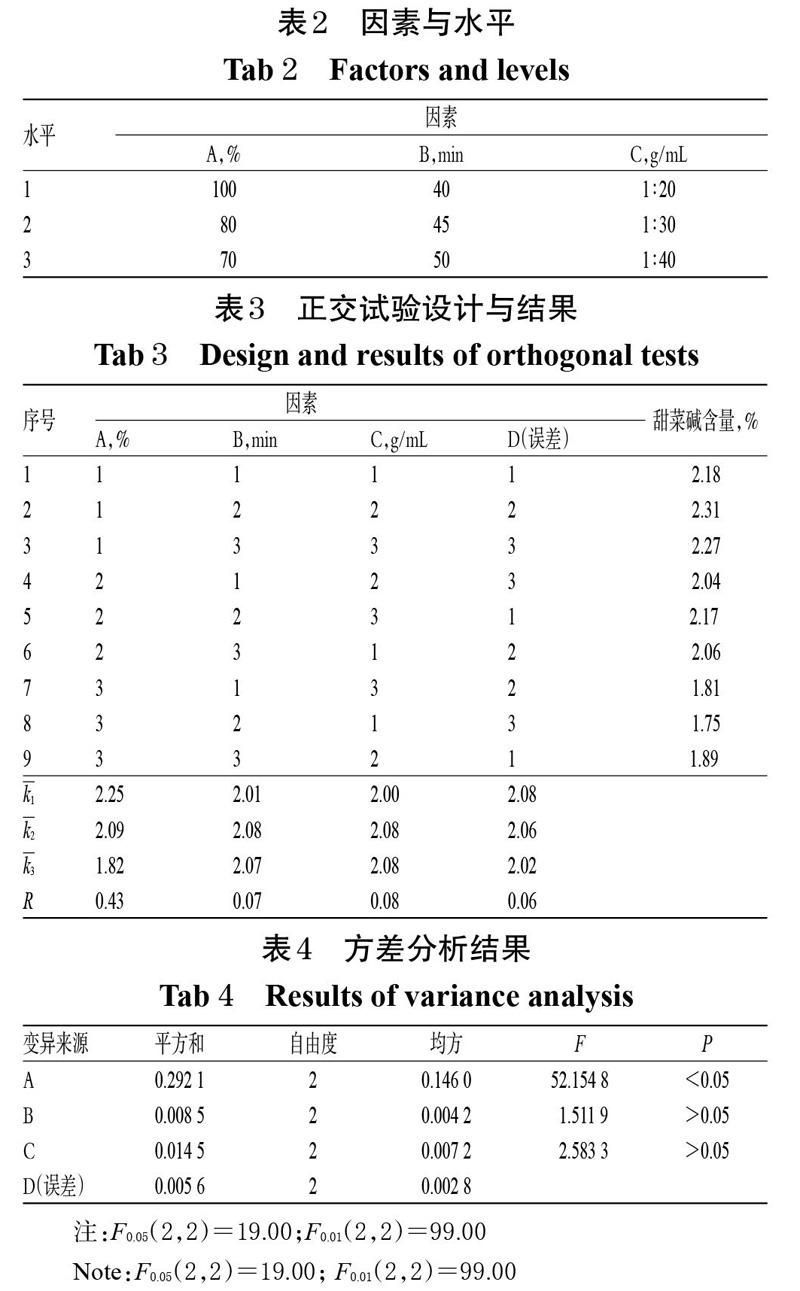
在单因素试验结果的基础上,以甲醇体积分数(A,%)、提取时间(B,min)、料液比(C,g/mL)为考察因素,甜菜碱含量为指标,采用L9(34)正交试验设计对枸杞子中甜菜碱的提取方法进行优化。因素与水平见表2,正交试验设计与结果见表3,方差分析结果见表4。
由表3结果可知,各因素对甜菜碱含量影响程度的排序为A>C>B,即甲醇体积分数>料液比>提取时间。由表4方差分析结果可知,甲醇体积分数对甜菜碱含量有显著影响(P<0.05),提取时间和料液比对甜菜碱含量无显著影响(P>0.05)。综合考虑极差分析和方差分析结果,确定最优提取条件为A1B2C2,即以料液比1 ∶ 30投料,甲醇超声提取45 min。
精密称取枸杞子(批号:NKY01)1.0 g,共3份,按上述最优提取条件超声提取甜菜碱,按“2.1”项下方法进样测定,记录峰面积并按外标法计算提取液中甜菜碱含量。结果,甜菜碱平均含量为2.30%(RSD=0.43%,n=3),表明此提取方法可行。
2.3 含量测定方法比较
分别取10批枸杞子样品各1 g,按“2.2.2”项下最优提取方法提取,按“2.1.2”项下方法制备供试品溶液,再按“2.1.3”项下色谱条件进样测定,记录峰面积并按外标法计算甜菜碱含量;同时,按照2015年版《中国药典》(一部)中收录的薄层色谱法[1]测定供试品溶液中甜菜碱含量,结果见表5。由表5可见,两种方法测定结果的相对误差为-1.92%~2.79%,表明两种方法测定结果几乎无明显差异。
3 讨论
3.1 色谱条件的选择
由于枸杞子中成分具有多样性,将目标成分与其他成分有效分离是进行定量分析的关键。本课题组前期考察了不同色谱柱[Agilent Zorbax NH2色谱柱(150 mm×4.6 mm,5 μm)、Agilent Zorbax 300-SCXA色谱柱(250 mm×4.6 mm,5 μm)、Waters Spherisorb NH2色谱柱(250 mm×4.6 mm,5 μm)]、不同流动相比例(60 ∶ 40、70 ∶ 30、75 ∶ 25、80 ∶ 20,V/V)对甜菜碱分离的影响。结果,Waters Spherisorb NH2柱中甜菜碱色谱峰与其他成分色谱峰的分离效果优于其他色谱柱,且当乙腈-0.01mol/L磷酸二氢钾水溶液的比例为75 ∶ 25(V/V)时,色谱峰之间分离效果较好。
3.2 浸润提取法的考察
本研究在前期筛选提取方法时,还考察了浸润提取法的提取效果,分别测定了浸润20、25、30、35、40、45、50、55 min时同一批枸杞子(批号:NKY01)提取液中甜菜碱的含量。结果,上述提取时间的提取液中甜菜碱含量均低于2.00%,均较超声提取法和加热回流提取法的含量低,故未将该法列入单因素试验。
综上所述,本研究建立了甜菜碱含量测定的HPLC法,并通过单因素试验和正交试验筛选了枸杞子中甜菜碱的最佳提取方法,通过比较本研究所建HPLC法测定结果与《中国药典》薄层色谱法测定结果的差异,发现几乎无明显差异。由此表明,本研究成功建立了枸杞子中甜菜碱的定量分析方法和提取方法,可为枸杞子中甜菜碱的含量测定提供方法支持。
参考文献
[ 1 ] 国家药典委员会.中华人民共和国药典:一部[S].2015年版.北京:中国医药科技出版社,2015:249.
[ 2 ] LIND B,JIANG Y,WARK L,et al. Dietary wolfberry increases hepatic insulin sensitivity in obese mice[J]. FASEB J,2012,6(3):828-837.
[ 3 ] CHU PHW,LI HY,CHIN MP,et al. Effect of lyciumbarbarum(Wolfberry)polysaccharides on preserving retinal function after partial optic nerve transaction[J]. PLoS One,2013. DOI:10.1371/journal.pone.0081339.
[ 4 ] 武改梅,賈跃胜,袁世宏.枸杞抗癌的免疫药理研究进展[J].中国药房,2002,13(1):54-55.
[ 5 ] 史蓉,李婷婷,周丽,等.甘肃枸杞功能性物质及其功效研究综述[J].甘肃农业科技,2019(9):81-86.
[ 6 ] 李炳龙,齐永秀,马向忠,等.甜菜碱药物分析进展[J].泰山医学院学报,2008,29(3):238-240.
[ 7 ] 张宇金,高世勇,何立巍,甜菜碱的生物活性研究[J].哈尔滨商业大学学报(自然科学版),2006,22(1):13-16.
[ 8 ] 贺天雨,乐胜锋,杜宁,等.液相色谱法在枸杞甜菜碱含量测定中的应用[J].食品安全质量检测学报,2019,10(11):3444-3451.
[ 9 ] 谢忱,徐丽珍,李宪铭,等.枸杞子化学成分研究[J].中国中药杂志,2001,26(5):323-324.
[10] 张怡,张宗山,王芳,等.高效液相色谱法测定阿维菌素在枸杞果实中的残留动态[J].西北农业科技大学学报(自然科学版),2006,34(12):181-184.
[11] 翟雪蓓,武晓媛,徐晓阳,等.高效液相色谱测定中药夏枯草活性成分含量[J].世界最新医学信息文摘,2019,19(69):118.
[12] 鄢玉芬,徐双美,梁乙川,等. HPLC法测定不同贮藏条件下川芎中10种化学成分的含量[J].中国药房,2019,30(6):807-812.
[13] 卢艳婷.枸杞中甜菜碱的含量测定[J].食品安全导刊,2018(18):49-50.
[14] 梁景辉,贾芙蓉,时璐,李攀龙.HPLC-ELSD测定枸杞子中甜菜碱的含量[J].中国处方药,2016,14(2):32-33.
[15] 谷大建,李旭. SPE-HPLC法测定枸杞中甜菜碱的含量[J].齐鲁药事,2007,4(12):213-214.
[16] 张自萍,郭荣,廖国玲,等.枸杞甜菜碱含量测定方法的比较研究[J].西北农业学报,2007,16(6):292-295.
(收稿日期:2020-03-20 修回日期:2020-06-04)
(编辑:邹丽娟)
