灯盏花素胃黏附片的制备及质量评价
2020-09-02刘巍刘文宋信莉王冠华汪云霞李云凯
刘巍 刘文 宋信莉 王冠华 汪云霞 李云凯
中圖分类号 R944.4;R927.11 文献标志码 A 文章编号 1001-0408(2020)14-1690-05
DOI 10.6039/j.issn.1001-0408.2020.14.05
摘 要 目的:制备灯盏花素胃黏附片,并进行处方优化和质量评价。方法:以羟丙甲纤维素K100M、卡波姆934P为生物黏附剂和骨架材料,以乳糖为填充剂,以硬脂酸镁为助流剂、润滑剂,采用粉末直接压片法制备灯盏花素胃黏附片。采用加权法对灯盏花素胃黏附片在pH 6.8磷酸盐缓冲液中第2、6、12 h的累积释放度(Q2 h、Q6 h、Q12 h,以灯盏乙素计,由高效液相色谱法测定)评分和体外胃组织黏附力进行综合评分;以此评分为指标,通过L9(34)正交试验设计优化灯盏花素胃黏附片中羟丙甲纤维素K100M、卡波姆934P及乳糖的用量并进行验证。对所制胃黏附片的性质、鉴别、重量差异、脆碎度、释放度、灯盏乙素含量进行考察。结果:灯盏花素胃黏附片的最优处方为42%灯盏花素提取物、10%羟丙甲纤维素K100M、3%卡波姆934P和45%乳糖;验证试验结果显示,所制3批灯盏花素胃黏附片的平均Q2 h、Q6 h、Q12 h分别为20.36%、48.55%、87.00%,平均体外胃组织黏附力为31.36 g/cm2,平均综合评分为70.23(RSD=1.84%,n=3)。所制胃黏附片为淡黄色,味淡或微咸;其出峰时间与灯盏乙素对照品一致;重量差异为±6%,脆碎度为0.54%,Q12 h为83.51%(RSD=2.14%,n=6);灯盏乙素含量为288.47 mg/g(RSD=0.70%,n=3)。结论:成功制得灯盏花素胃黏附片,其质量评价符合2015年版《中国药典》要求。
关键词 灯盏花素;胃黏附片;处方优化;质量评价
Preparation and Quality Evaluation of Breviscapine Gastric Adhesive Tablets
LIU Wei1,LIU Wen2,SONG Xinli1,WANG Guanhua1,WANG Yunxia1,LI Yunkai1(1. School of Pharmacy, Guizhou University of TCM, Guiyang 550002, China; 2. Party Office, the Affiliated Hospital of Guizhou Medical University, Guiyang 550004, China)
ABSTRACT OBJECTIVE: To prepare Breviscapine gastric adhesive tablets, to optimize the formulation and to evaluate the quality. METHODS: HPMC K100M and carbomer 934P were used as bioadhesives and skeleton materials, and lactose was used as filler, and magnesium stearate was used as glidant and lubricant to prepare Breviscapine gastric adhesive tablets by direct powder pressing method. The comprehensive scores of scores of accumulative release rate of Breviscapine gastric adhesive tablets in pH 6.8 PBS at 2, 6, 12 h (Q2 h, Q6 h, Q12 h,with scutellarin meter,by HPLC method) and in vitro adhesion force of gastric tissue were evaluated by weighting method. Taking this scores as indexes, L9(34) orthogonal test design was used to optimize the amount of HPMC K100M, carbomer 934P and lactose in Breviscapine gastric adhesive tablets and validation tests were conducted. The properties, identification, weight difference, fragility, release and the content of scutellarin of the gastric adhesive tablets were determined. RESULTS: The optimal prescription of Breviscapine gastric adhesive tablets were 42% breviscapine, 10% HPMC K100M, 3% carbomer 934P and 45% lactose. The verification test results show that the Q2 h, Q6 h, Q12 h of 3 batches of Breviscapine gastric adhesive tablets were 20.36%, 48.55%, and 87.00% ; the average in vitro adhesion force of gastric tissue was 31.36 g/cm2;the average comprehensive score was 70.23 (RSD=1.84%, n=3). The gastric adhesive tablets were light yellow, tasteless or slightly salty; the peak time was consistent with that of scutellarin control; its weight difference were ±6%, the fragility was 0.54%, and the Q12 h was 83.51% (RSD=2.14%, n=6). The content of scutellarin was 288.47 mg/g(RSD=0.70%,n=3). CONCLUSIONS: Breviscapine gastric adhesive tablets is prepared successfully, and its quality evaluation conforms to the requirements of Chinese Pharmacopoeia (2015 edition).
KEYWORDS Breviscapine; Gastric adhesive tablets; Formulation optimization; Quality evaluation
灯盏花素(Breviscapine)是从菊科植物短葶飞蓬[Erigeron breviscapus (Vant.) Hand.-Mazz.]中提取出来的黄酮类有效成分,是以灯盏乙素为主、另含有少量灯盏甲素的混合物[1]。现代药理研究表明,灯盏花素具有改善血流量、抗血小板凝聚、抗氧自由基、抗血栓等作用[2],临床上主要用于冠心病、脑血栓、脑出血和心绞痛等心脑血管疾病的治疗[3]。但灯盏花素是弱酸性成分,在结肠、盲肠环境中不稳定,易被肠道酶酶解为苷元[4],限制了其临床应用。有研究显示,当胃内pH较低时,灯盏花素的油水分配系数相对较大,脂溶性较好,跨膜吸收比较容易,所以延长其在胃内的滞留时间可有助于提高灯盏花素的治疗效果[4]。
胃肠道生物黏附给药系统(Gastrointestinal bioadhesive drug delivery system)是指通过使用黏附材料,使制剂黏附于胃上皮细胞表面,延长药物在胃内的滞留时间,促进其吸收并提高生物利用度的给药系统[5]。根据心脑血管疾病需要长期服药的特点以及患者用药的方便性,口服给药是最佳的给药方式[6];再则,已有研究报道指出,灯盏花素的半衰期短,吸收机制是被动扩散,吸收过程属一级动力学过程,表明灯盏花素可被制成口服缓释制剂[7-8]。基于上述因素,笔者考虑将灯盏花素制成胃黏附片,采用正交试验设计对其处方进行优化,并对所得胃黏附片质量进行评价,旨在通过延长灯盏花素在胃内的滞留时间,以达到提高药物累积释放度、促进药物吸收的目的,旨在为灯盏花素新制剂的开发提供参考。
1 材料
1.1 仪器
LC-20AT型高效液相色谱(HPLC)仪(日本Shimadzu公司);SK8210HP型超声波清洗器(上海科导超声仪器有限公司);DZF-6210型真空干燥箱(上海齐欣科学仪器有限公司);RC-3型溶出测试仪(天津市国铭医药设备有限公司);TDP-5型单冲压片机(长沙岳麓区中南制药机械厂);黏附力测定装置(贵州中医药大学药学院自制)。
1.2 药品与试剂
灯盏乙素对照品(成都克洛玛生物科技有限公司,批号:CHB160922,纯度:≥98%);灯盏花素提取物(陕西柏科生物科技有限公司,批号:190301,纯度:以灯盏乙素计不低于95%);卡波姆934P、羟丙甲纤维素K100M、乳糖、硬脂酸镁(上海源叶生物科技有限公司,批号:s24447、s14176、s25132、s24259);甲醇、磷酸(天津市科密欧化学试剂有限公司,批号:20190303、20190806,色谱纯);磷酸二氢钾、氢氧化钠(重庆川东化工有限公司,批号:20140901、20170501);其余试剂均为分析纯,水为纯净水。
1.3 动物
健康新西兰大白兔1只,雄性,体质量2.5 kg,由贵州医科大学实验动物中心提供,动物使用许可证号:SYXK(黔)2018-0001。动物于清洁、通风、采光好的环境下饲养,并自由饮食饮水。
2 方法与结果
2.1 灯盏花素胃黏附片的制备
以羟丙甲纤维素K100M、卡波姆934P为生物黏附剂和骨架材料,以乳糖为填充剂,以硬脂酸镁为助流剂、润滑剂制备灯盏花素胃黏附片。分别称取处方比例的灯盏花素提取物、羟丙甲纤维素K100M、卡波姆934P、乳糖,按等量递加法混匀,加入1%硬脂酸镁混合均匀后过80目筛,采用粉末直接压片法以单冲压片机压片,每片重50 mg。
2.2 灯盏乙素的含量测定
采用HPLC法测定。
2.2.1 对照品溶液的制备 精密称取灯盏乙素对照品适量,加入甲醇溶解并定容至10 mL量瓶中,制成质量浓度为0.96 mg/mL的对照品溶液,备用。
2.2.2 供试品溶液的制备 取灯盏花素胃黏附片10片,研细,精密称取50 mg,置于10 mL量瓶中,加入pH 6.8的磷酸盐缓冲液,超声(功率:500 W,频率:53 kHz)处理30 min,放冷,并用磷酸盐缓冲液定容,经0.45 μm微孔滤膜滤过,取续滤液,置于25 mL量瓶中,用甲醇定容,即得。
2.2.3 空白对照溶液的制备 按灯盏花素胃黏附片处方比例精密称取除灯盏花素外的其余辅料21 mg于10 mL量瓶中,按“2.2.2”项下方法制备空白对照溶液。
2.2.4 色谱条件 色谱柱:Agilent Zorbax SB-C18(250 mm×4.6 mm,5 μm);流动相:甲醇-0.2%磷酸水溶液(45 ∶ 55,V/V);流速:1.0 mL/min;检测波长:335 nm;柱温:35 ℃;进样量:10 μL。
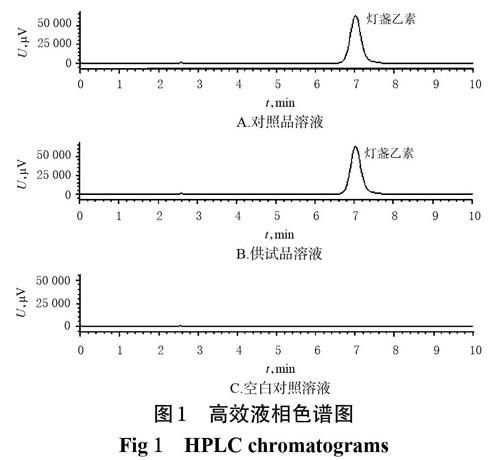
2.2.5 专属性试验 取对照品溶液(用甲醇稀释成57.6 μg/mL)、供试品溶液和空白对照溶液各适量,按“2.2.4”项下色谱条件进样分析,记录色谱图。结果,灯盏乙素的保留时间约为7.0 min,色谱峰峰形对称,溶剂与辅料对其测定无干扰,表明方法专属性较好,详见图1。
2.2.6 标准曲线绘制 精密量取灯盏乙素对照品溶液0.05、0.1、0.2、0.4、0.6、0.8 mL,分别置于10 mL量瓶中,加入甲醇稀释至刻度,混匀,得不同质量浓度的系列线性工作溶液,按“2.2.4”项下色谱条件进样分析,记录峰面积。以灯盏乙素质量浓度(x,μg/mL)为横坐标、峰面积(y)为纵坐标进行线性回归,得回归方程为y=25 950x+6 405.5(R 2=0.999 8),結果表明,灯盏乙素检测质量浓度的线性范围为4.80~76.80 μg/mL。
2.2.7 精密度试验 精密吸取灯盏乙素对照品溶液适量,用甲醇稀释至57.6 μg/mL,按“2.2.4”项下色谱条件连续进样6次,记录峰面积。结果,灯盏乙素峰面积的RSD为1.19%(n=6),表明仪器精密度良好。
2.2.8 重复性试验 取灯盏花素胃黏附片适量,共6份,按“2.2.2”项下方法制备供试品溶液,再按“2.2.4”项下色谱条件进样分析,记录峰面积并按标准曲线法计算灯盏乙素的含量。结果,灯盏乙素含量的RSD为1.59%(n=6),表明方法重复性良好。
2.2.9 加样回收率试验 精密称取已知含量(灯盏乙素含量为287.42 mg/g)的灯盏花素胃黏附片粉末0.1 g,共6份,分别精密加入等量灯盏乙素对照品,按“2.2.2”项下方法制备供试品溶液,再按“2.2.4”项下色谱条件进样分析,记录峰面积并计算加样回收率。结果,平均加样回收率为97.10%(RSD=1.94%,n=6)。
2.2.10 稳定性试验 取“2.2.2”项下供试品溶液适量,分别在室温下放置0、2、4、6、12、24 h时按“2.2.4”项下色谱条件进样分析,记录峰面积并按标准曲线法计算灯盏乙素的含量。结果,灯盏乙素含量的RSD为1.23%(n=6),表明供试品溶液在室温下24 h内稳定性良好。
2.3 体外释放度试验
精密称取灯盏花素胃黏附片适量,采用2015年版《中国药典》(四部)通则“特征检查法”中的溶出度与释放度测定法——篮法[9],转速为100 r/min,温度为(37.0±0.5)℃,释放介质为pH 6.8磷酸盐缓冲液500 mL,分别于2、6、12 h取释放液5 mL,同时补加相应释放介质5 mL,释放液经0.45 μm微孔滤膜滤过,取续滤液3 mL,按“2.2.4”项下色谱条件进样测定,记录峰面积,按标准曲线法计算灯盏乙素的质量浓度,并按下式计算其累积释放度(Q):Q(%)=(cn×V0+[∑][i=0][i=n-1]ci×V1)/W×100%(式中cn为第n个点测得的药物质量浓度,V0为释放介质的体积,ci为第i个点测得的药物质量浓度,i=n-1,V1为每次取样体积,W为灯盏乙素的总含量)。
2.4 体外胃组织黏附力试验
根据实验室条件并查阅相关文献资料[10-11],采用自制黏附力测定装置进行体外胃组织黏附力试验。取禁食不禁水24 h的家兔1只,于耳缘静脉注射空气处死,取其胃组织,用水冲洗除取胃内容物,用0.1 mol/L盐酸溶液冲洗除去胃表面黏液质并浸泡,保存备用。将灯盏花素胃黏附片在0.1 mol/L盐酸溶液中浸泡5 min后,用滤纸吸去表面液体,放在有机玻璃板上(a板);将胃组织剪切成小块,全覆盖固定于背面带挂钩的1 cm×1 cm有机玻璃板上(b板)。将a板与b板接触,并给予质量100 g的压力,维持10 s,将a板垂直固定,在b板上系一塑料袋,通过输液瓶以5 mL/min速度向塑料袋中加水,直至因拉力过大而分离,称量塑料袋中水的质量,以水质量与b板面积的比值计算体外胃组织黏附力(单位:g/cm2)。
2.5 正交试验优化胃黏附片处方
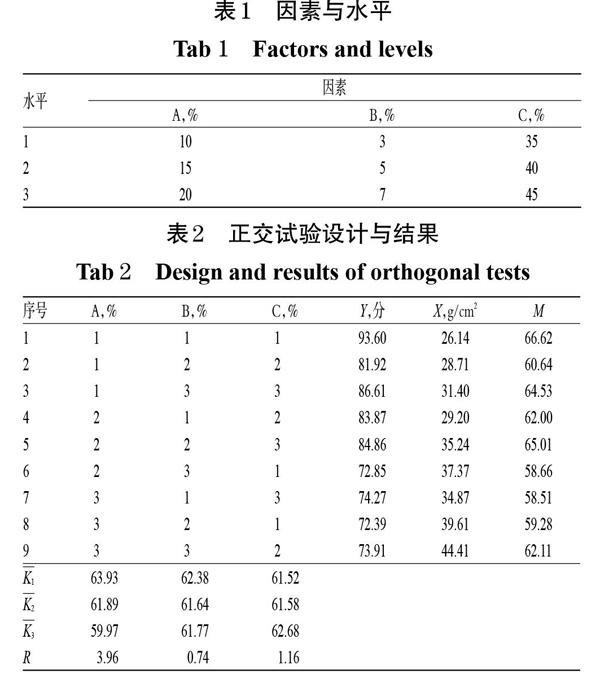
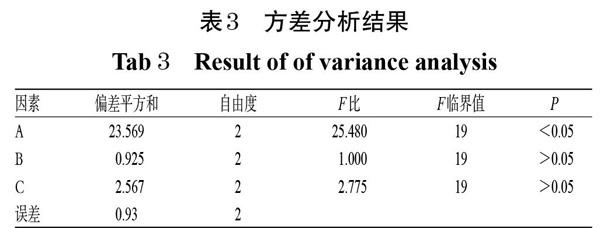
参考相关文献方法[12-13]并在预试验研究辅料对灯盏花素胃黏附片释放度和体外胃组织黏附力影响的基础上,以释放度评分(Y)和胃组织黏附力(X)的综合评分为指标,以处方中羟丙甲纤维素K100M(A,%)、卡波姆934P(B,%)及乳糖(C,%)的用量为考察因素,采用L9(34)正交试验设计进行处方优化。其中,Y=(Q1+Q2+Q3)/3,Q1为2 h累积释放度(Q2 h)的得分,释放20%计100分,每增加或减少1%减2分;Q2为Q6 h的得分,释放50%计100分,每增加或减少1%减2分;Q3为Q12 h的得分,释放80%计80分,每增加1%加2分,反之减2分[14]。综合评分(M)采用加权法计算,释放度评分、体外胃组织黏附力的权重系数分别为0.6、0.4,即M=0.6Y+0.4X。因素与水平见表1,正交试验设计与结果见表2,方差分析结果见表3。
由表2中的极差分析结果可知,各因素对灯盏花素胃黏附片综合评分影响程度的排序为A>C>B,最优处方为A1B1C3;由表3方差分析结果可知,因素A对灯盏花素胃黏附片的综合评分有显著影响(P<0.05)。综合考虑,确定最优处方为10%羥丙甲纤维素K100M、3%卡波姆934P、45%乳糖,与42%灯盏花素提取物混合。以上述最优处方比例,按“2.1”项下方法制备3批灯盏花素胃黏附片,测定其体外累积释放度和胃组织黏附力,并计算综合评分进行验证。结果,3批样品的平均Q2 h、Q6 h、Q12 h分别为20.36%、48.55%、87.00%,平均体外胃组织黏附力为31.36 g/cm2,平均综合评分为70.23(RSD=1.84%,n=3),表明该工艺稳定可行,详见表4。
2.6 质量评价
2.6.1 性状 灯盏花素胃黏附片为淡黄色片剂,味淡或微咸。
2.6.2 鉴别 取灯盏花素胃黏附片适量,参照2015年版《中国药典》(一部)中灯盏乙素的HPLC法[15]进行鉴别。结果,灯盏乙素对照品和供试品的出峰时间一致,符合药典规定,色谱图见图1A、1B。
2.6.3 重量差异 取灯盏花素胃黏附片适量,按2015年版《中国药典》(四部)通则“片剂”中的重量差异检查法[9]进行检查。结果,20片灯盏花素胃黏附片的平均片质量为50 mg,重量差异为±6%,符合药典的限度(57.3%)规定[19]。
2.6.4 脆碎度 取灯盏花素胃黏附片130片,按2015年版《中国药典》(四部)通则“特殊检查法”中的片剂脆碎度检查法[9]进行检查,以损失质量与原质量的百分比为脆碎度,减失重量不得超过1%。试验重复3次。结果,130片灯盏花素胃黏附片的原质量为6.276 g,平均损失质量为0.034 g,平均脆碎度为0.54%;片剂完整,无缺角,符合药典规定。
2.6.5 释放度 取灯盏花素胃黏附片6片,精密称定,按“2.3”项下方法测定灯盏乙素的累积释放度,结果见表5。灯盏花素胃黏附片的平均Q12 h为83.51%(RSD=2.14%,n=6),符合药典规定[9]。
2.6.6 含量测定 按“2.2”项下方法测定3批灯盏花素胃黏附片中灯盏乙素的含量,每批平行测定3次。结果,3批灯盏花素胃黏附片中灯盏乙素的含量分别为288.28、290.57、286.57 mg/g,平均含量为288.47 mg/g,(RSD=0.70%,n=3)。
3 讨论
本课题组前期预试验发现,粉末直接压片法和湿法制粒法制备的胃黏附片在体外释放度方面无显著差异,但考虑灯盏花素的热稳定性较差,所以最后采用粉末直接压片法进行制备。另外,目前2015年版《中国药典》及其余相关标准中还没有统一的黏附力测定方法,故本研究结合自身条件并参考有关文献[10-11],自制黏附力测定装置对所制胃黏附片的胃组织黏附力进行测定。
卡波姆934P和羟丙甲纤维素不仅都是缓释制剂的骨架材料,同时还具有生物黏附性[16]。选用这两种生物黏附材料制备灯盏花素胃黏附片,可使灯盏花素持续释放达12 h,且所得片剂具有良好的黏附性,可以在胃肠道滞留较长的时间,保证药物释放完全。两者的比例是释药的关键,当卡波姆934P用量过大时,所得片剂的黏附性增加,会导致药物难以释放;而当羟丙甲纤维素用量过大时,又会导致药物释放减慢且释放不稳定(这是因为随着羟丙甲纤维素用量增加,制剂形成凝胶的速度加快[17])。因此,控制好两者的比例关系,是实现黏附和缓释的关键所在。
本研究以灯盏花素为模型药物,制成了具有黏附及缓释性能的片剂;在优化灯盏花素胃黏附片处方的基础上,对该制剂的质量进行了初步评价。结果显示,本研究成功制得了灯盏花素胃黏附片,其质量评价符合2015年版《中国药典》要求,为灯盏花素的剂型改进和开发提供了新的思路。但是,该胃黏附片的药动学和药效学特征仍有待进一步研究。
参考文献
[ 1 ] 周莉.灯盏花素的心脑血管药理及临床研究进展[J].中医药信息,2013,30(6):134-136.
[ 2 ] 方睿,杜树山.灯盏花素制剂研究进展[J].中国实验方剂学杂志,2011,17(4):233-236.
[ 3 ] 陈丽芳.灯盏花素注射液治疗冠心病心绞痛的临床应用[J].中国循证心血管医学杂志,2016,8(4):500-502.
[ 4 ] 钟海军,邓英杰,徐春莲,等.灯盏花素的理化性质研究[J].中国药房,2013,24(7):608-610.
[ 5 ] 李谦,王立强.胃滞留给药系统的最新研究进展[J].中国新药杂志,2014,23(19):2255-2260.
[ 6 ] 杨海丽.心脑血管疾病临床用药的经验分析[J].医学信息旬刊,2011,24(6):2376-2377.
[ 7 ] 许英爱,范国荣,高申,等.灯盏花素大鼠在体肠吸收动力学研究[J].中草药,2007,38(7):1036-1039.
[ 8 ] 谭建玲,邢翔飞,陈进兵,等.外翻肠囊法研究灯盏花素小肠吸收的影响因素[J].中国药房,2015,26(13):1763- 1766.
[ 9 ] 国家药典委员会.中华人民共和国药典:四部[S]. 2015年版.北京:中国医药科技出版社,2015:3-4、120-124.
[10] 高朝霞,蒋学华,张川川,等.体外黏附力的测定及在生物黏附制剂处方筛选的试用[J].中国医药工业杂志,2006,37(9):606-609.
[11] 杜丽东,倪京满,孟庆刚,等.放线菌素D阴道生物黏附片的研制[J].中国新药杂志,2007,16(5):387-390.
[12] 赵壮,杜守颖,陆洋,等.卡波姆等6种生物黏附材料体内外黏附性能评价[J].中国药学杂志,2014,49(24):2188-2192.
[13] 符旭东,陈晨,李银科,等. HPLC法测定卡波姆类口腔黏附片中盐酸利多卡因的含量[J].中国药师,2015,18(4):695-697.
[14] 党云洁,王国杰,杜宇坤,等.斑蝥素胃黏附缓释片的制备与体内外评价[J].中国实验方剂学杂志,2016,22(21):1-5.
[15] 国家药典委员会.中华人民共和国药典:一部[S]. 2015年版.北京:中国医药科技出版社,2015:147-148.
[16] 张志荣,付劼,黄园,等.卡波姆与羟丙基甲基纤维素在体内外与大鼠胃肠黏膜黏附性的考察[J].药学学报,2001,36(7):543-546.
[17] 杜青,平其能,刘国杰.影响卡波姆-羟丙基甲基纤维素黏附片黏附性质的因素考察[J].中國医院药学杂志,2002,22(12):709-711.
(收稿日期:2020-03-24 修回日期:2020-06-04)
(编辑:邹丽娟)
