血栓调节蛋白联合凝血酶-抗凝血酶复合物判断脓毒症预后的临床价值
2020-09-02钟林翠宋景春邓星平胡艳晶何龙平林青伟曾庆波
钟林翠,宋景春,邓星平,胡艳晶,何龙平,林青伟,曾庆波
解放军联勤保障部队第908医院重症医学科,南昌 330002
脓毒症是指机体对感染反应失调而导致危及生命的器官功能障碍[1-2]。全球每年脓毒症患者超过1900万,其中600万死亡,病死率超过25%[3-4]。凝血功能紊乱是脓毒症患者最常见的临床表现之一,脓毒症合并凝血功能紊乱时病死率会明显升高[5-6]。脓毒症导致凝血功能紊乱的主要机制是内毒素或低灌注导致内皮细胞损害后出现组织因子大量释放、生理性抗凝机制受损和纤溶功能抑制。凝血酶-抗凝血酶复合物(thrombin-antithrombin complex,TAT)是反映凝血系统活化的敏感指标,纤溶酶-α2抗纤溶酶复合物(α2-plasmin inhibitor-plasmin complex,PIC)是反映纤溶系统活化的敏感指标,血栓调节蛋白(thrombomodulin,TM)和组织型纤溶酶原激活剂-纤溶酶原激活剂抑制剂-1复合物(tissue plasminogen activator-inhibitor complex,t-PAIC)能够反映血管内皮细胞的功能[7-10]。本研究旨在探讨TM联合TAT判断脓毒症患者预后的临床价值。
1 资料与方法
1.1 研究对象 选取2018年5月-2019年7月解放军联勤保障部队第908医院重症医学科收治的80例脓毒症患者,男49例,女31例,年龄(66.3±16.4)岁。纳入标准:①符合2016年Sepsis 3.0诊断标准[1]:对于疑似或确认感染,序贯器官衰竭评分(SOFA评分)≥2分可诊断为脓毒症;②年龄≥18岁。排除标准:①先天性凝血功能障碍;②慢性肝功能不全;③血液系统恶性肿瘤;④存在可引起血小板变化的其他疾病如血小板减少性紫癜、脾功能亢进;⑤服用引起凝血功能异常或致血小板减少的药物。根据脓毒症患者90 d预后情况分为生存组(n=51)与死亡组(n=29)。
1.2 方法
1.2.1 主要试剂及仪器 HISCL-800自动化学发光免疫分析仪及配套化学发光试剂(日本Sysmex公司);ACL-TOP700全自动血凝分析仪及配套试剂(美国Werfen公司);CFMS LEPU-8800血栓弹力图仪及配套试剂(北京乐普医疗科技有限公司)。
1.2.2 凝血分子标志物检测 患者入院2 h内采用枸橼酸抗凝管(枸橼酸与血液比例为1:9)采集外周血2 ml,室温下3000 r/min离心10 min。按HISCL-800说明书步骤操作,采用化学发光免疫分析法定量检测TM、TAT、t-PAIC、PIC发光强度,根据标准曲线计算TM、TAT、t-PAIC、PIC的浓度。
1.2.3 常规凝血项目检测 患者入院2 h内采用枸橼酸抗凝管(枸橼酸与血液比例为1:9)采集外周血2 ml,室温下3000 r/min离心10 min。采用TOP700全自动凝血分析仪测定凝血酶原时间(prothrombin time,PT)、活化部分凝血活酶时间(activated partial thromboplastin time,APTT)、凝血酶时间(thrombin time,TT)、纤维蛋白原(fibrinogen,FIB)、纤维蛋白原降解产物(plasma fibrin degradation products,FDP)及D-二聚体(D-dimer,DD)水平。其中PT、APTT、TT、FIB采用凝固法检测,FDP、DD采用免疫比浊法检测。
1.2.4 血栓弹力图(TEG)指标检测 患者入院2 h内采用枸橼酸抗凝管(枸橼酸与血液比例为1:9)采集外周血2 ml。按说明书步骤操作,所有血样均在40 min内完成TEG检测。测试结束后,记录TEG的凝血反应时间(R,正常值5~10 min)、血块形成速率(K,正常值1~3 min)、血块形成动力学(Angle,正常值55°~78°)、最大振幅(MA,正常值50~70 mm)及凝血综合指数(CI,正常值-3~3)。
1.3 统计学处理 采用SPSS 25.0软件进行统计分析。计量资料采用单样本S-W法进行正态分布检验,正态分布数据以表示,非正态分布数据以M(Q1,Q3)表示,满足正态分布且方差齐者组间比较采用t检验,不满足者组间比较采用非参数Mann-WhitneyU检验,计数资料组间比较采用χ2检验,并行ROC曲线分析。P<0.05为差异有统计学意义。
2 结 果
2.1 两组脓毒症患者一般资料比较 两组患者性别、感染部位差异均无统计学意义(P>0.05),年龄差异有统计学意义(P<0.05)。针对疾病严重程度,死亡组APACHE Ⅱ评分、SOFA评分、DIC评分、乳酸水平及DIC发生率显著高于生存组,差异均有统计学意义(P<0.05);两组休克发生率差异无统计学意义(P>0.05);针对炎症指标,两组WBC、CRP与PCT水平差异均无统计学意义(P>0.05,表1)。
2.2 两组脓毒症患者凝血功能比较 针对凝血指标,死亡组患者PT明显长于生存组,DD和FDP水平明显高于生存组,差异均有统计学意义(P<0.05);两组APTT、TT、FIB、PLT差异均无统计学意义(P>0.05)。针对TEG指标,两组R值、K值、Angle、MA值、CI值差异均无统计学意义(P>0.05,表2)。

表1 两组脓毒症患者一般资料比较Tab.1 Comparison of general informations between two groups of sepsis patients

表2 两组脓毒症患者凝血功能比较Tab.2 Comparison of coagulation function between two groups of sepsis patients
2.3 两组脓毒症患者凝血分子标志物比较 死亡组患者TM和TAT水平明显高于生存组,差异均有统计学意义(P<0.05);两组PIC、t-PAIC水平差异无统计学意义(P>0.05,表3)。

表3 两组脓毒症患者凝血分子标志物比较[M(Q1, Q3)]Tab.3 Comparison of coagulation molecular markers between two groups of sepsis patients [M(Q1, Q3)]
2.4 TM、TAT判断脓毒症预后的ROC曲线分析 将TM、TAT纳入ROC曲线分析,结果显示,TM、TAT判断脓毒症预后的AUC分别为0.74、0.67(P<0.05);当TM界值为16.95 TU/ml时,其敏感度、特异度、阳性预测值和阴性预测值分别为0.690、0.804、0.667、0.820;当TAT界值为10.55 ng/ml时,其敏感度、特异度、阳性预测值和阴性预测值分别为0.828、0.490、0.480、0.833(图1)。
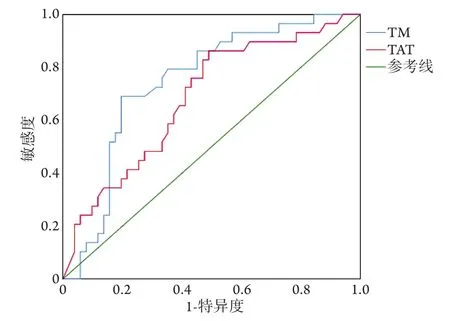
图1 TAT、TM判断脓毒症患者预后的ROC曲线分析(P<0.05)Fig.1 ROC curve of TM and TAT for diagnostic prognosis in sepsis patients (P<0.05)
将满足TM>16.95 TU/ml且TAT>10.55 ng/ml的患者纳入凝血紊乱组,否则纳入凝血正常组。凝血紊乱组患者APACHE Ⅱ、乳酸水平、DIC发生率及病死率明显高于凝血正常组(P<0.05);两组SOFA评分、休克发生率差异无统计学意义(P>0.05,表4)。
3 讨 论
本研究发现,死亡组患者APACHEⅡ评分、SOFA评分、乳酸水平、病死率均明显高于生存组,表明死亡患者入院时病情已非常危重。生存组患者入院时多数常规凝血指标(如PT、APTT、TT、FIB、PLT)和TEG指标(如R时间、K时间、Angle、MA值、CI)仍处于正常值范围内,仅DD和FDP水平高于正常值。与生存组比较,死亡组患者表现异常的凝血指标为DD和FDP,水平明显升高。DD和FDP的敏感度较高,但特异度不高,作为凝血异常的诊断指标价值有限,因此2019年国际血栓与止血学会科学标准委员会建议的脓毒症性凝血病诊断标准与2001年建议的弥散性血管内凝血诊断标准比较,主要在积分系统中去除了DD和FDP[11]。
TM是主要由内皮细胞表达的膜蛋白,可与凝血酶结合并辅助蛋白C发挥抗凝作用[12-13]。当血管内皮受损时,内皮细胞表面的TM被水解并脱落入血,在血液中含量会明显增加,因此TM可作为内皮细胞损伤的标志物[14]。凝血激活而产生的最终酶是凝血酶,部分凝血酶迅速与抗凝血酶结合,形成TAT。TAT的形成理论上处于纤维蛋白原活化之前,因而被认为是凝血系统激活的最早期指标[15-16]。本研究结果显示,死亡组患者在入院时TM与TAT水平即显著高于生存组,说明死亡患者的内皮细胞损伤和凝血系统激活程度较存活者更严重。有研究发现,TM和TAT对脓毒症凝血状态的评估效能优于PT、APTT、TT、FIB等传统凝血指标和TEG指标[17]。本研究ROC曲线分析结果显示,当TM界值为16.95 TU/ml时,判断脓毒症预后的特异度较高;当TAT界值为10.55 ng/ml时,判断脓毒症预后的敏感度较高。因此,本研究拟定TM>16.95 TU/ml且TAT>10.55 ng/ml时出现脓毒症相关凝血紊乱。
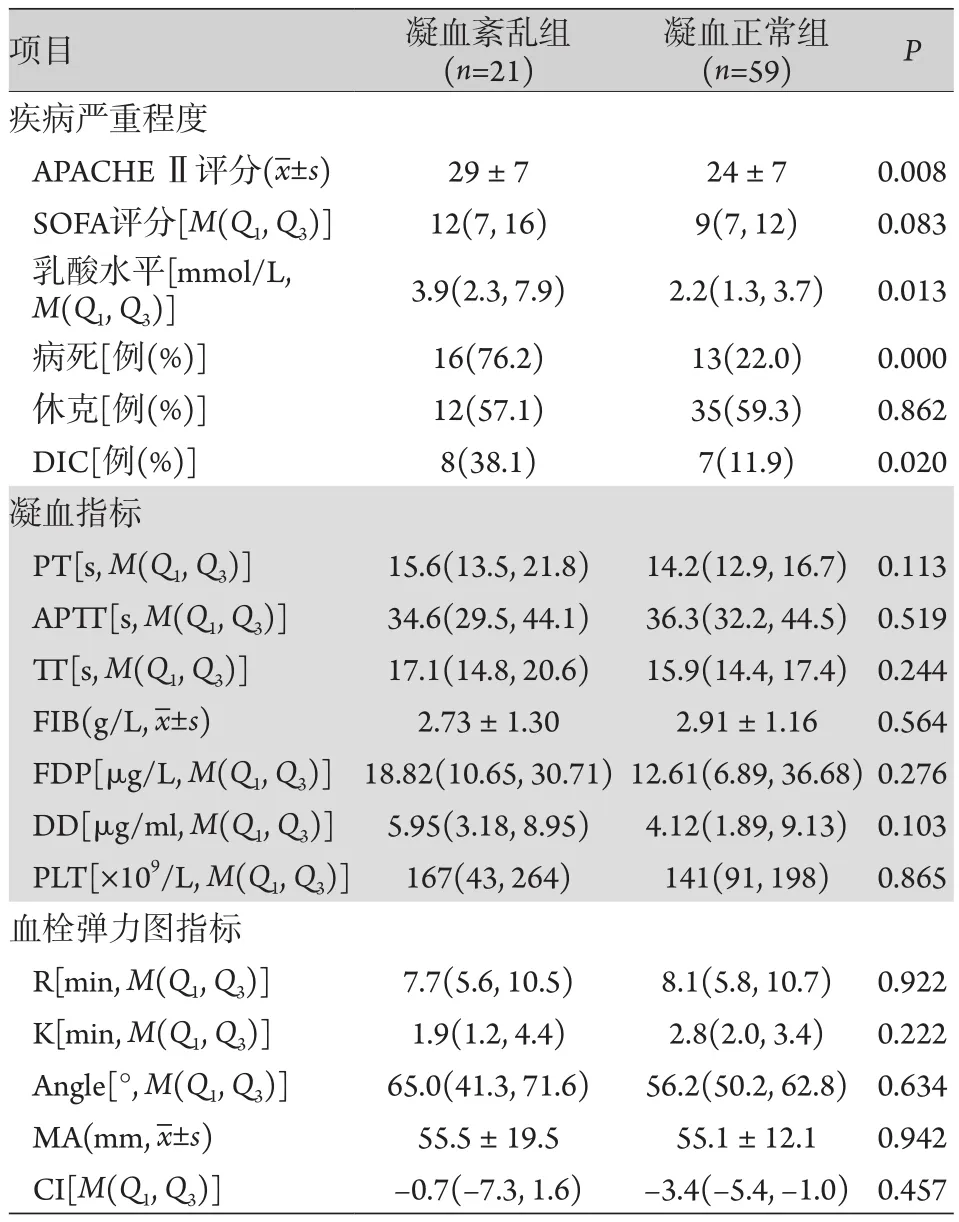
表4 凝血紊乱组与凝血正常组脓毒症患者一般资料比较Tab.4 Comparison of general data between the sepsis patients of coagulation disorder group and normal coagulation group
本研究发现,TM联合TAT诊断的脓毒症凝血紊乱组患者APACHEⅡ评分、乳酸水平、病死率及DIC发生率显著高于凝血正常组,两组常规凝血指标(如PT、APTT、TT、FIB、PLT、DD、FDP)和TEG指标(如R时间、K时间、Angle、MA值、CI)无统计学差异,表明与常规凝血指标和TEG指标相比,TM联合TAT能够有效判断脓毒症患者的早期凝血紊乱。这使临床上可以直接了解脓毒症患者内皮细胞的损伤程度,并及时发现由内皮损伤引发的凝血系统激活[18]。但本研究纳入样本量偏少,尚需扩大样本量验证TM联合TAT诊断的阈值以及按年龄分层的必要性,并以此为标准探讨血管内皮保护治疗策略的临床价值。
总之,TM联合TAT能够判断脓毒症患者预后和早期识别脓毒症相关凝血功能紊乱。
