新型冠状病毒肺炎患者心电图改变与心肌损伤的关系及其对预后的评估价值
2020-09-01李晴李相友祝芬曹蕾马笛
李晴, 李相友, 祝芬, 曹蕾, 马笛
武汉市第三医院 1心肺功能科, 2心血管内科(湖北武汉 430060)
新型冠状病毒肺炎(coronavirus disease 2019,COVID-19)以呼吸道症状为主要表现,部分患者肺部病变进展较快,出现严重急性呼吸综合征表现,常累及心脏、肠道和肾脏等多个系统[1],据报道约27.8%的患者出现心肌损害[2]。COVID-19患者合并心血管系统基础疾病比较多见,部分患者病情急剧恶化,死亡病例增加,可能与心肌损伤有关。在诊治COVID-19患者中发现,心肌损伤的患者除了心肌酶、肌钙蛋白I(TNI)等升高之外,心电图可呈现与常见心血管疾病导致的心电图异常不同的形态改变。本研究对确诊的289例COVID-19患者的临床资料进行回顾性分析,寻找心电图与COVID-19患者心肌损伤的关系,以及心电图在患者死亡风险预测中的价值,以提高对伴心肌损伤的COVID-19的认识,早期识别与干预,提高患者生存率。
1 资料与方法
1.1 一般资料 回顾性分析2020年1月19日至3月15日于武汉市第三医院确诊且入院后行超敏肌钙蛋白I(hs-TNI)、心电图检查的COVID-19患者的临床资料。该研究已通过武汉市第三医院伦理委员会批准(批号:武三医伦KY2020-035)。纳入标准:选择符合《新型冠状病毒肺炎诊疗方案(试行第七版)》[3]中关于COVID-19诊断标准的患者。排除标准:(1)合并急性心肌梗死、急性心脑血管意外;(2)合并慢性肾功能衰竭;(3)既往患有房颤(扑)、原发性心肌病、起搏器植入状态、束支阻滞/室内阻滞等患者;(4)合并肿瘤、慢性肝脏疾病等患者。根据hs-TNI结果将患者分为两组,hs-TNI正常值参考区间[4]采用健康人群第99百分位作为上限,即≤0.026 3 ng/mL,以hs-TNI>0.026 3 ng/mL的患者为观察组,hs-TNI≤0.026 3 ng/mL的患者为对照组。
1.2 方法
1.2.1 患者的一般临床资料 收集年龄、性别、症状、基础疾病(高血压、糖尿病、冠心病、高脂血症、脑梗死等)、入院体温(T)、收缩压(SBP)、舒张压(DBP)、心率(HR)、血氧饱和度(SpO2),危重症、转入ICU和死亡情况等。
1.2.2 实验室资料 乳酸脱氢酶(LDH)、肌酸激酶(CK)、肌酸激酶同工酶(CK-MB)、α-羟丁酸脱氢酶(HBDH),以及hs-TNI等。
1.2.3 心电图检查 患者入院后采集心电图,同时记录采集心电图时症状。采用MECG -300型号12导全自动心电图诊断仪,定准电压10 mm/mV,走纸速度25 mm/s,滤波频率40 Hz。正确连接12导联,待基线稳定后记录20 s内心电变化。分析心搏起源、节律、房室传导、室内传导、复极(ST段、T波)、肢体/胸导联电压等心电图数据。心电图诊断术语根据《心电图标准化与解析的建议与临床应用国际指南2009》确定。
1.2.3.1 ST段抬高标准 40岁以上(含40岁)男性,V2及V3导联J点抬高不应超过0.2 mV(2 mm),其他导联不应超过0.1 mV(1 mm);40岁以下男性,V2及V3 导联J点抬高不超过0.25 mV(2.5 mm);女性V2及V3 导联J点抬高不应超过0.15 mV(1.5 mm),其他导联不应超过0.1 mV(1 mm)。
1.2.3.2 ST段呈斜上及弓背向上型抬高[5]COVID-19患者心电图ST段呈斜上弓背向上型抬高的形态改变较多见,但目前意义未明。
1.2.3.3 ST段压低标准 所有人群,不论年龄大小,J点压低在V2及V3导联不应超过-0.05 mV(-0.5 mm),在其他导联不应超过-0.1 mV(-1 mm)。
1.2.3.4 T波改变标准 Ⅰ、Ⅱ、aVL、V2~V6导联T波振幅-0.1~-0.5 mV定义为T波倒置;-0.5~-1.0 mV为T波深倒置;负向T波振幅>1.0 mV为巨大倒置T波。T波振幅低于同导联R波振幅的1/10为T波低平;T波平坦是指Ⅰ、Ⅱ、aVL、V4~V6导联,T波振幅在0.1~-0.1 mV,其中Ⅰ、Ⅱ、aVL导联R波振幅>0.3 mV。
1.2.3.5 异常Q波标准 相邻两个相关导联的Q波时限≥0.03 s,振幅≥同导联R波的1/4,形态粗钝或有切迹(除外Ⅲ导联和aVR导联)。
1.2.3.6 肢体导联低电压标准 肢体导联R+S振幅<0.5 mV,或3个标准导联R+S振幅<1.5 mV;胸前导联低电压标准:胸前导联QRS综合波振幅<1.0 mV。

2 结果
2.1 两组患者的一般资料比较 两组患者的年龄差异有统计意义(P<0.05)。与对照组比较,观察组男性多见,差异有统计学意义(P<0.05);心血管系统疾病史中,观察组高血压、冠心病比例较高,差异有统计学意义(P<0.05);观察组收缩压较高、SpO2较低差异有统计学意义(P<0.05);观察组危重症比例、转入ICU比例,以及病死率较高,差异有统计学意义(P<0.05),见表1。
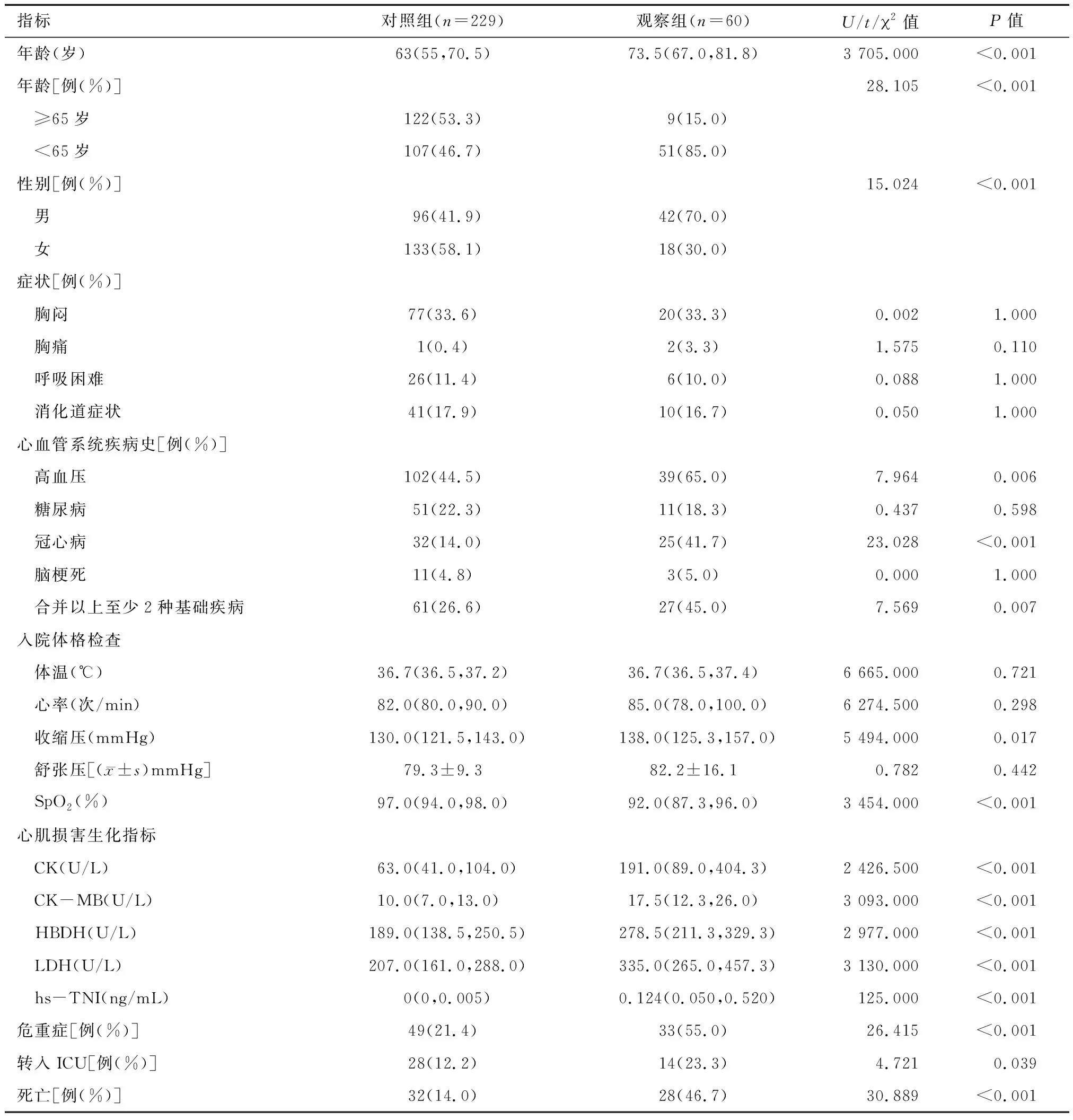
表1 两组患者临床资料比较 M(P25,P75)
2.2 心电图检查 与对照组比较,观察组心电图异常发生率高,差异有统计学意义(P<0.05);其中,观察组新发传导阻滞、过早搏动、ST段压低,以及左室导联T波低平发生率高,差异有统计学意义(P<0.05)。两组心电图出现Ⅱ型Wellens波患者(图1)和ST段呈斜上及弓背向上型抬高(图2)较多见,但差异无统计学意义(P>0.05)。见表2。
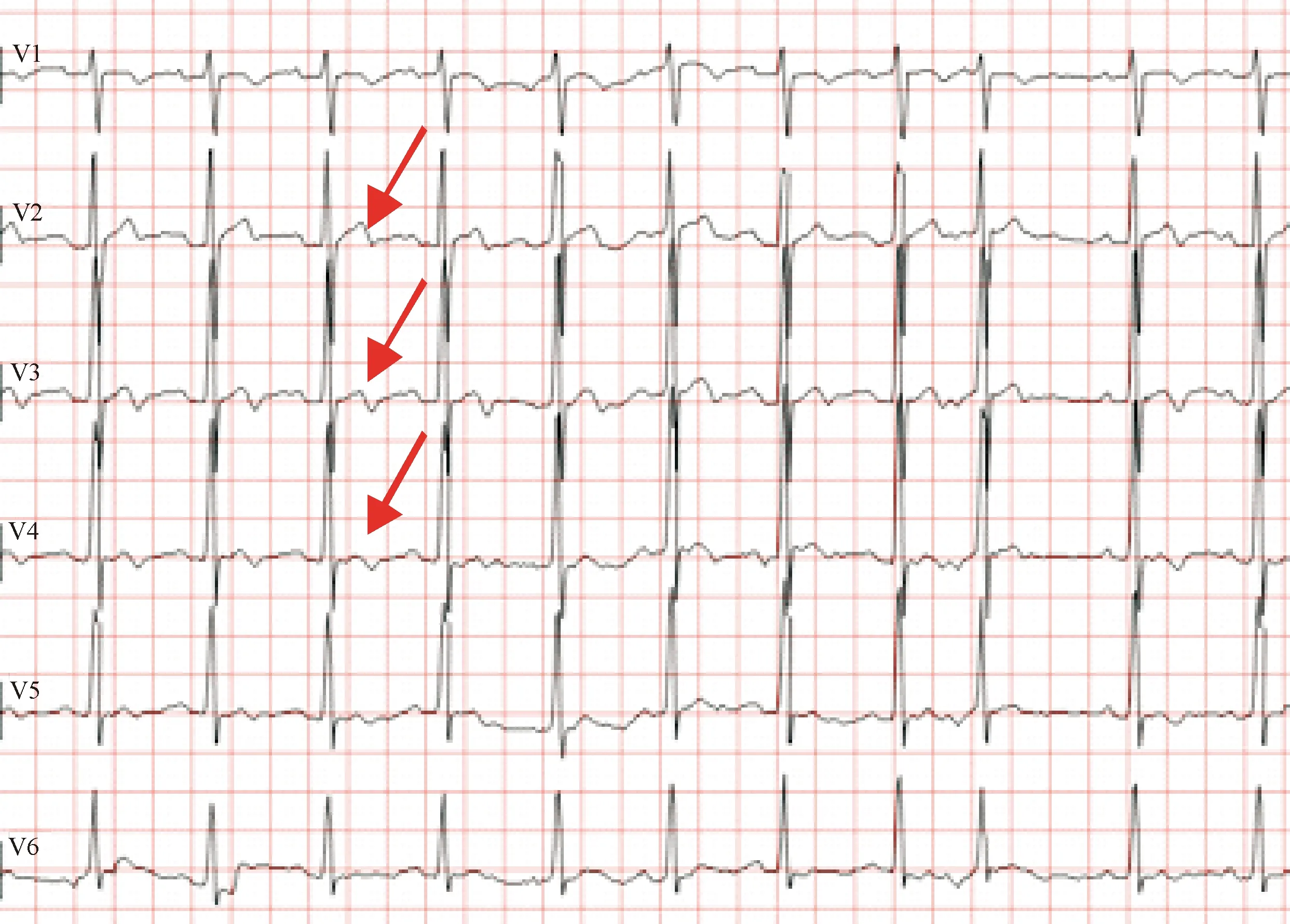
注:心电图V2~V4导联T波正负双向,呈Ⅱ型Wellens波表现(箭头所指)

图2 COVID-19患者心电图ST段斜上及弓背向上型抬高表现(箭头)
两组患者死亡60例,死亡患者心电图异常发生率高,与非死亡患者心电图改变比较,差异有统计学意义(P<0.05);其中,ST段呈斜上及弓背向上型抬高和左室导联T波低平发生率高,差异有统计学意义(P<0.05),见表3。
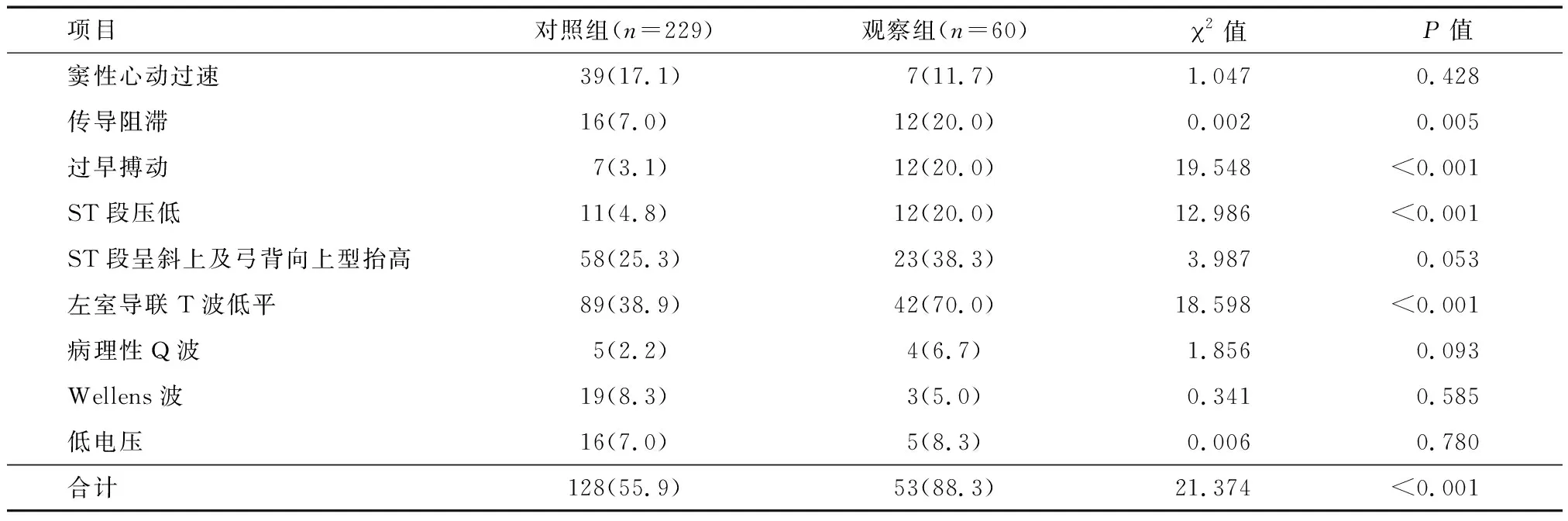
表2 两组患者的心电图改变比较 例(%)
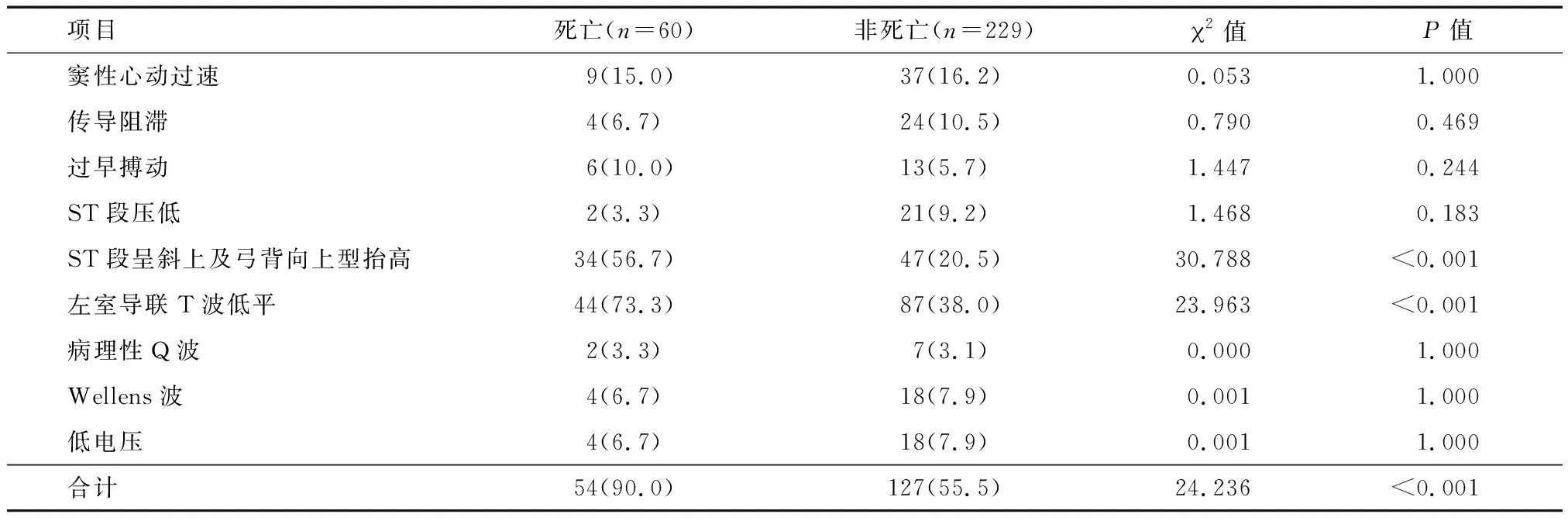
表3 COVID-19死亡患者心电图改变情况分析 例(%)
2.3 logistic回归分析心电图改变对COVID-19患者死亡风险预测 以COVID-19患者死亡为因变量,将上述单因素分析中有统计学意义的指标进行非条件logistic回归分析,变量筛选方法:向前步进(似然比)法。在校正性别、年龄、高血压史、冠心病史、SpO2混杂因素后,结果显示心电图异常、ST段呈斜上及弓背向上型抬高,以及左室导联T波低平改变均是COVID-19患者死亡的危险因素,见表4。
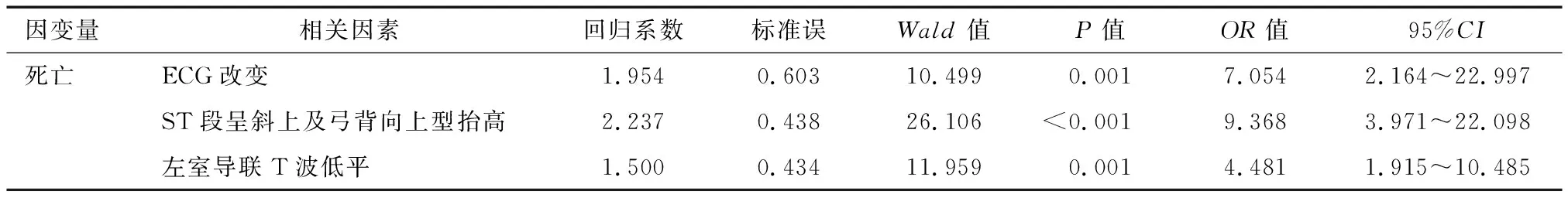
表4 多因素logstic回归分析心电图在COVID-19患者临床预后评估中的价值
3 讨论
自COVID-19发生以来,COVID-19与心肌损害的关系被国内外学者关注和研究,Guo等[2]对187例COVID-19患者的分析发现,有27.8%的患者存在肌钙蛋白升高。另有文献报道[6-7]危重症患者中合并心肌损伤者达44.4%~62.5%,提示伴心肌损伤可能是COVID-19发展成危重症的主要原因。COVID-19的全因死亡率约2.3%[8],一旦合并心肌损伤,病死率迅速升至59.6%[2]。COVID-19患者发生心肌损伤比例高、伴心肌损伤患者重症率高,病死率高,因此需要早期诊断,早期决策。心电图是反映心脏电生理结构和功能的重要检查,也是反映犯罪血管定位的有效工具,可以反映心肌损伤或冠脉动脉病变。本研究通过对比伴心肌损伤与不伴心肌损伤的COVID-19患者入院的基线资料和心电图资料,以及临床预后等,分析心电图改变对COVID-19患者的心肌损伤的早期诊断和预后判断价值。
本研究显示,COVID-19患者合并心血管系统基础疾病比较多,约44.5%的患者合并一种心血管系统疾病,约30.4%的患者合并两种以上心血管系统基础疾病,与既往研究[2,9]基本一致,新型冠状病毒感染器官组织与ACE2受体有关[10],心血管疾病患者可能存在更多ACE2受体[9]。与对照组比较,观察组更多发生于老年男性患者(P<0.05),与Guo等[2]报道一致;在心血管系统基础疾病方面,观察组中合并有糖尿病的比例差异无统计学意义(P>0.05),但是有研究[2,11]提示伴心肌损伤的患者合并糖尿病的比例较高,研究不一致的原因可能与纳入标准不同,或者不同医院住院患者构成不同有关。但本研究中观察组合并高血压和冠心病的比例较高,差异有统计学意义(P<0.05),与既往报道[2,11]一致。冠心病患者在感染新型冠状病毒后更易发生心肌损伤的机制,考虑与冠状动脉在缺氧和炎症反应作用下斑块不稳定,更容易出现缺血性心肌损伤有关。另外,缺氧和心理应激也会使交感神经兴奋加重冠状动脉痉挛,使心肌缺血心肌细胞损伤加重。既往研究[2,4,11]均显示COVID-19患者,尤其是伴心肌损伤的患者D-二聚体升高,提示凝血功能异常,微血栓形成,这些因素可加重冠状动脉缺血,引起心肌损伤。与对照组比较,观察组患者重症比例、转入ICU比例,以及病死率均升高,差异均有统计学意义(P<0.05),与既往研究[12]一致,提示伴心肌损伤的患者在面对新型冠状病毒感染时可能面临更大的死亡风险。本研究显示, COVID-19患者心电图异常发生率为62.6%,比武汉亚洲心脏病医院[13]报道的74.2%略低,考虑与其纳入标准和排除标准不同有关,我院纳入患者中排除了既往有房颤、传导阻滞、起搏器植入史等的患者。常见心电图异常为左室导联T波低平、ST段呈斜上及弓背向上型抬高、窦性心动过速、新发传导阻滞、Ⅱ型Wellens波和低电压,同一患者的心电图可存在多种改变,不同患者的心电图改变具有多样性和易变性。与对照组比较,观察组新发传导阻滞、过早搏动、ST段压低,以及左室导联T波低平改变发生率均较高,差异有统计学意义(P<0.05),T波低平改变涉及导联广泛,主要分布在左心室相关导联。ST段呈斜上及弓背向上型抬高的心电图改变比较常见,尽管与观察组比较差异无统计学意义(P>0.05),但与非死亡患者心电图比较,这种类型的心电图改变在死亡患者中发生率高,且差异有统计学意义(P<0.05)。在校正年龄、性别、SpO2以及高血压、冠心病心血管系统病史混杂因素后,心电图异常、ST段呈斜上及弓背向上型抬高以及左室导联T波低平改变均是COVID-19患者临床预后的危险因素,提示存在这些改变就应该关注心脏损害,及早干预,提高患者生存率。ST段呈斜上及弓背向上型抬高对于患者死亡风险的OR=9.368(95%CI:3.971~22.098),提示心电图ST段呈斜上及弓背向上型抬高可能是COVID-19患者心肌损伤以及死亡的重要表现。心电图是反映心脏几何结构和电生理结构改变的工具,理论上可以比心肌损伤血清学改变出现时间更提前,因此心电图改变可能比TNI更能早期预测死亡风险,因此需要重视心电图在COVID-19患者中的应用价值。
心电图出现改变的原因分析主要与以下因素有关:(1)血管炎引起的心肌和冠脉损伤,《新型冠状病毒肺炎诊疗方案(试行第七版)》[3]中关于心脏和血管组织病理学改变可见部分血管内皮脱落、内膜炎症及血栓形成。冠状动脉病变的原因可能与血管炎有关,陈韵岱等[14]心血管病理研究者认为,COVID-19心肌损伤与冠状动脉血管炎有关,其认为新型冠状病毒感染可能诱发或者直接感染冠状动脉,导致内皮细胞功能下降甚至内皮细胞死亡脱落,同时伴随着内皮及内皮下的炎症细胞浸润,以及机体较高的血栓风险。上述改变一方面可以通过影响心肌的血液供应、诱导心肌炎症反应以及增加冠脉血流负荷,导致患者出现急性心肌损伤;另一方面可导致冠状动脉狭窄,在心电图上出现冠状动脉狭窄表现,本研究中有8例既往无心血管系统病史的患者心电图出现Ⅱ型Wellens波,这种改变提示左前降支近端狭窄,COVID-19患者心电图出现Ⅱ型Wellens波目前意义未明,需要进一步研究。(2)低氧血症诱导的心肌损伤:COVID-19主要表现为肺部损伤,无论普通型还是危重型均有不同程度的呼吸困难,刘茜等[15]的COVID-19患者的尸检报告发现患者肺部损伤明显,肺淤血较重,炎性病变较重,支气管管腔内可见胶冻状黏液、肺泡内可见大量黏性分泌物,这些病变可影响患者的肺通气和换气功能,引起低氧血症,心脏是高耗氧器官,缺氧可加重心肌损伤,心电图可表现为广泛导联T波低平改变。(3)全身炎症反应引起的非缺血性急性心肌损伤:国内外研究已证实COVID-19患者体内有多种炎症因子升高,心脏受炎症因子刺激,以及焦虑情绪等综合因素下出现非缺血性急性心肌损伤,心电图出现与常见心血管系统疾病导致的不同的形态改变,广泛导联ST段斜上及弓背向上型抬高,考虑与心肌细胞受炎症因子刺激产生损伤电流有关。(4)病毒性心肌炎,既往文献[16]报道在多伦多的SARS患者尸检中,35%的患者显示心肌中存在SARS冠状病毒RNA。我国学者赖日权等[17]在对SARS患者尸检中显示,心肌纤维颗粒变性、空泡变性,灶性液化性肌溶解等改变符合病毒性心肌炎改变。新型冠状病毒与SARS冠状病毒有同源性,新型冠状病毒感染也可能会引起病毒性心肌炎。病毒直接侵犯心肌、心肌内小血管和传导系统,可引起心脏起搏、心肌细胞除极和复极,以及传导系统功能异常。但刘茜等[15]报道的COVID-19患者尸检报告未观察到新型冠状病毒对心肌或冠脉系统或者传导系统直接侵害的证据,推测可能与解剖病例少,或者死亡患者处于不同病程阶段,以及对心肌内病毒的检测手段限制导致结果偏倚有关。
综上所述,伴心肌损伤的COVID-19患者重症比例高,病死率高,早期诊断和干预尤为重要。除病史、心肌酶、TNI等检查外,心电图可以反映心肌损伤,并且对早期诊断、预后预测,以及制定个体化治疗均具有重要意义。本研究存在一定局限性,因本研究为单中心回顾性研究,多数患者入院后未做心电图检查,纳入病例数量有限;另外,大部分患者入院后仅做1次心电图检查,未能观察动态演变及规律,因此需要扩大样本量进一步研究,为临床工作提供更多帮助。
