从肌肉的组织结构和生成机制探讨“人造肉”开发的仿生技术
2020-09-01刘业学王稳航
刘业学 王稳航
(1 天津科技大学食品科学与工程学院 天津300457 2 工业发酵微生物教育部重点实验室 天津科技大学生物工程学院 天津300457)
肉是一种兼具美味与口感并且营养丰富的动物源性食品。当今社会,肉不仅是人们健康饮食的重要组成部分,也是一类重要的工业产品,与人们的生活息息相关。 “肉”一般指猪、牛、羊等牲畜及禽类(有时也包括野味,而水产类一般排除在外)宰杀后肉尸的去骨部分以及可食的内脏、 皮和脂肪组织等,狭义上以骨骼肌为主。肉类是人类蛋白质的重要来源,富含多种微量元素和维生素,具有平衡膳食、增强体能的作用。 然而,一些研究表明肉类的不当加工和过量食用会对人体健康产生潜在的不良影响。
同大多数生物材料一样,肉是一种多组成、多层次、各向异性的结构体,其中所含的肌肉组织、结缔组织和脂肪组织均起源于中胚层, 经过一个复杂的生长与发育过程逐渐形成。动物屠宰后,肉需经过宰后成熟、物理加工和热处理3 个阶段,才能成为被人们直接消费的肉制品。 在这个过程中原有肌肉的组织结构会发生很大变化, 从而形成结构迥异的不同肉类产品。
由于存在全球人口数量增加, 对粮食需求压力增大,生产肉类对环境的不利影响,过度加工肉制品的潜在健康危害以及人们对新型食品的追求等诸多原因, 使得利用其它蛋白资源和相关技术模拟肉的色泽、风味和口感以开发仿肉产品,具有重要的社会意义。 生物体内肌肉的生成是一个自组织(Self organization)过程,是建立在从分子水平到细胞器、细胞、器官和有机体的复杂层次结构的基础上, 由多个具有交互规则的系统在空间和时间上组织的过程。 虽然人们对此过程以及相关机理仍不清楚, 但是通过利用已知的食品大分子的热力学性质,包括无序分离、自组装(Self assembly)等,以及外力辅助成型技术如螺杆挤出、纺丝等, 可以开发具有不同组织结构的人造肉产品,如植物蛋白肉。 另外,直接利用生物合成系统可以生产高质量的人造肉产品,其中菌蛋白(Myoprotein)已经商业化;利用动物细胞真正合成肌肉组织已在实验室取得成功。 这些研发成果丰富了人造肉的多样性, 对推动人造肉产业发展起到重要作用。
如何开发质地逼真、营养丰富、安全卫生的人造肉产品, 在人们对健康食品具有迫切诉求的当今社会既是机遇又是挑战。 本文从肌肉的结构组成和发生机制出发, 针对肉制品的质地和感官品质的贡献性,引入仿生学概念,评价目前已应用或具有潜在应用前景的人造肉生产策略与技术,并对未来的人造肉仿生技术进行展望, 为开发质地纹理与组织结构更为逼真的高质量人造肉, 拓展健康仿生食品的研究与开发提供参考。
1 肉的结构和生成
1.1 肉的形态结构
骨骼肌是动物机体最大的组织, 具有收缩功能,是肉的重要来源,占产肉动物胴体体重的35%~65%。 骨骼肌由大约90%的肌纤维以及10%的结缔组织和脂肪组织组成(图1),其包括水分75%,蛋白质19%,脂肪2.5%,碳水化合物1.2%,含氮浸出物1.65%,无机物0.65%[1]。 作为一种复杂的生物组织, 肌肉由存在于复杂结缔组织网络中高度收缩的肌原纤维结合形成, 其与结缔组织相互交叉融合形成应力和粘连, 直接或间接地与骨骼相连。肌肉是一类典型的复杂黏弹性体,既具有固体的弹性性质,又呈现液体的黏性性质。
每块肌肉的构造基本相同,由外到内依次为:肌肉→肌束→肌纤维(肌细胞)→肌原纤维→肌节(肌动蛋白和肌球蛋白)。如图2 所示,整块肌肉的外表面由一层结缔组织——肌外膜包裹。在内部,每块肌肉被另一层结缔组织即肌束膜(或称肌间膜)分隔成肌束,肌束直径可达1~5 mm,在横切肌肉时肉眼可见(图1)。 每个肌束由许多单独的肌纤维组成, 肌束间被第3 层结缔组织——肌内膜隔开。单个肌纤维是多核细胞,通常直径为20~80 μm,结构复杂,是肌肉的最基本单位(图2)。

图1 肉的外观形态与结构组成Fig.1 The meat appearance and structure
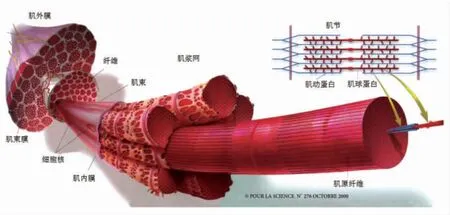
图2 肌肉的组织结构示意图[1]Fig.2 Schematic diagram of muscle tissue structure[1]
1.2 肉的生成机制
肌肉发育和生长可以分为3 个阶段:1)肌肉及相关组织的胚胎细胞的形成;2)肌肉胚胎细胞的发育;3)分化后肌细胞的生长。 一般来说,分化阶段1)和2)决定每块肌肉的肌细胞数量,而分化后阶段3)则主要负责肌肉的生长,即通过实现分化后肌纤维的体积增大,也就是肥大(Hypertropy)实现的。某些情况下,肌肉纤维数量也可以在肌细胞分化后增加或减少(肌细胞被破坏)。 脊椎动物的肌肉组织、 结缔组织和脂肪组织的形成与发育均起源于中胚层, 分别由中胚层祖细胞和充质干细胞分化成肌细胞、成纤维细胞和脂肪细胞。肌生成是指胚胎发育过程中肌纤维的形成, 而脂肪生成和纤维生成分别是指脂肪细胞和成纤维细胞的形成。
肌纤维、 结缔组织和脂肪细胞的数量不仅受物种、性别、品种、基因和表观遗传等因素影响[2],也受到营养水平、肌肉活动(锻炼)、应激激素(皮质类固醇,如皮质醇和肾上腺素)和生长促进因子等因素的影响, 这共同决定了肌肉的形态多样性和结构复杂性。 尽管人们对肌肉的基本结构和相关组成已有了解, 还在不断地探索肌肉组织的复杂性和可塑性, 以及相关的信号因子和调节机制[3]。
2 “人造肉”的开发与仿生技术
2.1 生物构建与仿生技术
肉类过度消费造成的环境污染、 动物福利缺失以及潜在的营养健康问题, 引起人们越来越多的关注与担心。 而肉作为一种集口感、美味、营养于一体的重要食物, 深深地根植于人们的饮食体系之中,对于人类的饮食具有重要意义。人们开始利用其它蛋白资源与技术模仿肉的结构、形态、质地、风味,开发人造肉,以满足消费者的需要。 其中,如何实现对肉的形态结构与质地组织的模仿,一直以来都是一个重要的问题。
人类作为自然界食物链的最顶端, 其食物全部来源于其它生物,包括动物、植物和微生物及其代谢产物。 任何一种天然食物包括肉食都是由分子的一级、二级及高级结构,通过层层组装,从纳米、微米尺寸,最终到宏观可见的具有各向异性的结构体。这些结构复杂、层次分明的生物材料不仅决定了它们独特的属性和功能, 而且直接决定其食用品质。这归因于大自然的馈赠,其在温和条件(涉及温度、pH 以及离子强度等)和常压条件下的水相环境中创造了一套通用的多组分、 多层次材料设计规则,包括分子组装、纳米控制、各向异性和高度有序的2D 和3D 结构,形成了组分-结构-功能的有序统一[4]。
细胞结构及组织构建不仅是生物体的基本构建模块,也是整个复杂系统的集合,这激发了许多领域包括食品科学领域在内的仿生学的发展[5]。仿生大体可分为3 个层次:1)Bionics,指通过模仿生物系统的功能和行为,达到建造技术系统,它打破了生物和机器的界限, 将各种不同的系统沟通起来;2)Biomimetics,为模仿并严格复制的存在于自然的东西;3)Bioinspiration, 指仿生产品或过程只能部分模仿或启发, 使得仿生领域范围更大、更广。在食品加工领域中,大部分仿生仅限于第3 层次。
随着纳米技术的发展和对生物材料的层次组装的不断阐析, 人们开始加强对仿生材料制备过程中不同尺寸和维度的调整与控制, 形成以纳米为中心的从分子-纳米-微米-宏观的自下而上(bottom-up)途径的仿生材料设计策略,如图3 所示[6]。而这种策略可以通过食品大分子组装或直接利用生物反应器完成, 同时也适用于人造肉的开发。
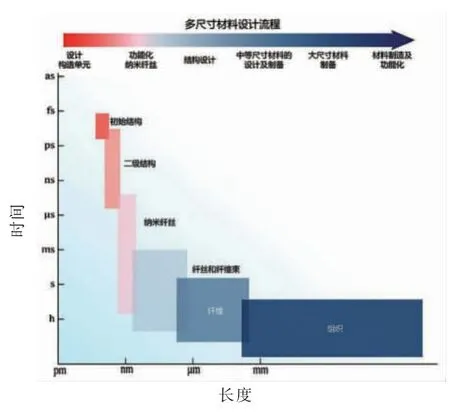
图3 多尺度仿生材料的构建策略[6]Fig.3 Construction strategy of multi-scale bionic materials[6]
2.2 肉制品的多样性与可模仿性
从原料肉到肉制品要经过宰后成熟、 物理加工和热处理3 个阶段。 首先,畜禽在宰杀后,肌肉组织在蛋白酶的作用下发生部分水解, 使得肉质变软,成熟。 同时,热处理会对肉的组织结构产生影响[7]:热处理开始时肌纤维蛋白变性,导致肉收缩、失水和增韧,接着胶原蛋白变性,发生凝胶化和溶解,肉原有结构不断被破坏,肉质变得越来越嫩,更容易咀嚼。此外,在加工过程中,原料肉经腌渍、滚揉、切碎、斩拌等工艺,肌纤维蛋白不断溶出,组织形态发生更大变化,甚至有些肌纤维完全消失,从而形成组织结构迥异的肉类产品。根据组织形态与内部结构的不同, 目前市场上的肉制品可基本可分为重组类和原肉类2 大类, 其组织结构及可模仿性见表1。

表1 不同肉制品的结构属性与可模仿性比较Table 1 Comparison of structural properties and imitability of different meat products
3 人造肉的纤维成型技术
由于肌肉成分的多样性、 结构的多层次尤其是复杂的各向异性, 以及表现出特有的黏弹性等材料属性, 因此实现真正意义上与肌肉结构一致的人造肉依靠目前的科技发展水平, 短期内甚至很长一段时间内难以实现。 由于肉的结构组成在加工过程中的变化以及人们对不同肉制品的特有质构和口感的需求差异, 相对降低了人造肉开发的技术难度。 蛋白质的各向异性纤维成型技术是人造肉的关键, 这对于仿原肉类和粗凝胶类产品(表1)尤为重要。 最近,Dekkers 等[8]综述了人造肉的结构化过程,并按自上而下(top-down)和自下而上(bottom-up)2 条途径,详细列出已应用或有潜在应用的纤维成型技术, 并阐述其尺寸的控制问题。 江南大学陈坚院士团队对人造肉的商业化技术和细胞培养肉也进行了相应的归纳总结[9-10]。
根据表1 所述不同肉制品的组织形态和感官特性, 结合实际蛋白组织化的技术原理与具体机制,将人造肉仿生技术分为以下3 类:蛋白质的自组装技术、 外力辅助成型技术和细胞培养(自组织)技术。
3.1 自组装技术
生物体内肌肉的组装涵盖了从分子-纳米-微米-宏观的所有尺寸,最终形成高黏弹性的固态结构体。而在实际食品加工体系中,由于蛋白质的低溶解度,所使用的浓度通常比较低,即使能够成形成高浓度的分散体系, 也无法形成具有组织状的各向异性结构体, 所以最为简便的方法是通过相分离将蛋白从溶液中凝聚出来并组装成不同形态尺寸,甚至是纳米尺寸的蛋白纤丝,或者通过添加外源的不同尺寸的纤维状物质使其蛋白体系具有丰富的纤维纹理和质地,以实现仿肉制品的生产。食品蛋白质无论是单一体系还是复合体系, 大多数为热力学不稳定体系,易受到各种因素影响,如温度、pH、压力、离子强度和浓度,极易出现相分离现象,而导致蛋白质以多种形态出现(图4)。 其中, 球状蛋白如大豆蛋白等是用于仿肉制品开发的主要蛋白质,其在天然状态下水溶性较好,通常先通过热处理使球状蛋白变性, 内部疏水基团暴露而使蛋白分子间易于聚合,降低其溶解度,再结合其它外界条件,促进其相分离,形成最终的结构和纹理。
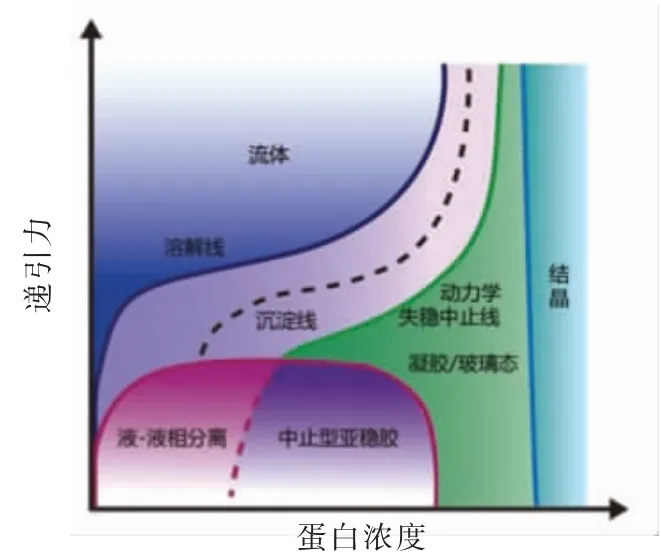
图4 球蛋白的不同状态图[11]Fig.4 Illustration of a state diagram for a globular protein[11]
3.1.1 无序凝聚 在单一蛋白体系中, 可以通过调节pH 和增加离子强度使蛋白质生成肉眼可见的沉淀,从而使产物组织化,如加热后的豆浆加入钙或镁离子生成沉淀,通过挤压形成豆腐。 另外,食品复合体也经常出现相离现象, 如通过蛋白质与多糖的相互作用等形成食品生物聚合物。 尤其是蛋白质和多糖,易发生自组装,形成复杂的多组分多相结构,被用于结构组织化。 例如,将蛋白质与海藻酸钠混合液中加入多价阳离子, 可生成纤维状聚合体, 通过清洗可生成生干物质含量为40%~60%的产品[12]。 这些反应往往由于反应速度过快导致蛋白质分子来不及折叠成有序结构,这些组织化往往在微观结构上呈无序的无定形态,难以实现仿肌肉纤维的效果。
另外, 冷冻过程中冰晶的生长会产生富溶质相和寡溶质相(冰晶),使得蛋白质产生各向异性的结构, 再通过冷冻干燥或通过蛋白质预先生成不可溶凝胶,也可利用常温或加热溶解冰晶,使水分流出, 以获得具有片状平行方向的多孔微观结构。通过控制冰点的温度和速度调整冰晶的大小,很明显的是,其结构组织化是在较大尺寸(以肉眼可见的结构为主)上进行的[13]。
3.1.2 分子自组装 实际上, 以纳米为基础的小尺寸蛋白质分子的自组装已开始引起食品研究人员的兴趣。 更多的研究表明通过对蛋白质的相分离实现精确控制,可制备纳米尺寸的微球、球状物和纤维, 而其中淀粉样蛋白纤丝 (Amyloid like protein fibril)最为引人关注。据报道,迄今已有23种食物蛋白可在一定条件下组装成淀粉样蛋白纤丝, 其通常的制备方法是将蛋白在远低于其变性的条件下加热数小时(通常为80~90°C,pH 2,不加盐,300 r/min,5~24 h)[14]。 在这个过程中,球蛋白分子可在温度或pH 等外界条件改变的情况下,通过将其内部结构转变为伸展状态, 从而暴露出易于聚集的区域(疏水基团),触发蛋白质聚集,形成蛋白纤丝, 导致蛋白质进入热力学稳定的最有利状态(淀粉样蛋白纤丝的能量最低)。 所组装的蛋白纤丝的结构受pH、离子强度、温度和蛋白浓度等热力学不稳定因素的显著影响, 同时也会受到动力学因素如时间等的制约。值得注意的是,受包括反应时间等因素在内的大多数不精确控制条件的影响,蛋白质往往形成其它的形态,如前面提到的无序凝聚形态。另外,一些蛋白质水解也会产生蛋白纤丝[15]。 一些研究表明,食品蛋白纤丝确实改善了蛋白质原有的加工性能[16],比如,乳清来源的蛋白纤丝膜,与乳清蛋白膜相比,其机械强度有了明显提高[17]。 然而,需要更多的研究来确定蛋白纤丝在复杂的食品系统中的确切作用, 以及它们自身是否能够抵抗食品加工过程中的外力冲击[16]。目前没有研究表明这些由蛋白质分子自组装而成的蛋白纤丝可以进一步生长成更高尺度的纤维,如毫米以上达到肉眼可见的规格, 这也可能会制约其在食品中,尤其是人造肉中的应用。
3.1.3 纤维塑形 不同尺寸的纤维添加于高浓度的聚合物体系对所形成的复合材料性能起到显著的提升作用, 包括提高聚合物的非平衡玻璃态或凝胶特性,以及最终产品的黏弹性和机械强度[18]。肉制品是一种高黏弹性的结构体, 利用天然生物来源纤维与非肉蛋白混合制备形成仿肉制品是一种简单、有效的人造肉生产技术。 大量的植物、藻类、食用菌以及动物(如外骨骼中的甲壳素)中富含多糖类纤维, 通常在农副食品加工过程中被废弃,而这些废弃物可通过机械粉碎、高压均质等工艺制备成不同尺寸(纳米、微米、肉眼可见)的高长径比的食品级纤维。 这些纤维通常具有较强的机械强度,可以满足仿肉制品的黏弹性要求。 另外,由于其长径比高, 所以能够形成仿肉制品的纤维状纹路与质地。目前适宜的纤维主要有蘑菇纤维、甲壳素纤维以及纤维素纤维。其中,食用菌与肉相似的口感和悠久的食用历史,以及简单、低能耗的制备工艺, 使蘑菇纤维用于人造肉的工业化生产可行性更强[19]。 另外,研究表明纳米纤维素能够增强蛋白凝胶的强度;并且,由于其具有脂肪类似物的特性[20-21],可用于提高最终产品的保水性,预计随着其食用安全性的确定以及作为食品配料的市场准入,在人造肉市场会有很好的应用。而这些纤维由于其具有较高的弹性模量, 通常会增强产品的硬度,可能无法提供蛋白纤维特有的口感,需要与其它非肉蛋白凝胶配合使用。
纳米级外源纤维的加入可能会从微观上影响蛋白质体系的整体结构。同时,在纳米蛋白纤丝的制备过程中, 可在蛋白溶液中加入预形成的蛋白纤丝,起到种子化作用,这不仅可以加速纤丝的形成,而且有望调节纤丝的聚集度和性能[16]。 与此相类似的是,已证明高强度、高长径比的纳米纤维素对生物凝胶具有定向调控作用, 能够形成具有各向异性及不同力学性能的结构[22]。
3.2 外力辅助成型技术
实际上很多情况下蛋白浓度往往高于前面所述的自组装所需的浓度, 在受到外界作用影响的情况下, 蛋白质聚集可能不会导致明显的相分离现象(如形成沉淀),而是形成凝胶或高黏稠体,这在以热处理和机械加工为主的食品加工中最为常见[13]。 这些高粘稠体系或凝胶,在受到搅拌、振荡、挤压和切割等机械处理时, 剪切产生的应力可以使其变形, 通过除去溶剂或直接固化将这种变形固定,从而实现物料的组织化。 事实上,人们很早就开始利用外界物理力场如螺杆挤出对食品材料进行变形以形成预期产品形状, 其变形尺寸一般都是肉眼可见。最近,这种外力辅助成型也开始延伸到如剪切流动成型技术等能够对微观结构变形控制的新型成型技术中。另外,对流动性强的蛋白溶液也可通过外力将其引流成细长蛋白液流,然后再将其溶剂快速挥发或固定化, 从而达到纤维化的目的,如湿法纺丝和静电纺丝。
3.2.1 螺杆挤出成型 挤出技术是将植物基材料转化为纤维状产品最常用的商业技术, 其中以螺杆挤出方式最为常见。 螺杆挤出技术是指将物料预混合后添加少量分散剂(或称塑形剂,大部分为水),再通过外力(螺杆挤出时形成的高压高剪切力)使物料形变并最后通过模头固定形变以形成产品的过程,其通过加热、水合和剪切应力的组合处理,使高浓度蛋白质在筒腔内塑化/熔化,再通过末端模量挤出成型[8],如图5 所示。 早在上个世纪七八十年代人们就广泛利用挤出技术开发组织化植物蛋白, 后来发展了较为高端的拉丝蛋白产品。这些产品基本上为低水分产品,如组织化植物蛋白(TVP),吸水膨胀性好,韧性强,有一定的咀嚼度,大多用于仿肉制品或肉制品配料中。后来又开发了高水分产品(质量分数50%以上)的湿法挤压技术,现已基本成熟,成为植物基人造肉生产的主流工艺。虽然挤压加工被研究了许多年,但是这种方法对过程的控制和挤压产品的设计仍主要基于经验[23]。 此方法简单、方便且易于批量生产,然而达不到对材料微观结构的设计控制, 影响了仿生材料的逼真性和功能。
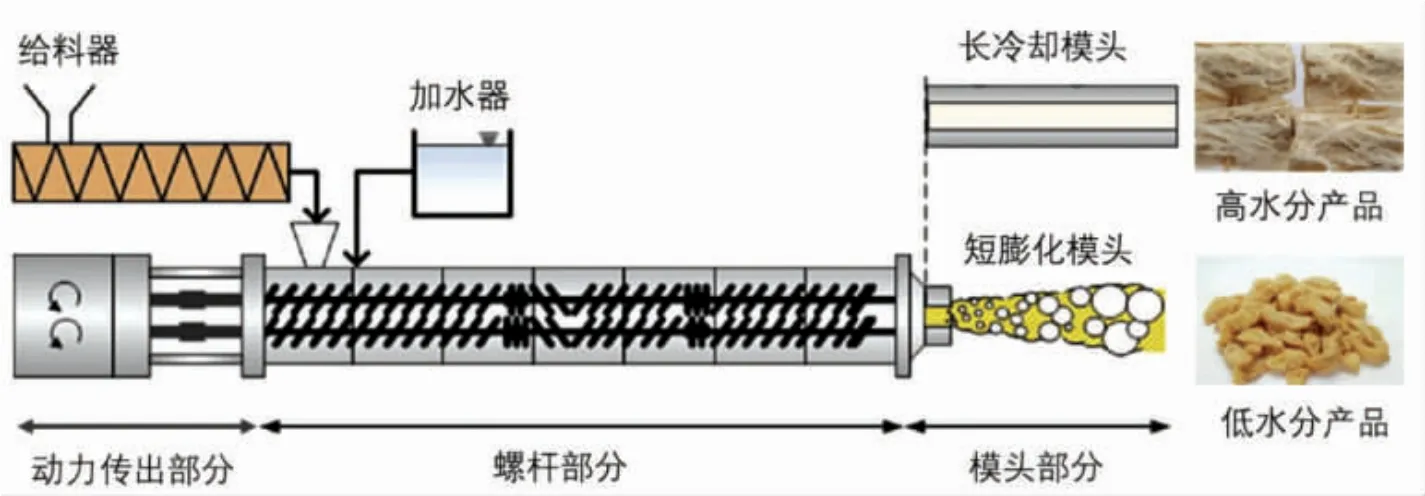
图5 用于人造肉生产的螺杆挤出机结构示意图[8]Fig.5 Schematic diagram of screw extruder for artificial meat production[8]
3.2.2 剪切流动成型 为了达到对成型过程中微观结构的控制,一种剪切流动(Shear flow)成型技术被开发用来生产纤维化产品。 其根据流变仪的设计原理[25],利用锥体转动时对腔内物料产生强大的剪切力而使物料组织化(图6)。 通常需要额外的加热辅助装置用于蛋白变性来提高体系的黏弹性。研究表明,此方法可实现对植物蛋白纳米尺度上的各向异性组织化的控制, 也可对动物蛋白如酪蛋白实现纳米尺度上的控制[25]。 目前,这项技术已成功地扩大化,设备的加工能力可达7 L[24]。

图6 剪切流动成型技术及相关的仿肉产品[24]Fig.6 Shear flow molding technology and related meat-like products[24]
3.2.3 湿法纺丝 为了实现蛋白质的纤维状成型, 可预先将蛋白质溶液沿细长的管道流出以形成蛋白质流, 然后再快速脱去溶剂或将蛋白质溶液固定化而实现纤维组织化, 这种技术称为湿法纺丝。 Boyer 早在1954年就申请了蛋白质湿法纺丝的专利,用于肉类似物的应用[26]。 其基本工艺流程是首先将含有蛋白质的溶液通过喷丝头挤出,然后浸入该蛋白质不可溶的溶剂中, 蛋白质在可溶和不可溶之间的交换导致挤压蛋白相的沉淀和凝固,形成直径为微米级的纤维丝,如图7a 所示。常见的大豆、 豌豆等植物蛋白均可通过湿法纺丝形成蛋白纤维。除了一维的单根纤维丝,也可形成具有三维结构的纤维团(图7b)。 湿法纺丝用于仿肉制品开发的优点是纤维形态规则、整齐,稳定性好,然而产量不适于放大,同时在生产过程中会产生大量的废液。

图7 湿法纺丝工艺流程图[27]Fig.7 Schematics of wet-spinning process[27]
3.2.4 静电纺丝 利用强电场将聚合物溶液或熔体形成喷射流并固化成纤维的过程称为静电纺丝。在电场作用下,针头处的液滴由球形变为圆锥形(即“泰勒锥”),并从圆锥尖端延展得到纤维细丝,其直径可达到纳米级(图8)。 能够形成静电纺丝的蛋白质必须是高度可溶的纤维状或无规则卷曲状而不是球状,并且需具有一定的黏性。植物蛋白通常不能满足这些要求, 因为它们可溶时呈天然的球状,而变性后多会形成不溶性聚集体。已报道一些动物蛋白如乳清蛋白、胶原蛋白、卵蛋白和明胶等可形成静电纺丝, 而植物蛋白中仅有少数如玉米醇溶蛋白被报道[28]。 其它植物蛋白可通过明胶等蛋白载体进行静电纺丝。 Nieuwland 等[29]展示了将玉米醇溶蛋白用作其它蛋白质如大豆蛋白载体的可能性, 这种利用混合蛋白进行静电纺丝的方法, 为此技术在食品领域的潜在应用提供了技术支持。 静电纺丝虽然对材料结构实现纳米尺寸控制, 但是将其作为潜在的人造肉生产技术仍存在很多障碍,主要表现在:一是扩大化生产所需的高昂设备投入,二是适宜原料的选择,如果仍需要明胶来进行静电纺丝, 那么最终产品仍难以达到真正的“无肉”要求。
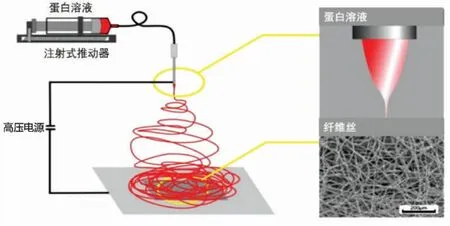
图8 静电纺丝成型工艺流程示意图[29]Fig.8 Scheme of an electrospinning equipment[29]
3.3 细胞培养技术(自组织技术)
模拟生物体材料(如肌纤维)的体内形成途径,以自下而上(bottom-up)的策略从分子水平组装合成纳米尺度的蛋白纤丝,再经过进一步聚集、结合,形成宏观可见的蛋白纤维,是使产品接近或达到肌肉纤维结构及相应的感官品质的最直接途径,如真菌蛋白、细胞培养肉等。 以自下而上的策略制备的食品材料属性虽更忠于天然食品, 但仍需继续探究其组装机理, 包括阐析生物体内自身的组装机制,以提高这一技术的应用进程。
3.3.1 微生物培养 为满足全球不断扩大的食物和蛋白质需求, 人们从上个世纪就开始利用微生物如细菌和酵母生产单细胞蛋白。经过10年的安全性评估,利用镰孢霉(Fusariumvenenatum)生产的菌蛋白(Mycoprotein)被英国食品与药物管理局正式批准作为食品,上市销售。菌蛋白是一种高蛋白、高纤维、低脂肪的食品成分,适合纳入健康饮食。菌蛋白是在好氧条件下,利用葡萄糖为主要碳源的培养基连续发酵产生的(图9)。 发酵完成后,通过短时间的热处理,降低其核糖核酸(RNA)含量(从干重的10%降到2%以下),然后通过离心收获菌丝体, 再与蛋清等粘合形成与肉纤维相似的纹理和味道[30]。 此外,也可以通过冷冻-脱水过程进一步形成更明显的纹理结构。 虽然此过程形成的纤维在宏观尺度上呈平行排列, 但是在微观结构上(毫米以下)为随机排列。 可以结合挤压技术或挤压流动技术使菌蛋白的微观结构更为规则[31]。
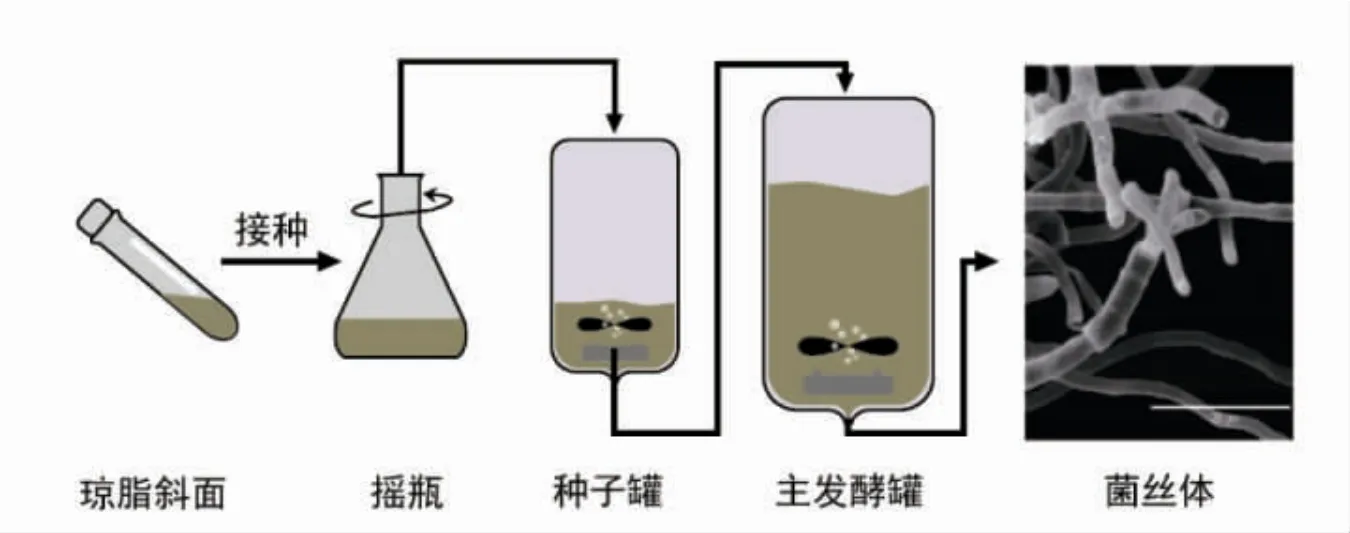
图9 菌蛋白深层培养示意(菌丝体摘自[31])Fig.9 Schematic diagram of bacterium protein by submerged fermentation(mycelium from literature[31])
目前,菌蛋白的生产工艺已经成熟,生产菌蛋白的培养基原料丰富,除了可利用含有胺、葡萄糖和生物素的合成培养基, 也可利用来源更为丰富的农副产品作为营养源。 据估计,使用1 t 的豌豆加工副产品可产生680 kg 的菌丝体,这比使用合成培养基多生产38%的蛋白质[32]。
菌蛋白作为一种商业化的生物合成仿肉制品, 为提供蛋白资源和减少肉类消费起到重要作用[33]。 然而,其在技术方面涉及菌种退化问题,如菌丝体纤维变短,甚至为球状,并且产量降低等问题也需要考虑。另外,菌蛋白可能引起潜在的过敏反应, 有必要对其相关产品进行安全评价以及开展毒理学试验和过敏性的评估研究。
3.3.2 动物细胞培养 动物细胞培养技术作为一种新兴的科技手段可用于开发更具有实际意义的人造肉产品。 原则上,只要有一个稳定的细胞系,无论来源于牛、猪、鸡,甚至是鱼或者其它可食用的动物, 就可以培养出动物肌肉组织用于肉类生产。简单地说,首先从数量有限的动物身上提取一些干细胞,繁殖并分化成肌肉细胞(成肌细胞),然后融合(形成肌管)并形成肌肉纤维(图10)。 在肌肉纤维培养过程中, 可加入细胞支架来促进肌细胞增殖与生长, 也可加入脂肪细胞进行共培养以提高脂肪含量。一旦肌肉纤维成熟并收获,可被加工成肉饼、肉丸等人造肉产品。
本世纪初, 美国国家航空航天局NASA 资助开发用于以食用为目的的动物培养组织[35]。 而真正意义上的人造肉是由马斯特里赫特大学(Maastricht University)教授马克·波斯特(Mark Post)于2013年8月培养的世界上第1 块牛肉汉堡[36]。 随后, 一大批公司和风投资金以及科研院所开始关注细胞培养肉。 2019年11月21日,我国南京农业大学周光宏教授团队使用猪肌肉干细胞培养出重达5 g 的中国第1 块细胞培养肉并通过了技术鉴定,掀开了国内细胞培养肉技术的攻关热潮。
作为细胞培养肉的开拓者马克·波斯特[37]详细评述了细胞培养肉的技术挑战[38],主要归纳为以下4 个方面:
1)细胞的筛选是细胞培养肉开发的关键。原则上讲,细胞培养肉属于细胞工程范畴,其细胞来源可为从原始组织中分离出来的原代细胞或细胞系。Kadim 等[39]介绍了可用于细胞培养肉的不同类型细胞,尤其是干细胞,包括胚胎干细胞、全能干细胞、多能干细胞、诱导多能干细胞和成体干细胞等。 目前从肌肉组织中提取的肌卫星干原代细胞(Myosatellite)应用最多。 另外,建立细胞系,包括将体细胞转化为诱导多能干细胞(iPSC)是细胞来源的另一种选择,其涉及的内容多,且细胞增殖与分化、遗传性状的稳定性等问题需要一一解决[40]。除了成肌细胞外, 脂肪组织来源的干细胞也是如此。
对成肌细胞的分化与增殖的控制则更为艰难。 如前所述,生物体内的细胞增殖(细胞数量增加)基本上在胚胎期已经完成,而出生后肌细胞仅进行肥大过程(分化成熟肌纤维),这是在一系列基因及信号因子的操控下完成的。 在体外培养尤其是大规模培养中, 如何精确把控细胞的增殖与分化仍仅限于经验,缺乏系统方法的理论基础。
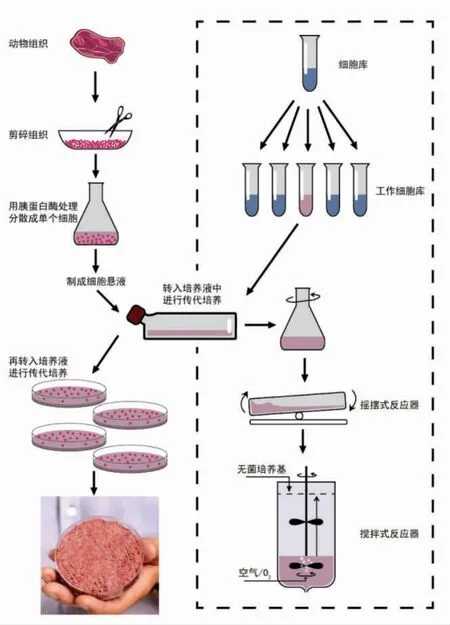
图10 动物细胞培养肉的生产工艺流程图[34]Fig.10 Production process flow chart of animal cell cultured meat[34]
动物体内肌纤维的肥大是在蛋白质的不断合成与分解中形成的, 而其中物理力学即神经控制下的肌肉收缩起到重要的作用, 这也是赋予肌肉的机械强度和质地的重要原因。 机械刺激在触发蛋白质合成和蛋白质组织收缩单位方面是极其重要的,其赋予肌肉典型的横纹肌微观形态。而目前构建人工支架使肌细胞粘附其上以形成张力,会促进所谓的生物人造肌肉产生蛋白质的理论仍需进一步验证[41]。 另外,在扩大化生产中如何操作也是潜在问题。除了被动拉伸和张力外,电刺激也能够促进肌细胞蛋白质合成, 促进肌纤维的提前成熟,而对于大规模生产,这种低效率的能量利用方式是否能够有效保证蛋白质的稳定合成, 还有待证明[37]。
2)培养基是细胞培养肉商业化的前提。培养基占据了细胞培养肉的大部分成本。 筛选来源广泛、质理稳定、安全卫生、成本低廉的细胞培养基无疑是一个相当艰巨的任务。 尤为重要的是培养基不应含有血清以及其它动物成分[42],然而目前含血清的培养基仍显著优于无血清培养基[43]。 同时,虽然培养基不会直接被人们消费,但是其来源的稳定性以及可追溯性是细胞培养肉作为食品的必要保障。此外,生产过程中产生的富含代谢废物的大量培养废液的处理也将是一个棘手的问题。
3)真正形成肉的多维结构体的技术仍不成熟。 目前细胞培养肉基本上是在2D 结构中形成的,或者说是在很薄(几百微米)的3D 结构中形成的,也就是说先进行肌纤维的培养,再收集组装形成肉饼、肉丸、香肠为代表的重组肉制品,而不能形成整块肌肉产品。要形成真正的肉块,需要优化形成更厚的3D 结构,这就涉及如何给内部细胞提供营养和氧气供应并去除产生的废物。 目前报道的产生了厚度为1 cm 的具有血管组织的3D 细胞结构体,其培养周期达6 周[44]。 此外,为解决之前提及的细胞培养肉缺少特有的材料特性以及相应的质地口感, 麻省理工学院的研究人员开发了1种方法, 即通过在明胶支架上培育牛和兔子的肌肉细胞,更好地模仿真肉的形状和味道[45],而无动物蛋白的细胞培养支架仍需进一步开发。
4)放大生产是细胞培养肉真正商业化的最大挑战。若要从培养的肌细胞中获取1 kg 蛋白质,则需要8×1012个细胞;如果悬浮培养,就需要1 个5 000 L 的搅拌型生物反应器[38]。 这个体积在已建立的生物处理中很常见, 而在组织工程和间充质干细胞扩展中尚未得到证实[46]。 为了实现更高的细胞密度, 一些其它类型的反应器如流化床生物反应器和中空纤维膜生物反应器虽可供选择,但仍需进一步实践验证。同时,如何在大型反应器中调控细胞分化,尤其是在不同类型细胞共培养时,远远要比控制其增殖复杂, 而现阶段的制备基本上是以单一的细胞进行的[38]。 此外,目前实验室肌肉细胞的培养主要是靠贴壁方式分化肌管以及成熟的肌纤维,虽然悬浮培养会提高生产效率,但是所形成的肌纤维形态是否发生改变, 仍需深入研究。如仍以贴壁方式生产,更大规模的适宜的相关生产设备需加大投入开发。
总之, 细胞培养肉作为真正意义上的肉类代替品,前景广阔,尤其是目前初步实验成功奠定了其潜在的商业化基础。然而,鉴于其较高的生产效率与逼真性是产品成功的关键, 根据目前的开发现状,在技术层面上仍需做很多改进和提升,还有很长的路要走, 并且在路途中还可能出现其它问题,包括真正商业化后。
4 结论
肉类作为人类饮食中蛋白质等营养物质的重要来源, 其过度生产与消费产生了许多潜在的全球化问题,如造成温室气体排放量增加,土地和水资源的大量消耗,损害动物福利,以及对人类健康产生的潜在影响等。 寻找新的蛋白质资源模仿肉的结构、形态、质地、风味,开发具有可持续性的、健康的肉类替代品,越来越受到关注。肉作为一种各向异性的材料组织,其不同组分、不同层次的组装复杂性从技术层面给开发其替代品带来了巨大挑战。以分子组装、细胞结构和组织构建为核心的结构生物学及仿生学等学科的迅速发展, 为食品仿生技术包括人造肉的开发提供了新的策略与手段。
蛋白质的自组装、 外力辅助成型和细胞培养(自组织)是目前主要的人造肉的纤维化技术,其在商业化生产上各有利弊。其中,蛋白质的自组装与外力辅助成型结合使用可能会实现优势互补,开发出不同组织形态和感官特性的仿肉制品。 同时,微生物发酵是目前成熟的细胞培养技术,利用其开发肉的代替品, 既能充分利用我国丰富的农副产品资源,也能满足人们对高纤维、低脂肪的食品的诉求。 动物细胞培养肉作为真正意义上的肉类代替品,发展前景广阔,已完成初步的实验室开发阶段, 然而由于其技术层面的许多障碍需要克服,因此未来还有很长的路要走,其真正的商业化还有很多不确定性。
从材料属性出发,以综合、多学科的角度研究肉和肉制品多样化的宏观物理属性以及其所表现出的特有的黏弹性和质构(口感),并阐析其微观结构的形成机制和策略, 在不同尺度上实现对人造肉产品结构的精细控制是目前重要的研究内容。 在具体应用方面,根据肉制品种类多样,组织结构迥异的特点,针对不同消费者的需要,采用行之有效的制备技术,开发出营养、健康、安全的肉类代替品,最大程度地实现资源的充分利用,能耗的最优化以及产品的高质化。
人造肉是一个新兴的食品产业, 产品的健康性是其发展的基础。崇尚与敬畏自然,积极开发食品仿生技术,大力发展健康仿肉制品,对优化我国农产品资源的综合利用效率, 促进肉类食品的多元化, 提升国人身体素质和生活质量具有重要意义。
