基于AHLs介导的革兰氏阴性菌群体感应调控及淬灭机制研究进展
2020-09-01崔天琦白凤翎励建荣
崔天琦 白凤翎 励建荣
(渤海大学食品科学与工程学院 生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心辽宁锦州 121013)
群体感应(quorum sensing,QS)是细菌以细胞密度依赖性方式协调基因表达和生理行为的系统[1]。它由自体诱导物(autoinducers,AI)介导,被动地与周围环境中的细菌细胞进行有效信息交换[2],信号分子的积累与细菌数量成正比。 当信号分子浓度达到阈值时, 同源受体结合信号分子并触发信号转导,导致其在生物膜形成、生物发光、质粒接合转移以及毒力因子等QS 表型表达[3]。 目前,在已鉴定的细菌多种信号分子中, 革兰氏阴性菌产生的N-酰基高丝氨酸内酯类 (N-acylated homoserine lactones,AHLs)信号分子介导的QS 现象在海洋生态环境的细菌中最为常见。 群体感应淬灭(quorum quenching,QQ)是指通过抑制AHLs合成,降解AHLs 以及阻断AHLs-LuxR 相互作用3 种方式干扰和破坏自身诱导的QS, 进而抑制介导细菌行为的基因表达。 由于细菌可通过感知信号分子浓度的波动监测细胞密度的变化确定是否激活某些与QS 启动和调控相关的基因, 因此AHLs 类信号分子在革兰氏阴性菌QS 调控和QQ中起着关键作用。
本文综述AHLs 类信号分子在革兰氏阴性菌的QS 调控和QQ 过程中作用机制的研究进展,为研究革兰氏阴性菌群体感应的调控和淬灭机制提供参考。
1 革兰氏阴性菌QS 系统及调控机制
绝大多数革兰氏阴性菌QS 系统主要由AHLs、AHLs 合酶(LuxI 蛋白)和AHLs 受体(LuxR族蛋白)3 类成分组成[4-5]。如图1 所示,在AHLs 调控的细菌QS 系统中,AHLs 由细胞内的AHLs 合成酶基因(如luxI)以低细胞密度合成并分布在细胞中。 当AHLs 和细胞浓度很低时,AHLs 无法结合AHLs 受体, 不能引起AHLs 合成酶基因转录,QS 表型无法表达。 随着AHLs 在环境中逐步累积[6],当达到高细胞密度时,AHLs 以细胞密度依赖性方式生长。 当AHLs 随细胞密度达到浓度阈值时,AHLs 结合其受体并激活转录因子(LuxR),活化的AHLs-LuxR 蛋白复合物通常与QS 的DNA(基因的启动子区)邻近同源二聚化并结合,激活由QS 系统控制的靶基因的转录,触发QS 系统调控的基因表达[1]。
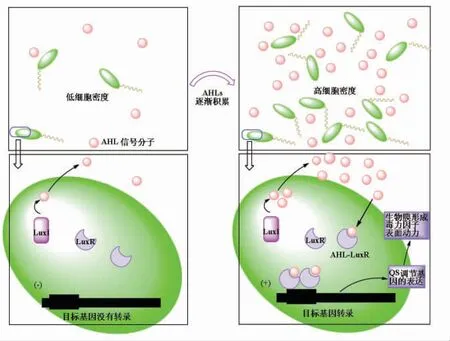
图1 革兰氏阴性细菌AHLs 介导QS 调控基因表达示意图Fig.1 Schematic representation of QS-regulated genes in AHLs of gram-negative bacteria
1.1 革兰氏阴性菌AHLs
1.1.1 AHLs 结构 AHLs 是一类中性脂质小分子,不同种类的细菌合成的AHLs 结构不同,其最基本的结构是由具有酰基链的高丝氨酸内酯环(homoserine lactone,HSL)组成(图2)[7]。 不同来源的AHLs 侧链的大小、取代基及饱和度不同,酰基侧链的长度通常在C4到C18之间。 大多数含有偶数个碳原子,以两个碳单位(C4,C6,C8等)逐增,碳3 位置处可以结合不同的取代基, 如-H、-OH、=O或-OXO 等, 常见革兰氏阴性菌AHLs 包括:C4-HSL、C6-HSL、C8-HSL、C10-HSL、C12-HSL、3-oxo-C8-HSL,3-oxo-C12-HSL 和3-OH-C10-HSL 等。不同细菌AHLs 的种类不同, 酰基侧链的饱和度也存在差异[8]。 AHLs 中HSL 是亲水基团,而其侧链具有疏水性, 因此可在水环境中保持稳定的两亲性分子状态。
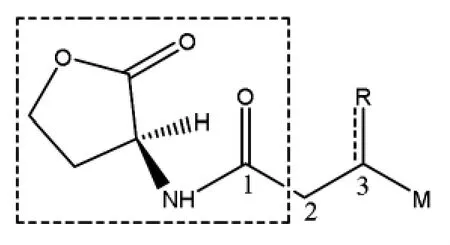
图2 革兰氏阴性菌AHLs 的化学结构式Fig.2 Chemical structure of Gram-negative bacteria AHLs
1.1.2 革兰氏阴性菌AHLs 的合成 目前已经确定100 多种变形杆菌能够产生AHLs。在海洋生态环境中栖息的嗜水气单胞菌 (Aeromonas hydrophila),杀鲑气单胞菌(A. salmonicida),鲁氏耶尔森氏菌(Yersinia ruckeri),鳗弧菌(Vibrio anguillarum),哈维氏弧菌(V. harveyi),创伤弧菌(V.vulnificus),迟缓爱德华氏菌(Edwardsiella tarda)和海洋屈挠杆菌(Tenacibaculum maritimum)均分泌形成AHLs。在革兰氏阴性菌体内,主要由LuxI、LuxM 和HdtS 蛋白家族3 类合酶在细胞内合成其AHLs[9]。
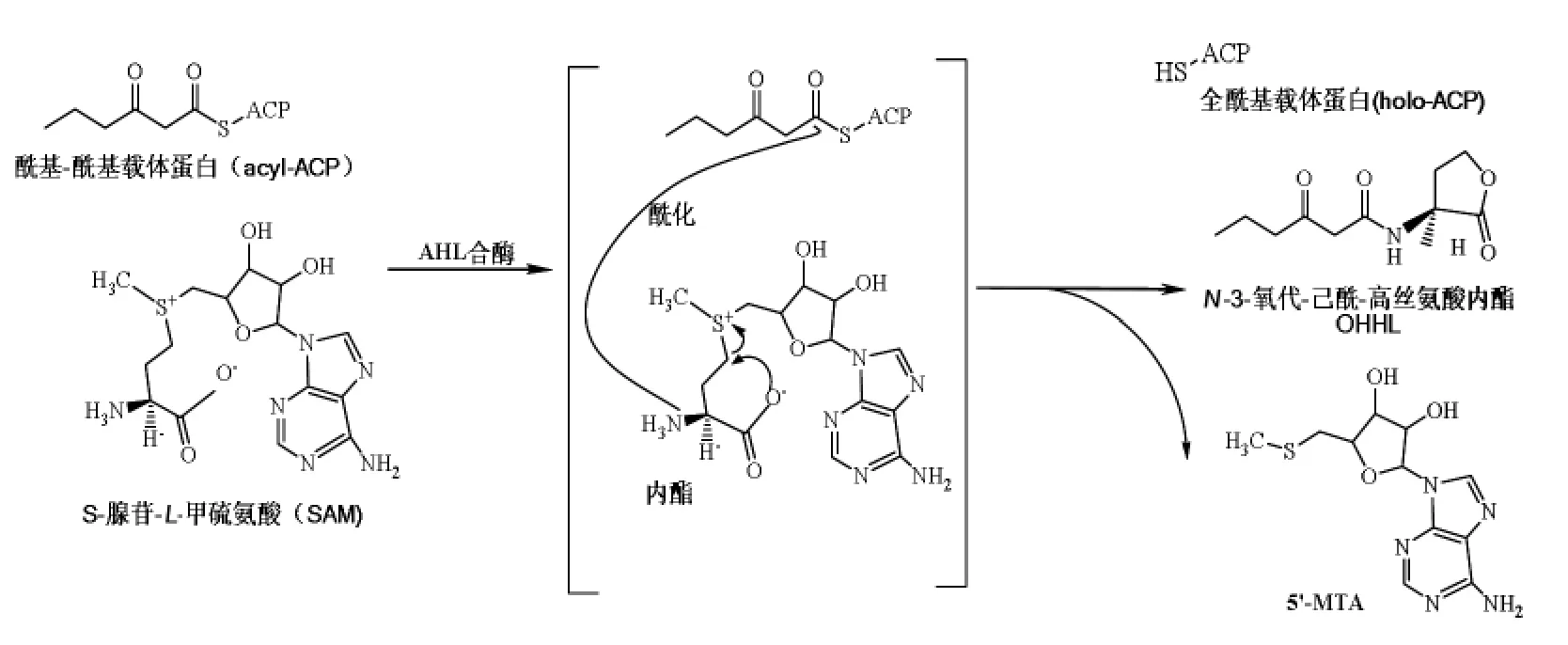
图3 革兰氏阴性菌AHLs 合成反应示意图Fig.3 Schematic representation of the synthesis reaction of Gram-negative bacteria AHLs
1)LuxI 酶 首先在费氏弧菌 (Vibrio fischeri)的lux 操纵子中发现LuxI 酶, 大多数已知AHLs 合酶是LuxI 蛋白家族的成员[10]。 对于LuxI酶和TraI 酶的体外研究发现, 初级酰基链供体是酰基-ACP(Acyl-acyl carrier protein,acyl-ACP),其内酯环来源于腺苷酰-L-甲硫氨酸(S-adenosyl-L-methionine,SAM)侧链,LuxI 合酶可利用此两种底物合成AHLs。 AHLs 合成反应机理主要包括酰化和内酯化两步骤(图3)[11]:先是SAM 与LuxI 酶结合,SAM 的胺基对酰基羰基碳(acyl-ACP)进行亲核式攻击形成丁酰基-SAM (Butyryl-SAM);然后与acyl-ACP 结合引发N-酰化(N-acylation)反应后使SAM 内酯化。 同时,在形成5’-甲硫腺苷(5’-methylthioadenosine,5’-MTA)之前释放全部的ACP。
2)LuxM 酶只有几种γ变形杆菌具有LuxM 家族酶[7]。 在哈维氏弧菌中,luxM 被鉴定为其形成LuxM 酶的一个基因,是形成特定AHLs 必需的酶。 在费氏弧菌等相关弧菌中,AinS 酶和VanM 酶产生AHLs[12],它们均具有与luxM 相似的基因序列。 除了利用酰基辅酶A (acyl-coenzyme A,acyl-CoA)之外,AinS 酶和VanM 酶对AHLs 合成的底物的要求也与LuxI 家族合酶类似。
3)HdtS 酶 HdtS 酶最初在荧光假单胞菌(Pseudomonasfluorescens)F113 中被鉴定出来,它产 生C6-HSL、N-(3-OH-7-cis-tetradecenoyl)-HSL 和C10-HSL 类信号分子。 HdtS 属于溶血磷脂酸-酰基转移酶家族成员[13], 可利用acyl-ACP 和acyl-CoA 两者作为底物酰化形成溶血磷脂酸[14],而HdtS 催化AHLs 合成的酶促反应机制还没有明确。此外,AHLs 生产所需HdtS 酶的特征还不确定,而在细菌体中不存在产生AHLs 的同系物。 该类细菌酶家族似乎具有两个功能,即:溶血磷脂酸的酰化和AHLs 的合成。
1.2 革兰氏阴性菌QS 调控机制
最早发现QS 系统调控机制的革兰氏阴性菌是海洋中产生发光现象的费氏弧菌。 当调控生物发光基因的密度达到阈值时, 会诱导费氏弧菌发光基因的表达而产生发光现象[15]。 费氏弧菌的QS调控蛋白包括LuxI 和LuxR, 其中LuxI 为自诱导物合酶,LuxR 蛋白为细胞内自诱导物感受因子。同时,LuxR 也是DNA 结合转录激活元件。 编码自诱导物合成酶的luxI 基因位于luxICDABE 操纵子的片段上,调控3-oxo-C6-HSL 信号分子的合成[16]。当LuxR 与3-oxo-C6-HSL 结合后被激活,LuxR 编码一个转录子与上游luxICDABE 操纵子结合刺激荧光激酶系统必要组分的转录,合成蛋白LuxI[17]。现已证实绝大多数革兰氏阴性菌QS 系统均与费氏弧菌的LuxI/R 型QS 的双组分系统类似,因此,费氏弧菌的LuxI/R 双组分系统已被视为革兰氏阴性菌QS 的模式系统。
近年来,铜绿假单胞菌(Pseudomonas aeruginosa)QS 系统的调控机制也逐渐被人们所认识[18]。该系统是由多层次群体感应链控制, 现已确定两组LuxI/R 同系物信号系统分别为LasI/LasR 和RhlI/RhlR[19]。LasI 和RhlI 是自诱导分子合成酶,它们分别产生3-oxo-C12-HSL 和C4-HSL 两类AHLs信号分子[20],而LasR 和RhlR 为转录激活剂。 这两个群体感应系统在铜绿假单胞菌毒力因子的高效表达、碱性蛋白酶、弹性蛋白酶、绿脓菌素等的产生中发挥联合作用[21]。 目前,铜绿假单胞菌QS 系统多层次群体感应链中的第3 组自诱导物还需进一步鉴定[22]。
除费氏弧菌和铜绿假单胞菌之外, 其它革兰氏阴性菌产生AHLs 或具有LuxR/I 同系物的分布情况见表1。 两种常见病原体嗜水气单胞菌(A.hydrophila)和杀鲑气单胞菌(A. salmonicida)的调节蛋白分别为AhyI/R 和AsaI/R[23]。 AhyI 和AsaI主要合成C4-HSL 和C6-HSL 信号分子。 鳗弧菌(V. anguillarum)中表达LuxI/R 的同系物VanI/R,VanI 催化3-oxo-C12-HSL 信号分子的合成[21]。
综上, 革兰氏阴性菌的群体感应调控机制十分复杂。不同革兰氏阴性菌,群体感应调控机制具有一定的差异, 同一革兰氏阴性菌也可能存在多个QS 调控体系。
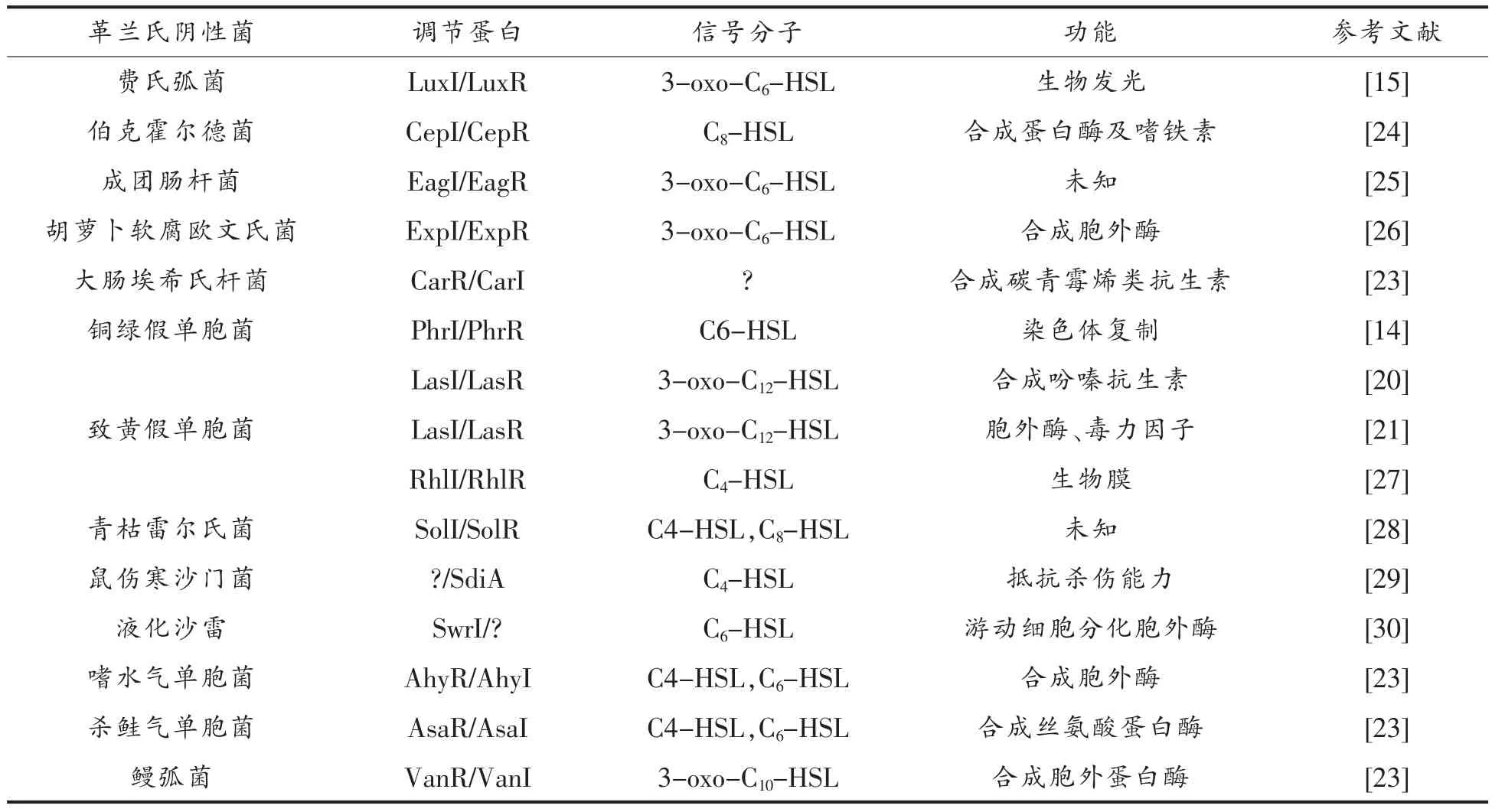
表1 常见革兰氏阴性菌QS 调节系统Table 1 QS Regulation system of common gram-negative bacteria
2 基于AHLs 革兰氏阴性菌QS 的淬灭作用
AHLs 类信号分子对革兰氏阴性菌QS 系统的调控具有十分重要的作用, 通过干扰或破坏AHLs 的合成可以达到淬灭革兰氏阴性菌QS 系统的目标[31]。 研究表明AHLs 合成酶(I)、AHLs 信号及AHLs 受体蛋白(R)构成了LuxI/R 型QS 系统中3 个明显靶点,若QS 系统的其中一个靶点受到外部干预或破坏, 都可能破坏菌体的分子信息传导,使QS 调节的目标基因不能表达(图4)。 而在铜绿假单胞菌等一些细菌中QS 系统淬灭作用机制更为复杂。革兰氏阴性菌QS 的淬灭作用是通过干扰和破坏AHLs 介导的QS 系统,使受试细菌表型基因不能表达, 进而实现抑制革兰氏阴性菌QS 的目标。
2.1 抑制AHLs 合成
LuxI 酶利用acyl-ACP 和SAM 催化AHLs 合成[32]。 SAM 是AHLs 合成的必要和独特的中间体,抑制AHLs 合成的研究主要集中在SAM 的各种类似物的使用上。 此外,还发现嘌呤核苷酸、高丝氨酸内酯衍生物和某些大环内酯类抗生素的同系物和类似物可抑制AHLs 合成[33]。
2.2 降解AHLs 分子
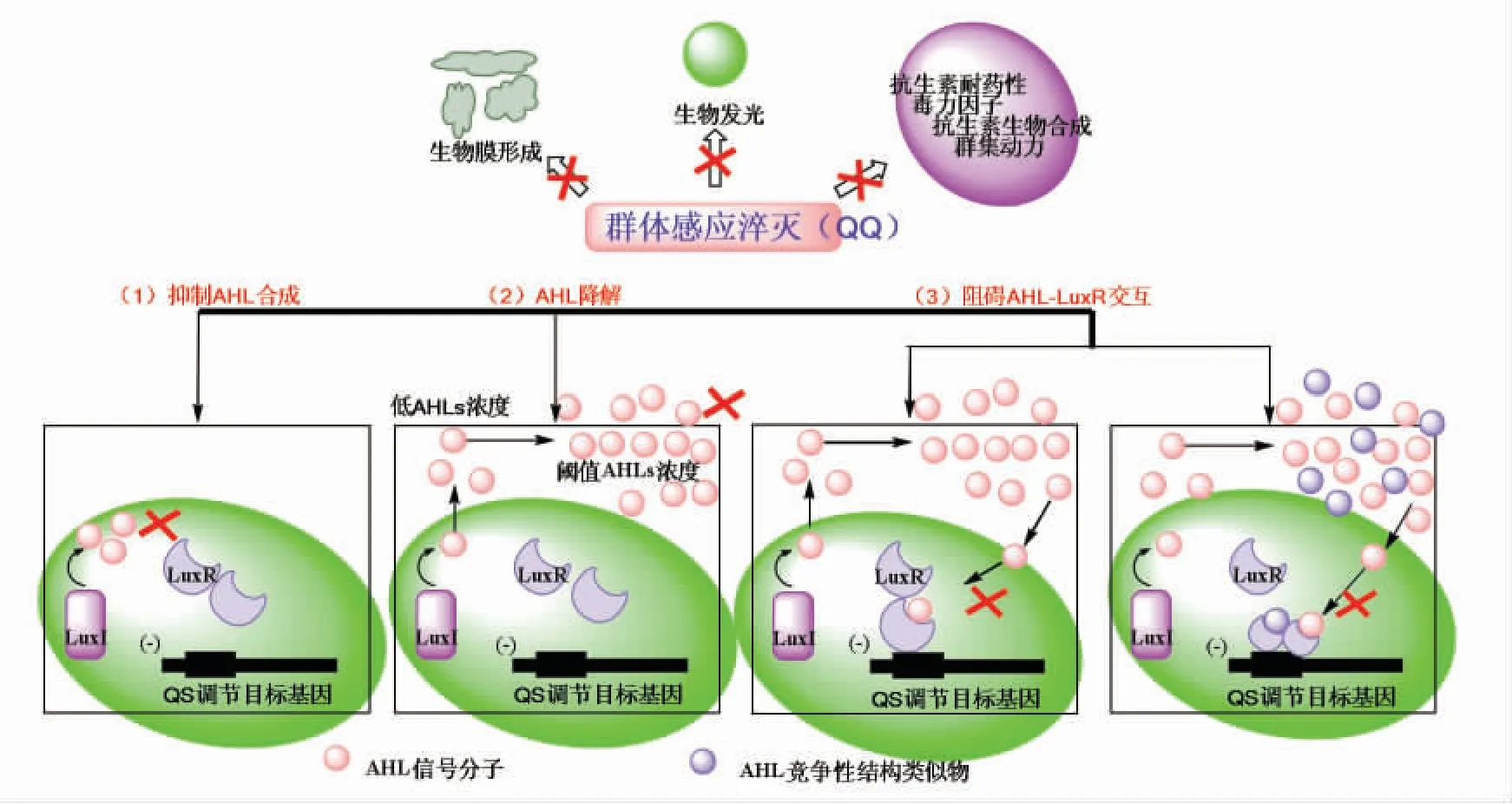
图4 革兰氏阴性菌的QQFig.4 QQ of Gram-negative bacteria
AHLs 信号分子的降解会破坏细菌的正常通讯途径。 目前为止已知有3 种降解方式, 包括化学、代谢和酶降解。 化学降解主要是指碱性pH 值导致内酯环打开,并导致AHLs 信号的活性丧失。然而,内酯环可以重新环化,并且AHLs 信号的活性在酸性pH 值下可以逆转。 对一些细菌如假单胞菌菌株PAI-A 和争论贪噬菌等进行代谢AHLs信号生长能力的研究。 AHLs 信号包括AHLs 内酯酶、AHL 酰基转移酶和氧化还原酶在内的QQ 酶完全降解或失活。
2.3 LuxR 型蛋白
目前,有关QS 抑制作用的研究大多数集中在阻断AHLs-LuxR 的相互作用,现已发现能够竞争或干扰天然AHLs 信号和LuxR 型受体结合的拮抗剂[34]。 研究证明从自然界筛选具有拮抗作用的AHLs 类似物,可阻碍AHLs 与LuxR 的受体结合[35],也可通过化学手段修饰AHLs 的酰基侧链形成AHLs 类抑制剂,主要是针对AHLs 高丝氨酸内酯环上的几个取代基进行修饰,形成能够结合LuxR的化合物。
3 AHLs 分子的酶解机制
对AHLs 的降解不仅是QQ 的重要目标,也是缓解细菌形成生物膜的有害作用,降低QS 毒力因子以及开发QSI 的有效策略。 目前, 降解或淬灭AHLs 分子共有AHLs 内酯酶(AHLs-lactonases)、AHLs 酰基转移酶(AHLs-acylases)和氧化还原酶(oxidoreductases)3 类酶(图5)[36]。表2 至表4 列出具有降解或淬灭QS 作用的微生物、动物组织和土壤宏基因组中QQ 酶的类型及信号分子种类,其中大多数QQ 酶在相应的细菌和真菌细胞中得到表征。
AHLs 内酯酶以水解和可逆两种方式切割HSL 的酯键形成同源的酰基高丝氨酸(AHS)衍生物[37]。 目前,已鉴定大多数AHLs 内酯酶都来源于细菌,如芽孢杆菌属240B1,酸门杆菌属[38]。
AHLs 酰基转移酶以不可逆的方式破坏高丝氨酸内酯和酰基链之间的酰胺键, 并释放游离的高丝氨酸内酯和相应的脂肪酸[39]。 降解产物失去信号分子传导活性,从而达到淬灭QS 的作用。 目前,已从铜绿假单胞菌和鱼腥藻属PCC7120[40]等细菌中获得广谱性AHLs-酰基转移酶。
氧化-还原酶以氧化或还原两种方式催化酰基侧链,使AHLs 信号的结构被修饰而不被降解。AHLs 分子结构的变化影响本身的特异性和识别性功能,从而导致细菌QS 表型的紊乱[41]。 迄今为止, 仅有红串红球菌W2 和巨大芽胞杆菌等少数细菌产生氧化-还原酶[33]。
3.1 AHLs 内酯酶
目前, 在多种生物体的不同蛋白质家族中发现对AHLs 信号分子具有降解活性的内酯酶,酶解AHLs 分子内酯键后转化形成相应的N-酰基高丝氨酸, 酶促降解类似于pH 值依赖性内酯溶解,它可在酸性介质中逆转(图5a)。 第1 个被鉴定的AiiA 酶是来源于芽孢杆菌属菌株240B1 由aiiA 基因编码的AHLs 内酯酶[12]。 在红串红球菌W2 中鉴定了不同种类的AHLs 内酯酶,从种皮微杆菌StLB037 和苍白杆菌属T63 中分离的AIIM和AidH,也被鉴定为AHLs 内酯酶[42]。来自海洋假交替单胞菌1A01261 产生的AHLs 内酯酶QsdH被鉴定,该酶是一种具有预测位于周质延伸的N-末端催化GDSL 水解酶结构域和C-末端RND 型外排泵结构域作用的内膜蛋白[51]。 从根瘤菌属NGR234 分离得到的胞外内酯酶DlhR 具有保守的GSD(L)序列和二烯内酯水解酶结构域,具有几种其它的QQ 酶, 其中至少一种属于金属内酰胺酶家族的AHLs 内酯酶(QsdR1)[53]。 目前,已确定的大多数细菌来源AHLs 内酯酶,如表2 所示。
AiiA 型内酯酶在条件致病菌铜绿假单胞菌中的表达阻止了由QS 控制的生理生化行为,包括降低了3-O-C12-HSL 含量, 阻止了C4-HSL 积累,减少了细胞外毒力因子产生以及群集运动性[47]。AiiA 内酯酶在伯克氏菌中的表达降低了AHLs 浓度并改变群集和泳动运动[52],aiiA 基因重组到植物中能够预防由胡萝卜软腐欧文氏菌引起的软腐病。 在铜绿假单胞菌PAO1 中表达的几种其它类型QQ 酶影响泳动性和生物膜形成[51-53]。 在植物病原体果胶杆菌中几种AHLs 内酯酶基因的异源表达降低了本身AHLs 水平, 降低了细胞外果胶分解酶的水平并减弱该病原体在马铃薯或其它植物中的致病作用[58]。
这些结果表明,通过水解AHL 内酯酶的方法淬灭AHLs 信号,是干扰细菌感染的可行策略。
3.2 AHLs 酰基转移酶
在芽孢杆菌属240B1 中发现AiiA 内酯酶后不久, 又发现菌株争论贪噬菌VAI-C 可以AHLs作为能源和氮源诱导形成一种AHLs 酰基转移酶, 该酶不可逆地水解AHLs 酰胺键后形成HSL和相应的脂肪酸(图5b)。争论贪噬菌VAI-C 可以降解不同长度酰基侧链(从C4到C12)的各种饱和AHLs 和3-oxo-C8-HSL。 脂肪酸可作为碳源和能源支持VAI-C 的生长,而HSL 只作为氮源。 后续研究在铜绿假单胞菌、青枯菌[61]、丛毛单胞菌属[67]、丁香假单胞菌[65]、希瓦氏菌属[60]、苍白杆菌属[64]、红串红球菌W2[39]和链霉菌M664[62](表3)等细菌中也鉴定了AHLs 酰基转移酶[70]。布鲁氏菌是一种能够产生长链AHLs 的导致人畜共患病的病原体,在体外或巨噬细胞感染期间可以产生具有控制内在AHLs 自诱导剂的AHLs 酰基转移酶(AibP),降解AHLs 后影响其致病作用[63]。在铜绿假单胞菌中发现和表征了另一种AHLs 酰基转移酶PvdQ,它与AiiD 酰基转移酶具有很高的同源性,只降解长链AHLs。
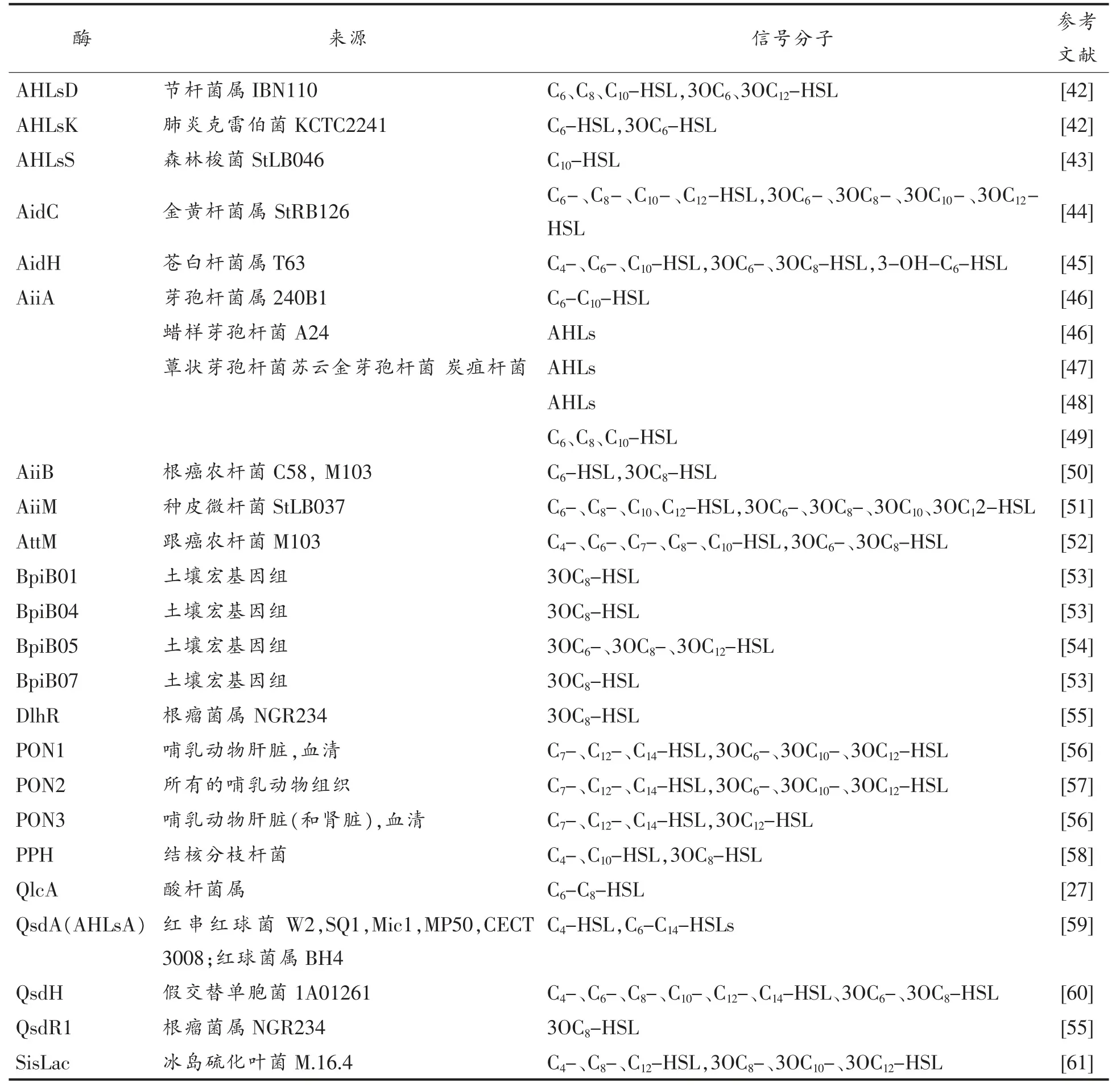
表2 降解或淬灭QS 的AHLs 内酯酶Table 2 AHLs-lactones that degrade or quench QS
大多数AHLs 酰基转移酶表现出对长链AHLs 降解的偏好。 然而,来自鱼腥藻属PCC7120的AiiC 酶可水解不同长度的AHLs[30]。表型分析显示PvdQ 在体外可作为一种QQ 剂, 添加PvdQ 到铜绿假单胞菌PAO1 培养物中可抑制3-oxo-C12-HSL 的积累、喹诺酮信号(Pseudomonas quinolone signal,PQS)合成以及弹性蛋白酶和绿脓菌素等毒力因子的表达。 AHLs 酰化酶的QQ 活性在各种QS 系统中得到证实, 这些酶可以用于控制AHLs介导的革兰氏阴性菌的致病作用。
与AHLs 内酯酶相比,AHLs 酰基转移酶更易于应用生物技术实现QQ 作用, 因为与内酰胺酶产物N-酰基高丝氨酸相反,酰基转移酶的反应产物不能自发再生为功能性QS 信号,且酰基转移酶产生的脂肪酸通常易于分解。
3.3 AHLs 氧化-还原酶
氧化-还原酶通过氧化或还原AHLs 的方式中断细菌QS 系统,而不是水解作用(图5c)。 最近仅在伯克霍尔德氏菌属GG4、巨大芽胞杆菌等细菌中发现了几种氧化还原酶(表4),来自巨大芽胞杆菌的细胞色素P450 单加氧酶CYP102A1 具有氧化N-脂肪酰基氨基酸和脂肪酸的活性,在酰基ω-1,ω-2 和ω-3 碳上羟基化催化AHLs 及其内酯分解为N-酰基高丝氨酸类产物。
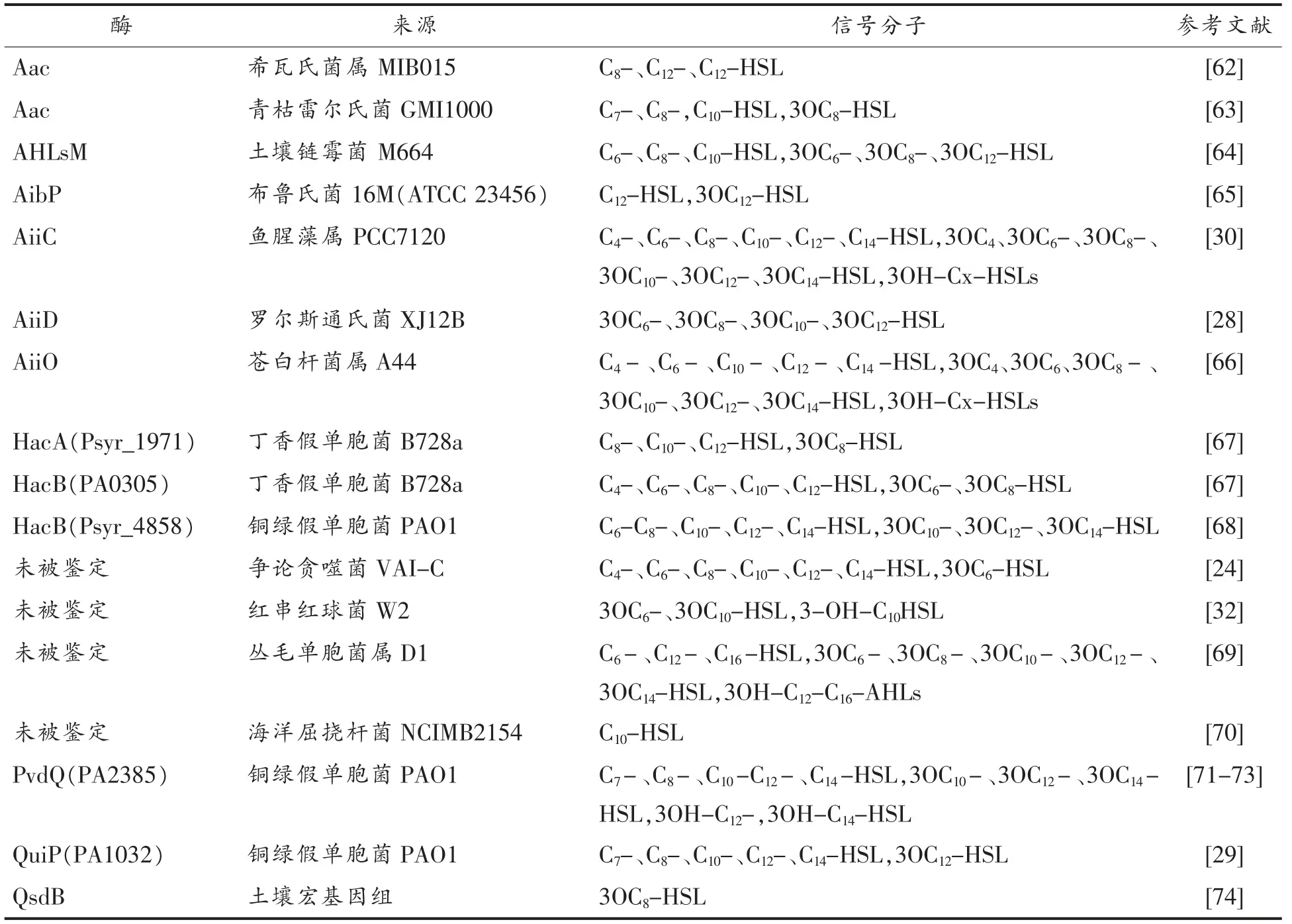
表3 降解或淬灭QS 的AHLs 酰基转移酶Table 3 AHLs-acylases that degrade or quench QS
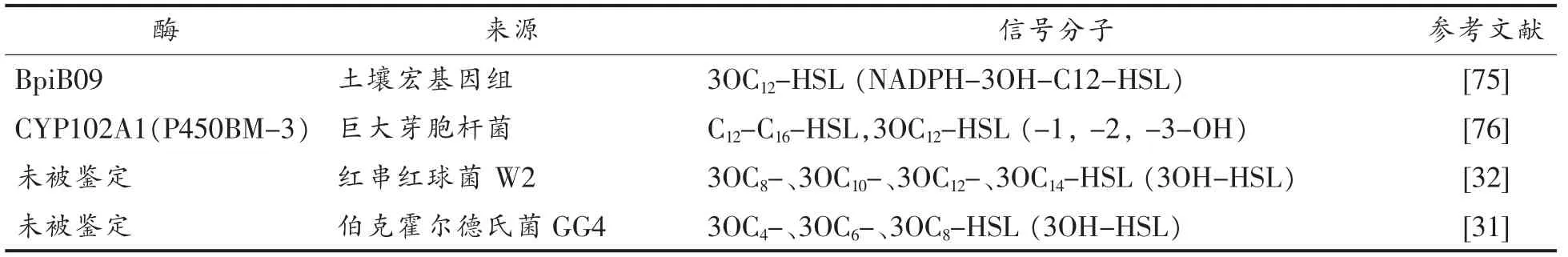
表4 降解或淬灭QS 的氧化-还原酶Table 4 Oxidoreductases that degrade or quench QS
除了形成内酯酶QsdA 和AHLs 酰基转移酶之外,红串红球菌W2 也具有氧化还原酶,可催化3-O-C(8-14)-HSL 使其还原为相应的3-OH-HSL,导致信号分子失活[32]。 从姜根系分离的伯克霍尔德氏菌GG4 也能够还原3-oxo-AHLs[31]。从土壤宏基因组文库中鉴定的另一种新型的氧化-还原酶BpiB09 可以催化3-oxo-C12-HSL 还原成3-OHC12-HSL, 该酶在铜绿假单胞菌中的表达影响QS调节基因的转录,减少绿脓菌素的产生,降低了菌体泳动性和生物膜形成[73]。
通过利用卤过氧化物酶氧化, 如次溴酸和次氯酸等卤素化合物形成活性氧分子, 用于杀灭病原微生物。 有学者提出一些海洋巨藻可以通过利用卤过氧化物酶系统来控制其表面上的生物膜形成, 表明由该类酶产生的卤素抗微生物剂引起的信号失活可促成天然细菌群落中的生物膜得到控制。
4 小结
细菌群体感应是当前微生物领域研究的热点之一,AHLs 信号分子是革兰氏阴性菌信息交流的物质基础。 通过干扰、破坏和降解AHLs 类分子是阻断群体感应的主要方式。 本文对革兰氏阴性菌群体感应具有淬灭作用的酶研究进行综述。 从近年的研究来看, 一是降解AHLs 分子酶的来源广泛,包括细菌、真菌和动植物组织;二是酶的种类繁多,不同来源的酶种类不同,大致分为AHLs 内酯酶、AHLs 酰基转移酶和氧化还原酶; 三是酶的降解对象和作用机制具有很大差异性。
基于AHLs 的QS 和QQ 的外源性调控作用,对控制QS 所形成的生物膜、毒力因子、生物发光等现象具有主导作用。 利用外源性AHLs 降解酶的QQ 作用,是控制QS 的一种具有潜在前途的防控策略。相对于添加抗生素等传统控制手段,生物源性QQ 作用具有生态环境友好,绿色、安全、高效等特点。随着研究的深入,必将为控制致病微生物和腐败菌的产生具有划时代的意义。
