基于高通量测序分析2种夹江腐乳中的微生物
2020-09-01万红芳汪立平
万红芳 汪立平* 赵 勇 李 立
(1 上海海洋大学食品学院 上海201306 2 食品热加工工程技术研究中心 上海201306 3 农业部水产品贮藏保鲜质量安全风险评估实验室 上海201306)
夹江腐乳是四川省的名优特色腐乳, 产于乐山夹江县,已有150 多年的生产历史[1]。 它以黄豆为原料,经过浸泡、磨细、制坯、培菌后,加入多种辅料并装坛密封发酵而成。因其配方独特,滋味浓郁,营养丰富,食用后余香不绝,故颇受当地消费者及外地游客的喜爱。 腐乳是我国传统大豆发酵制品,具有浓郁的民族特色,有“东方奶酪”的美称。腐乳的发酵是一个复杂的生物化学过程,其中微生物的种类和数目对其品质起着决定性的作用[2]。
长期以来,研究者们通过纯培养的方法,从传统发酵食品中分离鉴定多种微生物, 然而这种方法只适用于可培养的微生物, 其含量占环境微生物的极小部分(<1%)[3]。 近年来,变性梯度凝胶电泳(Denatured gradient gel electrophoresis, DGGE)等分子生物学方法, 被广泛应用于食品中微生物的检测、鉴定和群落结构的研究[4-5]。 然而,这些方法既耗时又昂贵, 而且难以检测低丰度的微生物类群, 在微生物群落和多样性分析方面仍具有较大的局限性[6]。 高通量测序(High-Throughput Sequencing,HTS),是最近几年新兴发展的生物学技术,能一次测序数百万条DNA 分子,具有比以往方法更高的分辨率,能准确、快速揭示样本中的微生物多样性及其群落组成[7]。 目前,研究人员通过高通量测序分析多种发酵食品中的微生物, 如泡菜[7]、榨菜[8]、豆酱[9]和豆豉[10]等,发现了更加丰富的微生物类群, 说明该技术在食品微生物快速检测方面具有广阔前景。
作为一种极具地域特色的自然发酵食品,夹江腐乳中的微生物均来自于自然环境。 由于目前对其中的微生物群落组成尚不清楚, 因此可能会出现一些质量问题和安全隐患。 再加上近些年来低盐腐乳的研制与开发,使得这些问题格外突出。本试验通过高通量测序结合传统培养的方法,对比分析2 种类型的夹江腐乳——香辣腐乳和白菜腐乳(以腌制白菜叶包裹腐乳坯)中的微生物,旨在填补辣味腐乳和花色腐乳中微生物的研究空白, 为深度挖掘地域性发酵食品中的微生物资源提供依据, 同时也为夹江腐乳质量安全方面的研究提供参考依据。
1 材料与方法
1.1 样品来源及取样方法
市购2 种夹江腐乳样品——香辣腐乳和白菜腐乳,产自四川省夹江县清江酿造厂。两种样品出厂日期均为2018年1月14日, 开封取样日期均为2018年1月17日。
在无菌条件下打开样品包装, 从腐乳罐中心部位依次取香辣腐乳25 g(其中腐乳块24 g,汤汁1 mL),白菜腐乳25 g(其中白菜12 g,腐乳块12 g,汤汁1 mL)。 每种样品取样2 份,1 份放入无菌均质袋中,加入225 mL 无菌生理盐水,用均质机均质;另1 份放入无菌管中,置-20 ℃冷冻保藏备用(用于提取微生物总DNA)。
1.2 试剂及仪器
平板计数琼脂 (PCA)(用于细菌总数和芽孢杆菌数目的测定)、孟加拉红琼脂(用于霉菌和酵母菌数目的测定)、MRS 琼脂(用于乳酸菌数目的测定),上海国药集团化学试剂有限公司;细菌基因组DNA 抽提试剂盒、 真菌基因组DNA 抽提试剂盒、琼脂糖、TAE、Tap PCR Master Mix、引物、PCR 产物纯化试剂盒, 上海生工生物生物工程有限公司;AxyPrep DNA 凝胶回收试剂盒,AXYGEN公司。
SW-CJ-1F 无菌操作台, 苏州安泰空气技术有限公司;JX-05 拍击式均质机,上海松茂生物科技有限公司;HH-1 恒温水浴锅,上海博讯实业有限公司;GNP-9270 隔水式恒温培养箱, 南京先玺仪器设备有限公司;LDZX-50KBX 立体式灭菌器,上海申安医疗器械厂;H1650-W 高速离心机,长沙湘仪离心机仪器有限公司;DYY-6C 电泳仪,北京市六一仪器厂;Tocan240 凝胶成像仪, 美国Bio-rad 公司;GeneAmpR9700 型PCR 仪, 美国ABI 公司。
1.3 平板培养
通过均质机将2 种腐乳样品充分拍打均匀后, 立即放入无菌操作台中进行系列稀释(10-1~10-7),然后分别取各梯度稀释液1 mL 于无菌平皿中,立即倾倒已融化并冷却至50 ℃的培养基(PCA培养基、孟加拉红培养基、MRS 培养基),摇匀后制成琼脂平板。 将剩余的稀释液放入80 ℃的恒温水浴锅中处理10 min, 然后按照相同的方法制成琼脂平板(PCA 培养基)。同一个稀释度做3 次重复,将制成的PCA 和MRS 琼脂平板分别在37 ℃下恒温培养2 d 和3 d,孟加拉红琼脂平板在28 ℃下培养5 d 后,分别对菌落计数统计[11-12]。
1.4 微生物总DNA 的提取、扩增和测序
采用DNA 提取试剂盒抽提2 种腐乳样品中的基因组DNA(具体操作见试剂盒使用说明书),用1%琼脂糖凝胶电泳进行检测。针对香辣腐乳和白菜腐乳的DNA, 首先利用引物338F (5′-ACTCCTACGGGAGGCAGCAG-3′)和806R (5′-GGACTACHVGGGTWTCTAAT-3′)对 细 菌16S rRNA V3-V4 区进行PCR 扩增, 同时利用引物SSV0817F(5′-TTAGCATGGAATAATRRA ATAGGA-3′)和1196R (5′-TCTGGACCTGGTGAGTT TCC-3′)对真菌18S rRNA V5-V7 区进行PCR 扩增, 对于每个样本,20 μL PCR 反应体系为:4 μL 5×FastPfu Buffer,2 μL 2.5 mmol/L dNTPs,0.4 μL FastPfu 聚合酶,0.2 μL BSA, 模板DNA 10 ng,正、反向引物(5 μmol/L)各0.8 μL,补ddH2O 至20 μL。 每个样本3 个重复,随后将同一样本的PCR产物混合,用2%琼脂糖凝胶电泳检测,利用凝胶回收试剂盒切胶回收PCR 产物。具体PCR 扩增程序如下:①95 ℃预变性3 min;②循环数(细菌27次, 真菌35 次)×(95℃变性30 s,55 ℃退火30 s,72 ℃延伸45 s);③72 ℃延伸10 min。
Illumina Miseq 测序由上海美吉生物医药科技有限公司完成。
1.5 生物信息学分析
1)序列处理与优化 利用Trimmomatic 软件对原始序列修剪和过滤[13],去除含N 碱基的序列,每个序列的最小质量值设置为20。 利用Flash 软件将双端序列拼接成1 条序列, 拼接序列的重叠区允许的最大错配比率为0.2。根据序列首尾两端的barcode 和引物区分样品, 并调整序列方向,barcode 允许的错配数为0,最大引物错配数为2。
2)物种注释 利用Usearch (version 7.0)软件平台, 按照97%的相似性对优化后的序列进行OTU 聚类,在聚类过程中去除嵌合体,得到OTU的代表序列。 基于QIIME 软件平台, 采用RDP classifier 贝叶斯算法对OTU 代表序列分类学分析[14], 分别在各个分类学水平: 门 (phylum),纲(class), 目(order), 科(family), 属(genus), 种(species)统计各样本的群落组成。 对比数据库是Silva(Release128 http://www.arbsilva.de)数 据库,置信度阈值为0.7。
3)多样性指数分析 计算菌群丰度的指数有Chao 指数和Ace 指数;计算菌群多样性的指数有Shannon 指数和Simpson 指数; 测序深度指数为Coverage 指数(http://www.mothur.org/wiki/)。
4)物种分析 对含量在1%以上的OTUs,利用R 语言vegan 包在目水平上制作聚类热图;利用FastTree 软件 (version 2.1.3 http://www.microbe- sonline.org/fasttree/)在属水平上构建系统发育树;利用origin 8.6 软件对计数结果进行分析并制图。
2 结果与分析
2.1 平板培养法测定微生物种类及数量
利用PCA 培养基、MRS 培养基和孟加拉红培养基分别统计2 种腐乳中总菌数(细菌)、乳酸菌数、酵母菌数和霉菌数。 将样品稀释液在80 ℃下水浴10 min 后, 利用PCA 培养基对芽孢杆菌计数。 由图1a 可见,2 种腐乳中的细菌总数、乳酸菌数、芽孢杆菌数均处于同一数量级(107CFU/g),霉菌和酵母菌数目(10~104CFU/g)较少,其中白菜腐乳中酵母菌数目较多(104CFU/g),比香辣腐乳中酵母菌数高2 个数量级, 这说明乳酸菌和芽孢杆菌在2 种腐乳中为优势细菌, 酵母菌在白菜腐乳的真菌中占绝对优势。根据图1b,2 种腐中乳酸菌数和细菌总数接近,芽孢杆菌数(白菜腐乳1.28×107CFU/g;香辣腐乳1.77×107CFU/g)相对少于乳酸菌(白菜腐乳2.51×107CFU/g; 香辣腐乳2.40×107CFU/g),其中以香辣腐乳中芽孢杆菌较多。
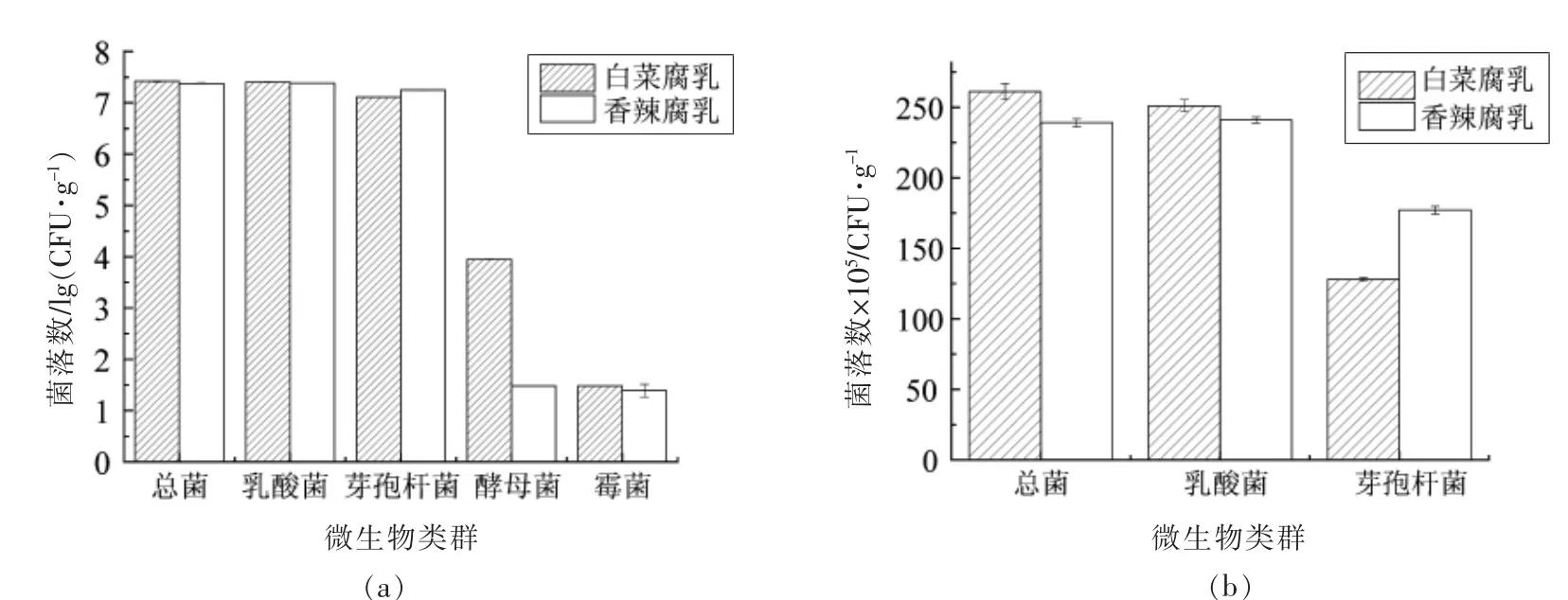
图1 2 种腐乳样本中的微生物种类及数目Fig.1 The taxon and number of microorganism in the two kinds of fermented bean curd samples
2.2 微生物高通量测序结果
通过Illumina Miseq 测序共获得187 204 条序列,其平均读长425 bp,范围为400~450 bp,其中香辣腐乳和白菜腐乳中微生物序列的平均读长分别为426 bp 和424 bp。 对2 种样本的测序结果进行多样性指数分析, 可估计环境群落的物种丰度和多样性,并衡量测序数据的合理性。由表1 可知,Chao 和Ace 指数在同一样本下数值相同,说明物种总数估计结果可靠, 其中香辣腐乳和白菜腐乳细菌OTUs 均为62,真菌OUTs 分别为19 和27。 根据Shannon 和Simpson 指数,可知白菜腐乳中细菌的群落多样性高于香辣腐乳, 而香辣腐乳中真菌的多样性高于白菜腐乳。由此可见,白菜腐乳中真菌OTU 数较高, 而其多样性不及香辣腐乳。 Coverage 指数值在表1 中均达0.9999,说明样本文库覆盖率很高, 本次测序结果可代表样本中细菌和真菌的真实情况。
2.3 两种腐乳样本中微生物组成分布
由表2 可知,厚壁菌门(Firmicutes,75.06%)、变形菌门 (Proteobacteria,10.17%)、 放线菌门(Actinobacteria,7.33%)在白菜腐乳中的含量较高。 厚壁菌门和变形菌门同样也是香辣白菜中的优势细菌门, 其中以厚壁菌门占有绝对优势(90.27%)。 子囊菌门(Ascomycota)是白菜腐乳中绝对优势真菌门,占比高达98.81%,其它门的占比均小于1%。 在香辣腐乳中,子囊菌门的占比也很高(85.57%), 其次是地位未定真菌(Fungi_incertae_sedis,9.8%)。 由此可见,2 种腐乳中的微生物在门分类水平上具有一定的相似性, 其中厚壁菌门为优势细菌门,子囊菌门为优势真菌门。虽然其它类别门组成具有一定差异, 但优势菌门差异不大。
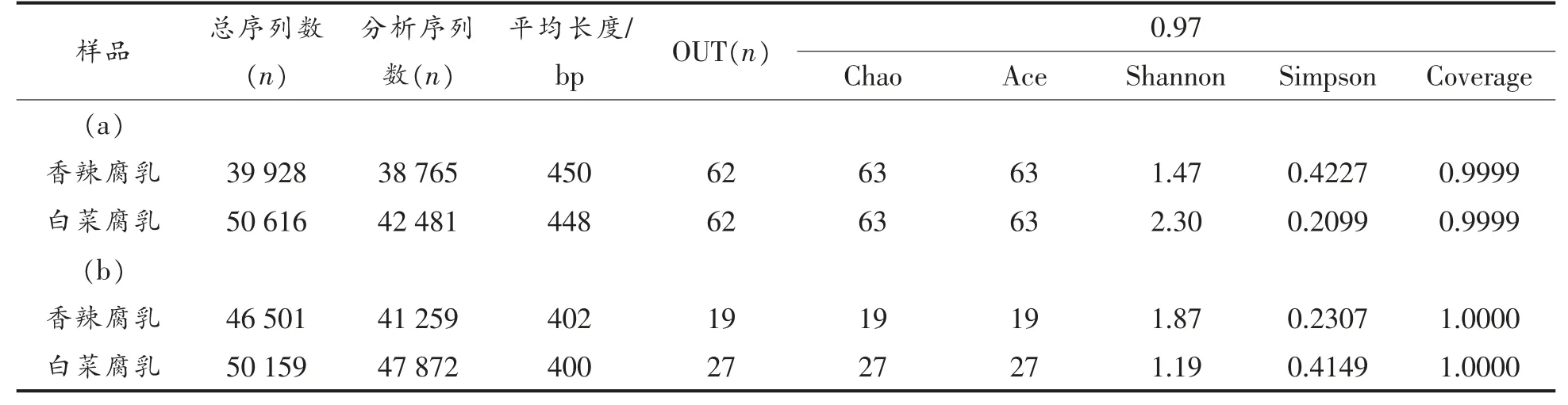
表1 2 种腐乳样本中细菌(a)和真菌(b)高通量测序数据汇总Table 1 Data summary of high-throughput sequencing of bacteria(a)and fungi(b)of two kinds of fermented bean curd samples
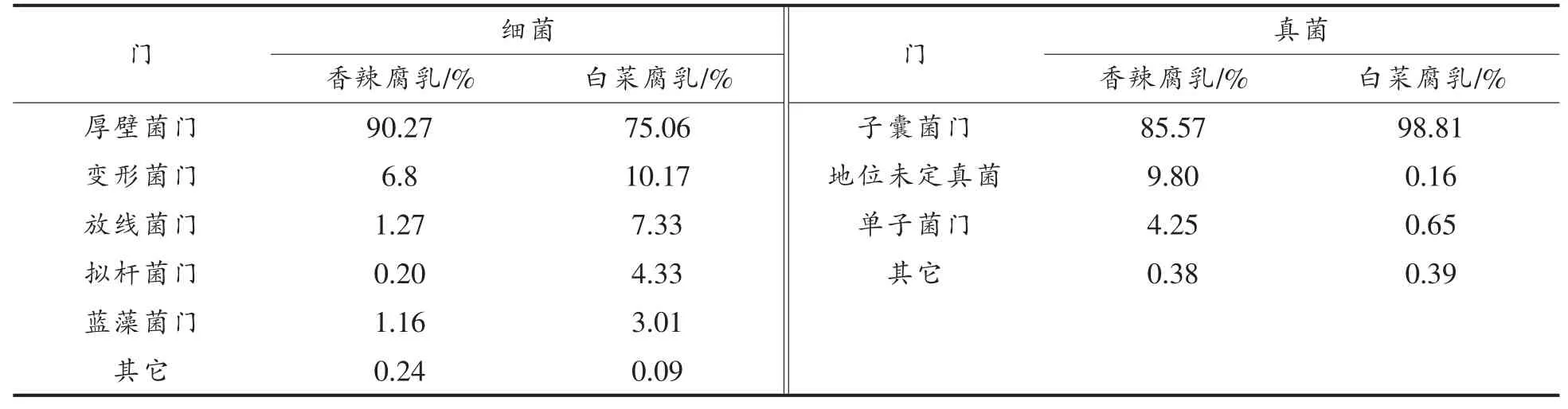
表2 2 种腐乳样本中微生物在门分类水平上的组成Table 2 Composition of microorganism at the level of Phylum of two kinds of fermented bean curd samples
对香辣腐乳和白菜腐乳中的微生物在目水平上进行相似性聚类,得到聚类分析热图。 由图2a可知,2 种腐乳中的优势细菌目均为厚壁菌门下的芽孢杆菌目 (Bacillales)(香辣腐乳64.83%,白菜腐乳41.27%)和乳杆菌目(Lactobacillales)(香辣腐乳25.32%,白菜腐乳33.80%),这2 个目的微生物在其样本中的丰度比具有较大差异(香辣腐乳2.56∶1,白菜腐乳1.22∶1)。此外,一些其它细菌目在2 种样本中的含量也存在较大差异, 其中肠杆菌目 (Enterobacteriales)在香辣腐乳中含量较高,微球菌目(Mcrococcales)、假单胞菌目(Pseudomonadales)和黄杆菌目(Flavobacteriales)在白菜腐乳中含量较高。 由图2b 可知,散囊菌目(Eurotiales,38.82%)在香辣腐乳中含量最高,其次是腔菌目(Pleosporales,21.97%)和肉座菌目(Hypocreales,15.63% ), 在目水平未分类真菌(norank_k__Fungi,9.80%);而在白菜腐乳中,酵母目(Saccharomycetales,86.98%)占有绝对优势,除腔菌目(8.07%)外,其它真菌目占比均小于1%。 此外, 通过聚类分析热图的颜色分布可以清晰地看出,在目水平上,白菜腐乳中细菌群落均匀性要高于香辣腐乳, 而其真菌组成却高度集中在酵母目上。
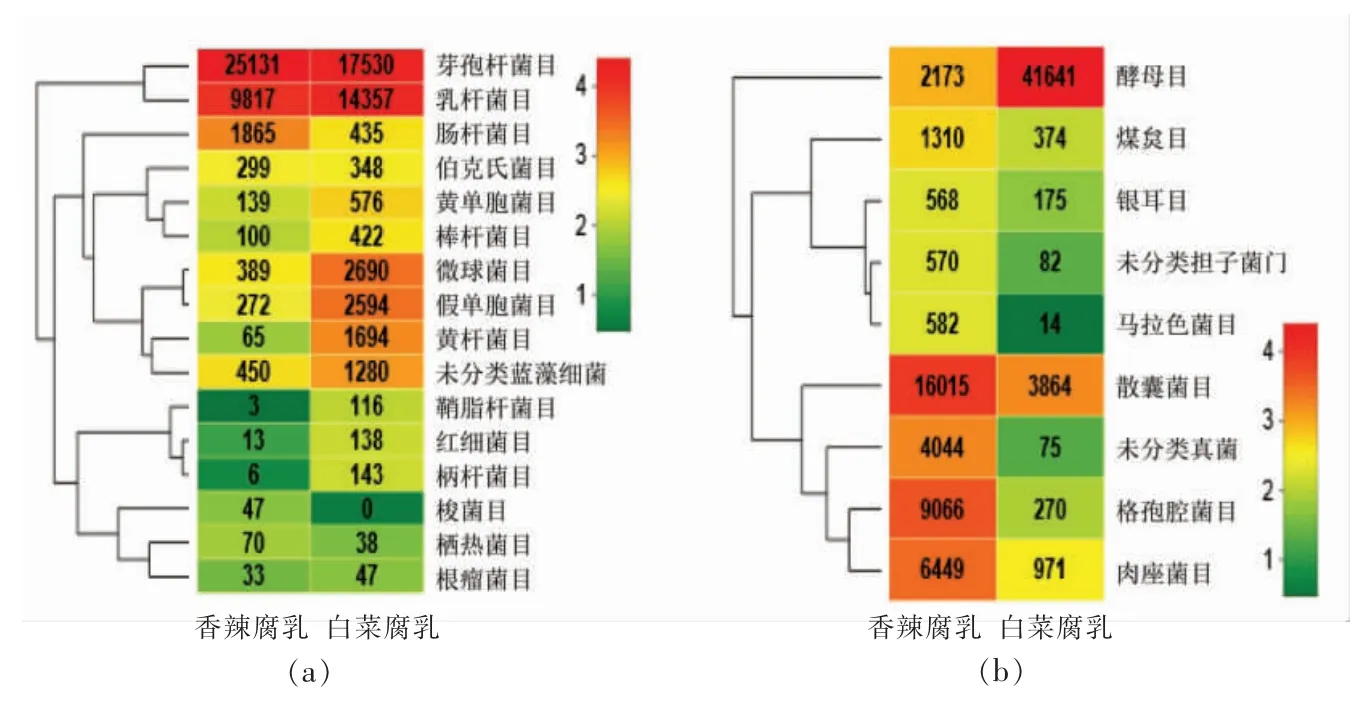
图2 2 种腐乳样本中细菌(a)和真菌(b)OTUs 丰度聚类热图Fig.2 Abundance clustering heat map of OTUs of bacteria(a)and fungi(b)of two kinds of fermented bean curd samples
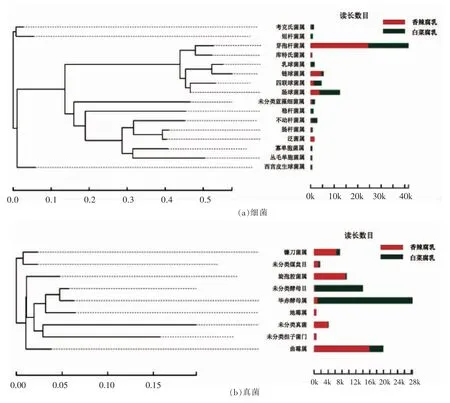
图3 2 种腐乳样本中细菌(a)和真菌(b)属水平系统发育进化树Fig.3 Phylogenetic tree on Genus bar of bacteria (a)and fungi (b)of two kinds of fermented bean curd samples
根据序列间碱基的差异, 在属分类水平上构建系统发育树。 由图3a 可知,2 种腐乳中的优势细菌集中在少数属上, 其中含量最高的是芽孢杆菌属 (Bacillus)(香辣腐乳63.41%, 白菜腐乳40.06%), 其次是乳酸菌 (lactic acid bacteria,LAB)有关属,主要包括肠球菌属、链球菌属、四联球菌属)和乳球菌属,其中链球菌属在香辣腐乳中含量较高(11.81%),肠球菌属(20.07%)、四联球菌属(7.93%)和乳球菌属(3.62%)在白菜腐乳中含量较高。此外,香辣腐乳中泛生菌属(Pantoea)含量远高于白菜腐乳 (3.91%,0.06%), 而不动杆菌属(Acinetobacter)在白菜腐乳中的含量远高于香辣腐乳(5.86%,0.68%),这说明两腐乳样本中的某些非优势细菌存在着较大的差异。 由图3b 可知,曲霉属(Aspergillus)、旋孢腔菌属(Cochliobolus)和镰刀菌属(Fusarium)在香辣腐乳中含量较高,占比分别为38.82%,21.97%,15.63%,在白菜腐乳中的含量却很少,占比分别为8.07%,0.56%,2.03%;毕赤酵母属(Pichia),未分类酵母目(与毕赤酵母属亲缘关系较近)是白菜腐乳中的优势真菌属,占比分别为56.99%和29.16%,在香辣腐乳中含量却非常少,分别为2.54%和1.21%。由此可见,两腐乳样品中优势真菌在属水平上具有很大差异。
3 讨论
检测夹江腐乳中的微生物, 发现2 种腐乳样品中细菌的数目和多样性均远高于真菌, 且优势细菌组成具有一定的相似性, 优势真菌组成差异较大。 芽孢杆菌属和乳酸菌(LAB)有关属为2 种腐乳的优势细菌属, 曲霉菌属和旋孢腔菌属为香辣腐乳中优势真菌属, 酵母菌有关属为白菜腐乳中的优势真菌属。
除了含量较高的优势微生物类群, 高通量测序还鉴定出一些其它微生物,如肠杆菌目、黄杆菌目、假单胞菌目和微球菌目的细菌,毛霉目、煤炱目和银耳目的真菌。 肠杆菌、黄杆菌、假单胞菌和微球菌等被证实会造成食品污染和腐败[15]。 为避免食品质量安全问题, 需关注其含量及比例。 不过,由于夹江腐乳的生产工艺为自然发酵,所以在其中发现一些来自于原材料和环境中的微生物是正常现象。
对2 种腐乳中的微生物计数, 发现乳酸菌的数目高于芽孢杆菌,且与总细菌数接近。测序结果显示芽孢杆菌丰度高于乳酸菌, 乳酸菌在2 种腐乳中的丰度均在50%以下。 分析原因可能是芽孢杆菌生命力强,其中大多数能在基础MRS 培养基上生长,加上芽孢杆菌属内的一些产乳酸成员,如凝结芽孢杆菌(Bacillus coagulans),也应该属于乳酸菌范畴[16]。 由于营养物质和生长条件的限制,许多微生物无法在培养基上生长, 再加上芽孢杆菌与其它可培养细菌的竞争作用, 所以总细菌计数结果要小于样品中实际的细菌数[3]。
另外,在白菜腐乳中占比相对较高(29%)的一个OUT(未分类酵母目),在测序结果中的科属水平上未得到分类, 这说明目前还有一些菌株尚未被测序或注释; 同时由于较短的测序片段和数据库的限制, 一些微生物测序结果只能达到属分类水平[6,17],这说明当前这一技术依然存在短板,有必要与传统培养方法结合来研究微生物多样性。
令人意外的是,虽然白菜腐乳中有“白菜”这一特别的材料, 但是其中乳酸菌并不比芽孢杆菌占优势, 分析原因可能是较高的含盐量抑制了乳酸菌自身繁殖和对白菜的发酵, 不过其中微生物竞争作用的因素也是不可排除的。 尽管如此,2 种腐乳中的乳酸菌组成具有较大的差别, 白菜腐乳中以肠球菌属占优势, 香辣腐乳中以链球菌属占优势,肠球菌属常见于蔬菜类样品,链球菌属常见于蛋白质类样品[15]。 这说明白菜对腐乳中乳酸菌的组成及比例有一定影响。
需要注意的是,在香辣腐乳中,旋孢腔菌属和镰刀菌属在真菌中占比高达21.97%和15.63%。这2 类真菌在自然界中广泛分布,可侵染多种作物[18-19],其中多种真菌可以产生对人、 畜健康有极大威胁的真菌毒素, 如多种镰刀菌可产生脱氧雪腐镰刀烯醇(DON),引起头晕、呕吐、食欲丧失、腹泻以及中枢神经系统紊乱等症状[20]。 然而,旋孢腔菌属和镰刀菌属在白菜腐乳中含量极少, 一方面可能是白菜腐乳中酵母菌数目较多, 拮抗作用抑制了其它真菌的生长[21];另一方面可能是肠球菌属细菌在白菜腐乳中含量较高,产生某种抗菌物质,如细菌素,进而对有害菌起到一定的杀灭作用[22]。
总体来看,夹江腐乳中的微生物是多样的、复杂的, 香辣腐乳和白菜腐乳中的优势细菌均为芽孢杆菌和乳酸菌, 优势真菌分别为曲霉菌和酵母菌。原料的不同会导致微生物组成的较大差异,白菜腐乳中乳酸菌和酵母菌的数目和种类明显高于香辣腐乳。
