植物乳杆菌发酵香菇不同部位风味物质变化研究
2020-09-01陈子琪郜海燕房祥军陈杭君吴伟杰刘瑞玲
陈子琪 郜海燕 房祥军 陈杭君 吴伟杰 刘瑞玲
(浙江省农业科学院食品科学研究所 农业农村部果品产后处理重点实验室 浙江省果蔬保鲜与加工技术研究重点实验室 中国轻工业果蔬保鲜与加工重点实验室 杭州310021)
香菇(Lentinus edodes)属担子菌纲(Basidaiomycetes)、伞 菌 目(Agaricales)、口 蘑 科(Tricholomatacete)、香菇属(Lentinus),又名花蕈、香信、厚菇、花菇等[1]。 香菇起源于我国,是世界第二大菇,也是我国久负盛名的珍贵食用菌,在民间素有“植物皇后”的美誉[2]。 其肉质肥厚细嫩,味道鲜美,香气独特,具有很高的营养、药用和保健价值。 香菇含有大量氨基酸和呈味核苷酸, 使其具有浓郁的香气和鲜味。目前,国内外已有香菇风味物质组成和形成机理的报道[3],然而,利用发酵处理加强香菇风味的研究较少。
发酵是一种传统的食品保存和加工的方式[4]。发酵利用微生物分泌的糖酶和蛋白酶改进食品质构和营养物质组成,并改善食品风味[5]。 植物乳杆菌是发酵食品常用的发酵菌种之一, 其代谢产物相互作用对于食品发酵风味形成具有重要作用[6]。植物乳杆菌可利用碳水化合物产生有机酸, 并将多肽降解为小肽和游离氨基酸, 最终产生各种挥发性和非挥发性成分, 赋予产品独特的风味和口感[7]。任大勇等[8-9]利用植物乳杆菌发酵辣白菜时发现, 植物乳杆菌可增加还原糖代谢并促进非还原糖向还原糖转化, 同时增加非挥发性酸的含量和挥发性酸的种类, 大大改善泡菜的风味, 这与Wang 等[10]的研究一致。 刘宗敏等[11]发现植物乳杆菌可缩短萝卜干的发酵周期并增加游离氨基酸和挥发酯的含量。 有研究报道植物乳杆菌在发酵果蔬汁[12-13]、发酵肉制品[14-15]以及调味品[16]中的应用。而目前使用植物乳杆菌发酵香菇的研究较少。 本课题组筛选香菇发酵菌种, 发现植物乳杆菌发酵所得发酵液的风味最佳。在前期工作的基础上,优化植物乳杆菌发酵香菇盖和香菇柄的工艺条件,为香菇发酵产品的开发利用提供理论依据。
1 材料与方法
1.1 材料与试剂
植物乳杆菌 (Lactobacillus plantarum,GDM1.191),由广东省微生物菌种保藏中心提供。
香菇品种为“L808”,采自浙江省磐安县盛源食用菌基地。
甘氨酸,北京鼎国昌盛生物技术有限公司;茚三酮,生工生物工程(上海)股份有限公司;磷酸氢二钠、磷酸二氢钾,上海凌峰化学试剂有限公司;盐酸,上海凌峰化学试剂有限公司
1.2 设备与仪器
DHG-9079A 型电热恒温鼓风干燥箱,上海精宏实验设备有限公司;Thermo Biofuge startos 型冷冻离心机,美国Thermo 公司;UNICO UV-2802型紫外分光光度计,尤尼柯(上海)仪器公司。
1.3 试验方法
1.3.1 材料预处理 产地预冷后当天运回实验室。 于5 ℃冷库预冷12 h,选取无机械损伤、外形正常的香菇作为试验材料。 将香菇盖和香菇柄分别于65 ℃烘干,粉碎、密封保存。
1.3.2 pH 值测定 按照GB 5009.237-2016 《食品pH 值的测定》测定香菇发酵液的pH 值[17]。
1.3.3 风味物质提取方法 香菇发酵液的上清液于70 ℃水浴加热2 h,冷却至室温,备用。
1.3.4 游离氨基酸测定 采用茚三酮比色法[18-20]测定香菇发酵液中游离氨基酸含量。 分别量取香菇盖和香菇柄发酵液上清液1.0 mL, 加蒸馏水补充至5 mL。 加入茚三酮显色剂0.5 mL,磷酸缓冲液1 mL,混合均匀,100 ℃水浴加热15 min 后冷却至室温,加水定容25 mL,摇匀。 在波长570 nm 处以蒸馏水为对照测定吸光度值。
1.3.5 呈味核苷酸测定 采用滋味分光光度法[21-22]测定。 分别量取香菇盖和香菇柄发酵液上清液0.5 mL,用0.01 mol/L 盐酸溶液定容25 mL,摇匀后在波长260 nm 处,以0.01 mol/L 盐酸为参比溶液,用紫外分光光度计测定吸光值。
1.3.6 风味物质评价 等鲜浓度 (Equivalent Umami Concentration,EUC)表示鲜味氨基酸与呈味核苷酸混合物协同作用所产生的鲜味强度相当于多少质量浓度的单一味精所产生的鲜味强度[23-24]。EUC 根据式(1)计算:
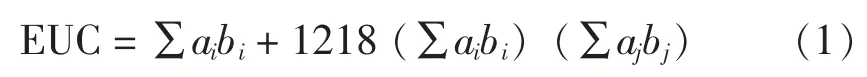
式中, ai和aj——鲜味氨基酸和鲜味核苷酸的质量浓度(g/100 g);bi和bj——鲜味氨基酸和鲜味核苷酸的呈鲜系数 (Glu 1,Asp 0.077,IMP 1,GMP 2.3,AMP 0.18)。
1.3.7 不同因素对香菇盖和香菇柄发酵的影响选取发酵时间(1,2,3,4 d)、接种量(2%,4%,6%,8%)、粉末量(0.5,1.0,1.5,2.0 g)和发酵温度(25,30,35,40 ℃)进行单因素试验,采用1.3.2 至1.3.6节所述方法测定风味物质,以等鲜浓度(EUC)为指标评价发酵效果,每组重复3 次。
1.3.8 最佳提取工艺的确定 通过单因素试验,采用经典的Box-Behnken Design(BBD),选取发酵时间(A)、菌液接种量(B)、粉末添加量(C)和发酵温度(D)4 个因素作为优化条件的对象。 以-1,0,+1 代表变量水平,试验因素和水平见表1。通过中心组合设计,以等鲜浓度(EUC)为响应值,重复3 次。
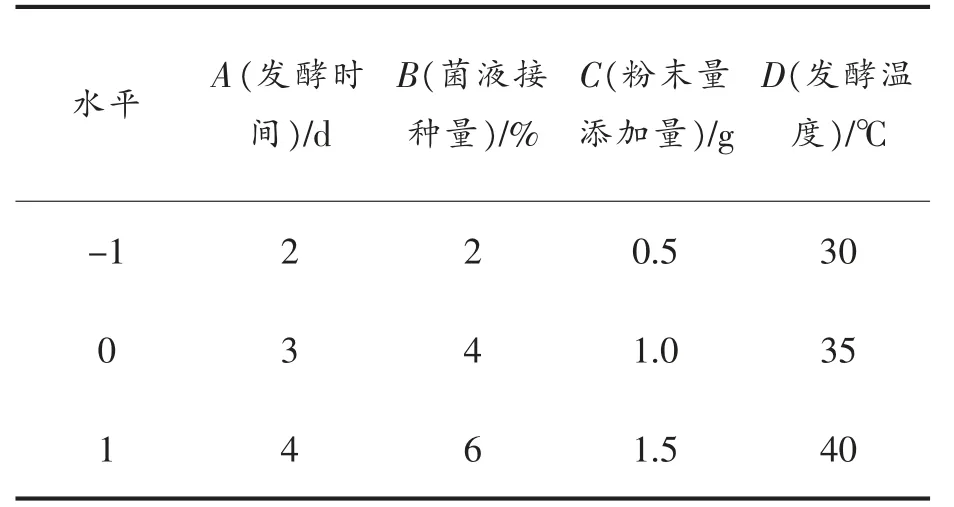
表1 响应面试验设计因素水平表Table 1 Factors and levels of response surface test design
1.4 数据统计与分析
单因素试验结果采用SPSS 22 软件分析处理, 响应面试验结果采用Design-Expert 8.0.6 软件设计分析。
2 结果与分析
2.1 发酵时间对香菇盖和香菇柄发酵的影响
发酵时间是影响发酵效果的重要参数。 发酵时间过短, 菌体生长和代谢不充足, 使得产酶不足,发酵不充分[25]。 发酵时间过长,菌体生长所需的营养物质消耗过多,并且发酵液染菌机率增加,从而影响工艺进程[26]。 发酵时间对香菇盖和香菇柄发酵的影响见表2~3。 随着发酵时间延长,香菇盖发酵液pH 值明显下降, 游离氨基酸和呈味核苷酸含量呈上升趋势, 发酵第3 天风味物质评价达到最高点。 香菇柄pH 值在发酵第3 天趋于稳定,游离氨基酸和呈味核苷酸含量呈上升趋势,并且EUC 值在第3 天达到最高点,说明发酵第3 天是香菇盖和香菇柄的最佳发酵时间。
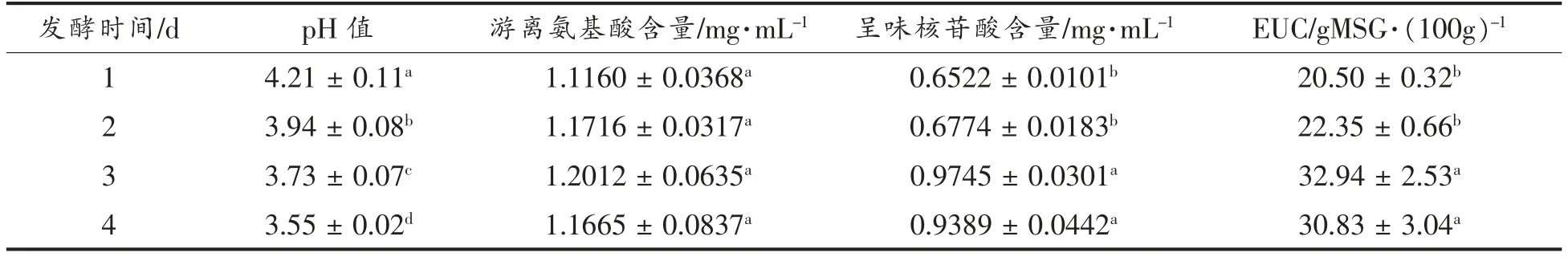
表2 发酵时间对香菇盖发酵的影响Table 2 Effects of fermentation times on fermentation results of Lentinus edodes pileus

表3 发酵时间对香菇柄发酵的影响Table 3 Effects of fermentation times on fermentation results of Lentinus edodes stipe
2.2 菌液接种量对香菇盖和香菇柄发酵的影响
菌液接种量是影响发酵效果的重要因素之一[27]。 提高接种量,能促进菌种生长繁殖及代谢物生成,从而影响发酵液的发酵进程[28]。 接种量过低,菌种生长迟缓,不利于酶及产物的生成;接种量过高,菌体繁殖过快,发酵底物的营养物质消耗过快,并且代谢产物会影响酶的合成[29]与大分子蛋白质的降解[30]。 菌液接种量对发酵的影响见表4~5。随着接种量增加,香菇盖和香菇柄发酵液pH值均有明显下降。 当接种量为4%时,香菇盖的呈味核苷酸含量显著高于其它3 组(P<0.05),香菇柄的游离氨基酸含量显著高于其它3 组(P<0.05)。通过比较EUC 值,当菌液接种量为4%时,香菇盖和香菇柄的发酵均达到最优。
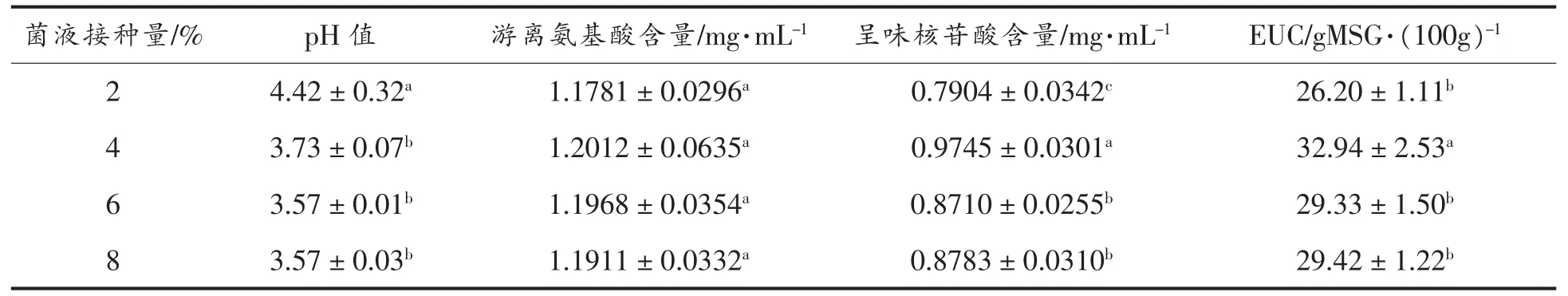
表4 菌液接种量对香菇柄发酵的影响Table 4 Effects of inoculation amount on fermentation results of Lentinus edodes pileus
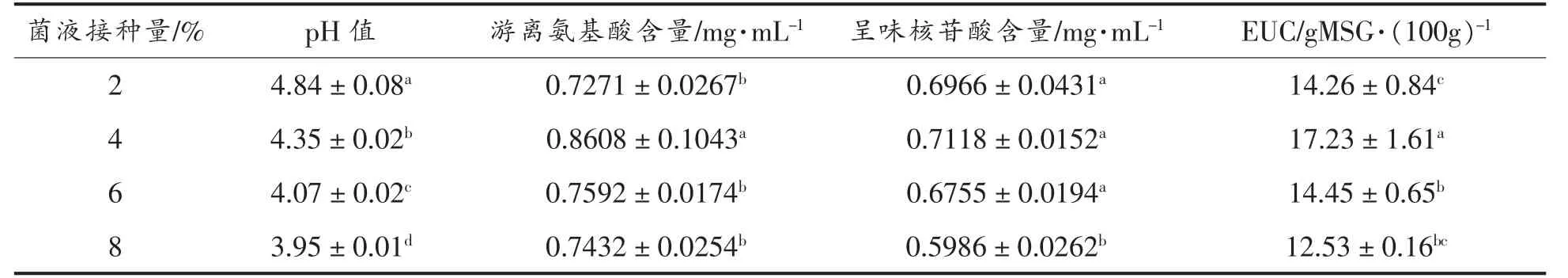
表5 菌液接种量对香菇柄发酵的影响Table 5 Effects of inoculation amount on fermentation results of Lentinus edodes stipe
2.3 粉末添加量对香菇盖和香菇柄发酵效果的影响
粉末添加量决定发酵底物中营养物质的含量[31], 直接影响菌体在发酵液中生长代谢进程[32]。粉末添加量越高,发酵液中发酵底物越多,菌体生长繁殖的营养物质越多。 粉末添加量对发酵结果的影响见表6 和表7。 随着粉末添加量的提高,发酵底物浓度增加, 香菇盖和香菇柄发酵液中游离氨基酸和呈味核苷酸的含量显著升高, 导致最终的风味物质评价(EUC 值)显著提高。据文献[37]报道,EUC 可分为4 个水平: 第1 水平为EUC>1 000 g MSG/100 g, 第2 水平为 (100~1 000)g MSG/100 g, 第3 水平为(10~100)g MSG/100 g,第4 水平为EUC<10 gMSG/100 g。 由表6~7 可知,粉末添加量为1.0 g 时,香菇盖和香菇柄发酵液的发酵效果最佳。
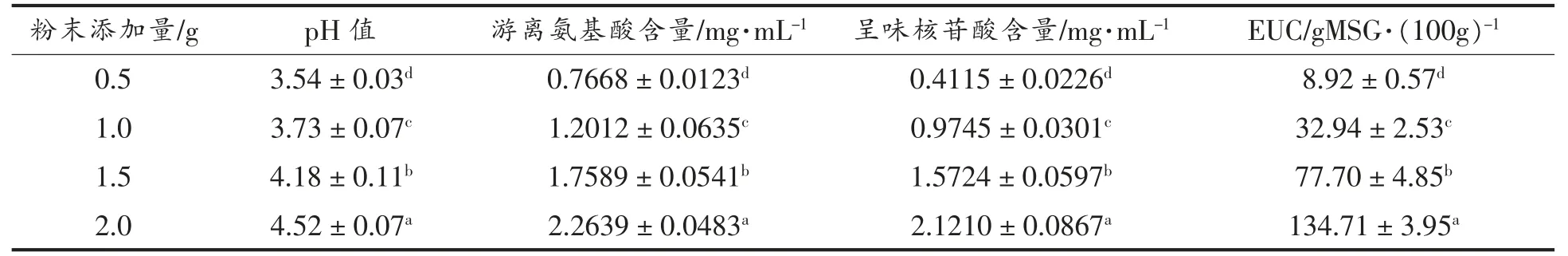
表6 粉末添加量对香菇盖发酵的影响Table 6 Effects of powder amount on fermentation results of Lentinus edodes pileus

表7 粉末添加量对香菇柄发酵的影响Table 7 Effects of powder amount on fermentation results of Lentinus edodes stipe
2.4 发酵温度对香菇盖和香菇柄发酵的影响
发酵温度也是影响发酵效果的重要因素之一[27,33]。 每种菌都有其最适生长温度,而最适生长温度不一定是最佳发酵温度[34-35]。发酵时只有选择合适的温度,才能达到较好的效果[36]。 发酵温度对发酵结果的影响见表8 和表9。 随着发酵温度升高,香菇盖和香菇柄的pH 值上升。 发酵温度对香菇盖发酵液游离氨基酸的含量没有显著影响(P>0.05),呈味核苷酸含量虽有明显上升,但30,35,40 ℃时含量无显著性差异(P>0.05),最终导致发酵温度30 ℃时EUC 值最佳。 发酵温度对香菇柄发酵液风味物质含量的影响主要在游离氨基酸含量方面。 由表9 可知,EUC 值变化无显著性差异,30 ℃时EUC 值最高,说明最佳发酵温度30 ℃。
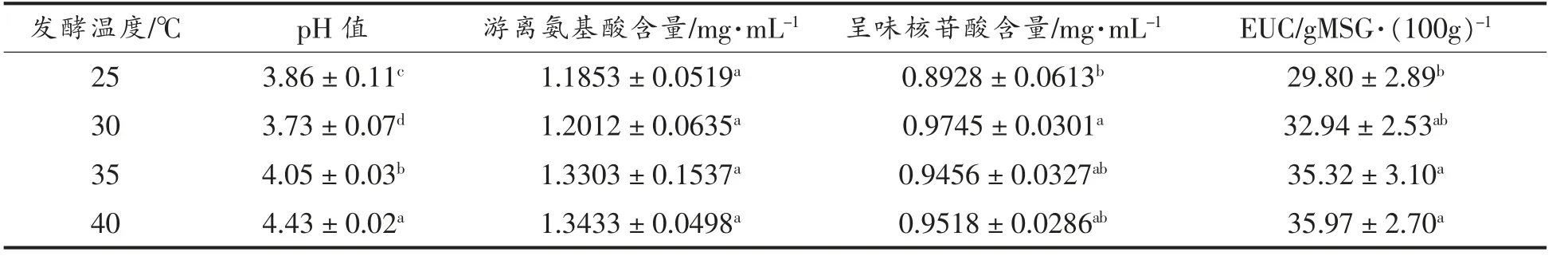
表8 发酵温度对香菇盖发酵的影响Table 8 Effects of fermentation temperature on fermentation results of Lentinus edodes pileus
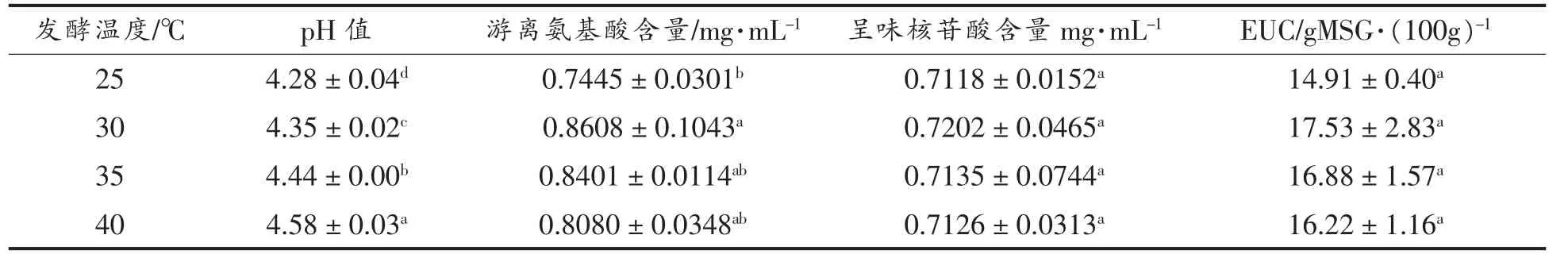
表9 发酵温度对香菇柄发酵的影响Table 9 Effects of fermentation temperature on fermentation results of Lentinus edodes stipe
2.5 响应面优化试验
2.5.1 响应面设计方案与试验结果 采用Design-Expert 8.0.6 软件, 在单因素试验基础上,以EUC 值为指标, 做4 因素3 水平的响应面优化试验。 共计29 组,设计方案及结果见表10。
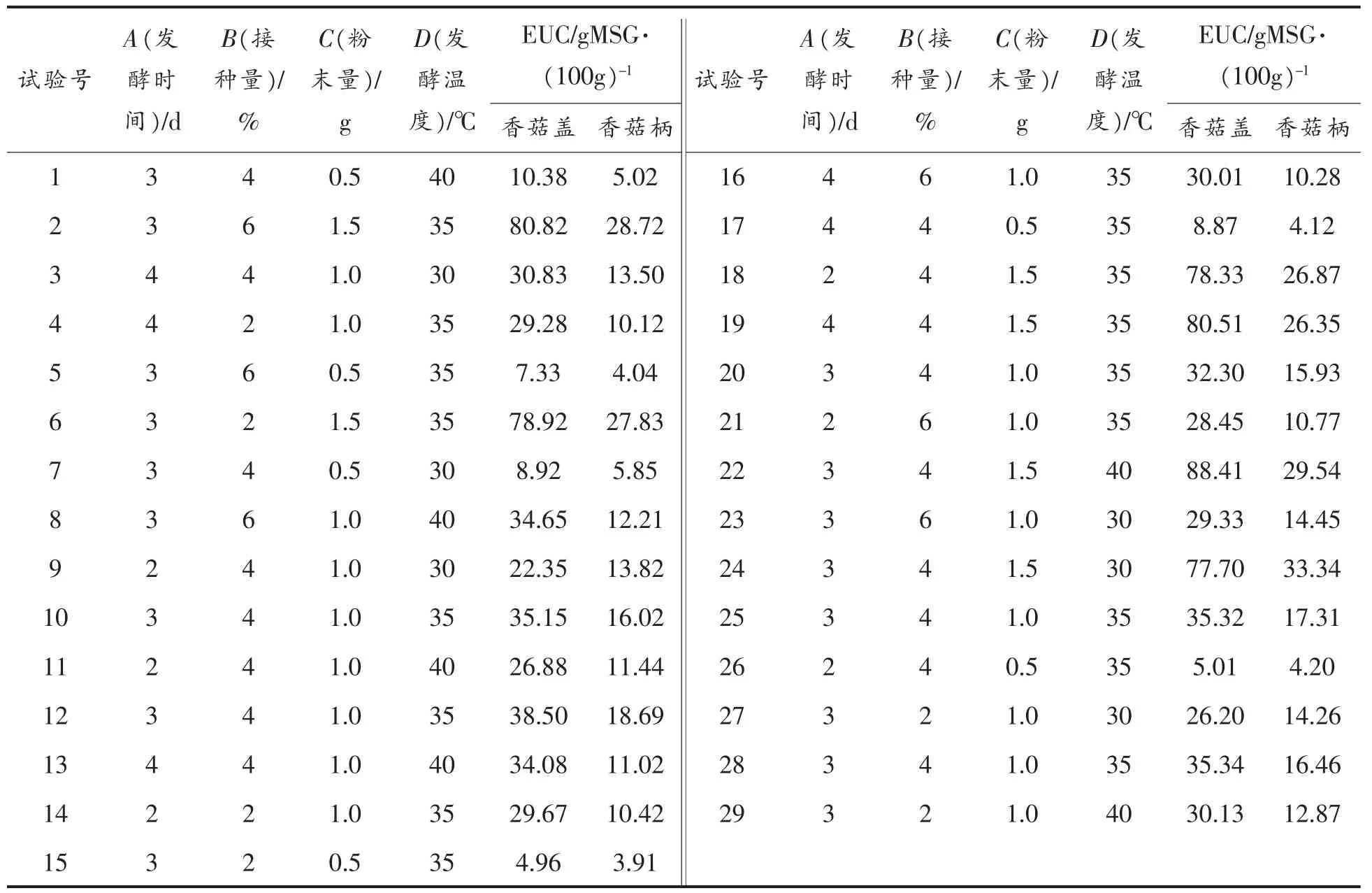
表10 响应面试验设计与结果Table 10 Experimental design and results by response surface test
2.5.2 模型方程的建立及显著性分析 运用Design-Expert 8.0.6 软件对表10 中试验数据进行回归分析,得出发酵时间(A)、接种量(B)、粉末量(C)和发酵温度(D)与香菇盖(Y1)和香菇柄(Y2)的EUC 值,拟合得到回归方程(2)和(3):
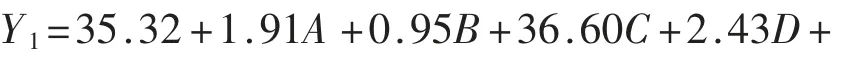

方差分析见表11~12, 两个模型的P 值均小于0.01,极显著;失拟项P 值均大于0.05,不显著,说明模型拟合良好,试验误差小,结果切合实际。模型的回归系数R2香菇盖=0.9957,R2香菇柄= 0.9939,说明此方程试验拟合度较好,误差小;R2adj(香菇盖)=0.9914,R2adj(香菇柄)=0.9877, 说明该模型能解释99.14%和98.77%的响应值变化,能很好预测植物乳杆菌发酵香菇盖和香菇柄的工艺参数。
香菇盖发酵液模型中回归系数的显著性检验显示,一次项A 对EUC 的影响显著(P<0.05),一次项C,D,二次项A2,B2,C2对EUC 的影响极显著(P<0.01)。 香菇柄发酵液模型中回归系数的显著性检验显示, 一次项C,D, 二次项A2,B2,C2对EUC 的影响极显著(P<0.01)。比较A,B,C,D 4 个因素的可知,影响香菇盖发酵液EUC 值因素的主次顺序为: 粉末量>发酵温度>发酵时间>接种量;影响香菇柄发酵液EUC 值因素的主次顺序为:粉末量>发酵温度>发酵时间>接种量。
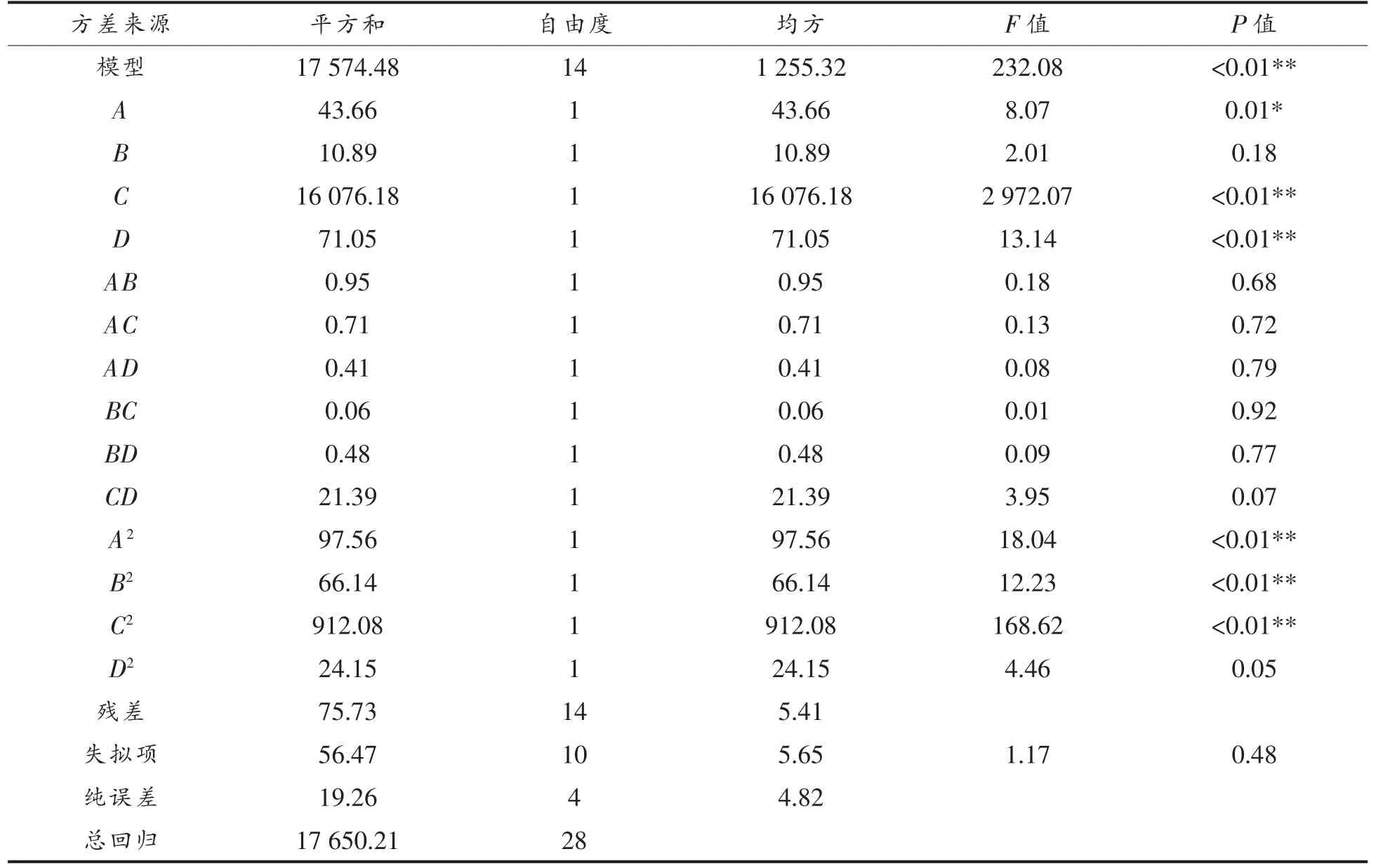
表11 香菇盖发酵液EUC 值回归模型的方差分析Table 11 Variance analysis of regression model for the EUC value of Lentinus edodes pileus
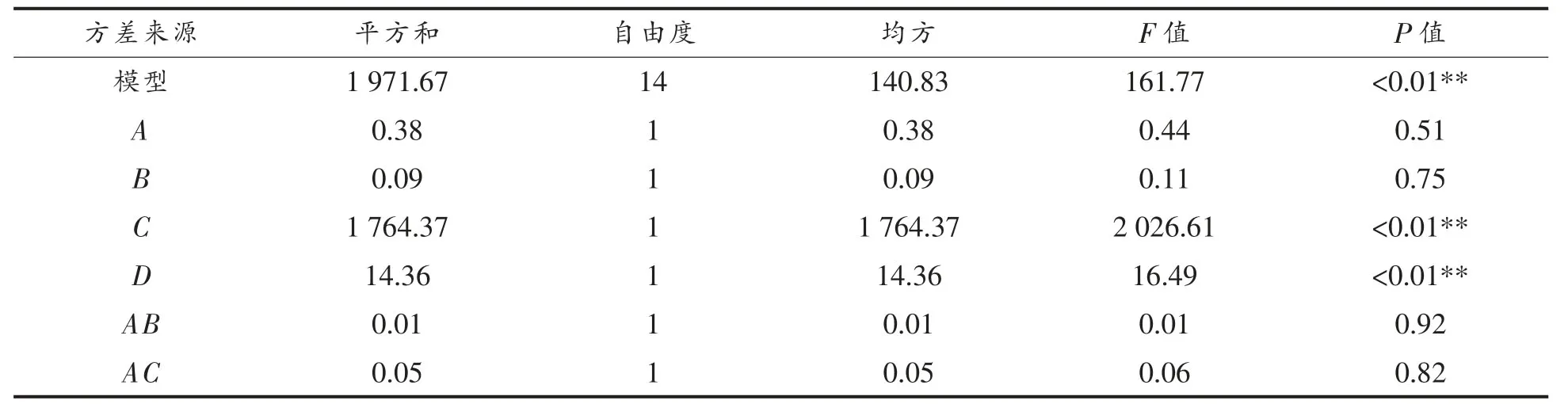
表12 香菇柄发酵液EUC 值回归模型的方差分析Table 12 Variance analysis of regression model for the EUC value of Lentinus edodes stipe
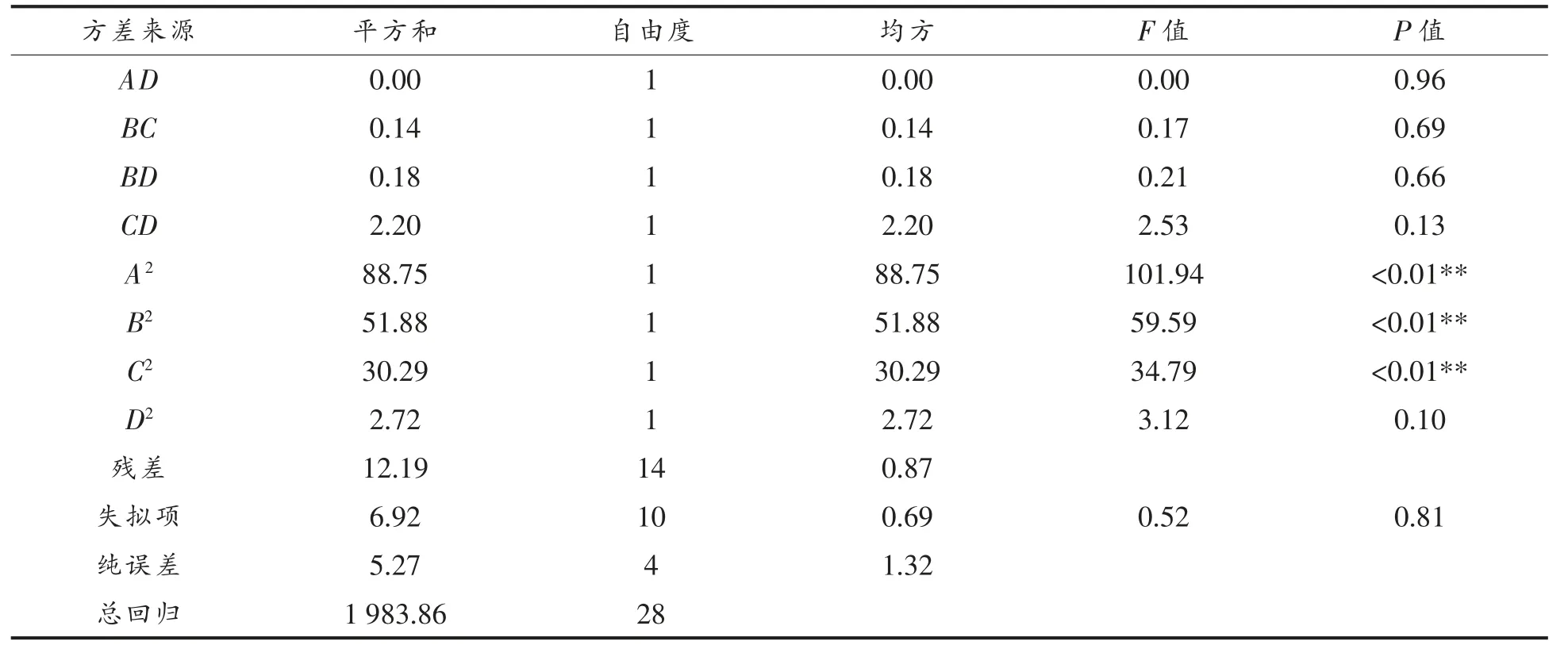
(续表12)
2.5.3 响应面优化分析 等高线为椭圆形表示2个因素交互作用显著,圆形则与之相反。响应曲线直观反映各因素的响应值。 图1,2 分别为香菇盖发酵液和香菇柄发酵液的各因素与EUC 值的交互作用。通过回归方程求解,得出植物乳杆菌发酵香菇盖的最优工艺条件为发酵时间4.00 d, 接种量4.38%,粉末量1.5 g,发酵温度40 ℃。 植物乳杆菌发酵香菇柄的最优工艺条件为发酵时间2.96 d,接种量4.18%,粉末量1.5 g,发酵温度30 ℃。 考虑实际生产情况,对该工艺进行修正,得到:香菇盖的工艺条件为发酵时间4 d,接种量4.5%,粉末量1.5 g,发酵温度40 ℃;香菇柄的工艺条件为发酵时间3 d,接种量4.2%,粉末量1.5 g,发酵温度30 ℃。 在此修正条件下香菇盖和香菇柄的理论EUC 值分别为84.09 gMSG/100 g 和32.38 gMSG/100 g,实际测得的EUC 值为84.61 gMSG/100 g 和32.02 gMSG/100 g,与预测值基本吻合,说明采用响应面法得到的工艺参数可靠, 具有一定的应用价值。
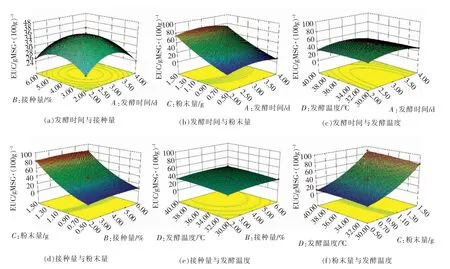
图1 各因素交互作用的香菇盖发酵液EUC 值响应面图Fig.1 Response surface diagram of interaction for various factors on the EUC value of fermentation of Lentinus edodes pileus
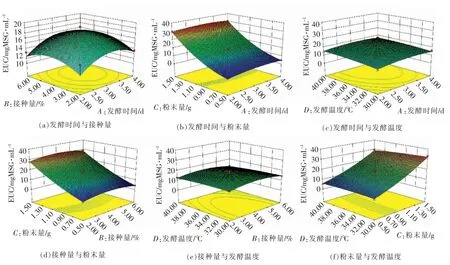
图2 各因素交互作用的香菇柄发酵液EUC 值响应面图Fig.2 Response surface diagram of interaction for various factors on the EUC value of fermentation of Lentinus edodes stipe
3 讨论
本试验中利用植物乳杆菌发酵处理香菇不同部位,提升了香菇风味物质含量,明显改善了香菇的风味。
研究了不同发酵条件对香菇风味的影响,结果表明:最佳发酵时间3 d,最佳菌液接种量4%,最佳粉末添加量1.0 g,最佳发酵温度30 ℃。 发酵时间过短或过长都会影响菌体发酵液中营养物质的转化。香菇发酵液在发酵第3 天风味最佳,可能是因为植物乳杆菌生长代谢最为旺盛。 菌液接种量为4%,能提高酶和代谢产物的产率,且不会影响相关酶的合成和大分子蛋白的降解。 粉末量决定菌体生长代谢所消耗营养物质的量。 考虑到EUC 值水平范围和实际应用,选择1.5 g 为最佳粉末量。 本试验中,最佳发酵温度为30 ℃,在此温度下既能促进植物乳杆菌的生长繁殖, 又促进其风味物质的生成。 在单因素试验的基础上, 采用Box-Behnken 设计4 因素3 水平中心组合试验,分别得到植物乳杆菌发酵香菇盖和香菇柄的最优工艺条件。 验证试验采用该工艺条件, 所得EUC实际值与预测值基本吻合,且比优化前提高76.38%和86.23%,表明该工艺条件是植物乳杆菌发酵香菇盖和香菇柄最佳工艺条件, 对植物乳杆菌发酵香菇的风味具有提升作用。
4 结论
本试验优化了植物乳杆菌发酵香菇的工艺条件,并结合实际生产情况,得到植物乳杆菌发酵香菇盖的最优工艺条件为:发酵时间4 d,接种量4.5%,粉末量1.5 g,发酵温度40 ℃;植物乳杆菌发酵香菇柄的最优工艺条件为: 发酵时间3 d,接种量4.2%,粉末量1.5 g,发酵温度30 ℃。
