新型鲶鱼体表黏液抗菌肽抑菌活性验证及抑菌机理
2020-09-01刘权伟李婷婷励建荣
刘权伟 李婷婷 励建荣*
(1 渤海大学食品科学与工程学院 生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心辽宁省食品安全重点实验室 辽宁省高等学校生鲜食品产业技术研究院 辽宁锦州121013 2 大连民族大学生命科学学院 辽宁大连116600)
抗菌肽(Antimicrobial peptides)是先天免疫系统中至关重要的一部分, 它是生物体为抵抗病原微生物入侵,从而形成具有抗菌作用的短肽[1-2]。瑞典科学家Steiner 等[3]早在1981年就从罗宾蛾(Hyalophoracecropia)中得到具有杀菌活性的短肽Cecropin。 之后,人们陆续从各种生物体中分离出具有抑菌效果的短肽[4]。由于抗菌肽引起细胞死亡的机制不是与细胞膜上的特定受体结合, 而是与膜磷脂的非特异性相互作用[5],所以抗菌肽产生耐药性的几率较小[6-7]。 同时,抗菌肽还具有抗菌谱广,杀菌活力强等特点,被认为是能够替代抗生素的首选药物,具有良好的应用前景[8]。 人们通过对已有抗菌肽的探索, 发现大多数天然抗菌肽具有两个相同的特征,首先基本是阳离子类型,其次,它主要是一种对水和脂类都有亲和力的两亲结构[9]。 经过大量研究,虽然抗菌肽的杀菌机理尚未明确, 但大多数抗菌肽被认为作用于细菌细胞膜上,发挥抑菌作用[10]。 另外,抗菌性与抗菌肽肽链形成的二级结构以及抗菌肽的生物学特性等方面也有关系。 例如含α-螺旋的抗菌肽通常会穿透细菌细胞膜的磷脂双分子层,导致跨膜电位消散,最终杀死细菌[11]。
鲶鱼(Clarias fuscus)属于鱼纲鲶形目鲶科,多数生活在海水的中、下部,适应生存环境能力较强。 与其它类型的鱼相比,当周围环境恶劣时,鲶鱼的体表黏液和内脏会应激形成一些抗菌活性物质, 尤其是在受伤之后这种活性物质的产量显著增多[12]。 表皮分泌的黏液是鱼类天然免疫的重要部分[13-14],它主要通过表皮杯状或黏液细胞产生的大分子蛋白发挥作用[15-16]。 早在1988年,Austin 等[17]初次报道了虹鳟鱼表皮黏液对传染性病原体有显著的抑制作用, 激发了研究人员对鱼类表皮黏液的研究热情。 Park 等[18]发现鲶鱼受伤后能够分泌抗菌肽,Su 等[19]在黄鲶鱼体表黏液中也分离到抗菌肽。 本实验室研究人员前期[20]从鲶鱼体表黏液粗提物中共分离获得4 个抗菌肽氨基酸片段,即:片段1:RLKEKNKA;片段2:RIVELTLPRVSVRL;片段3:KQEIILKF;片段4:RQIKIXRR。 使用这4个氨基酸片段, 通过固相合成法合成相对应的抗菌肽冻干粉。 试验发现,4 个氨基酸片段中,由片段2 氨基酸序列合成的抗菌肽抑菌效果最为显著,具有继续研究的价值。
本文以此段合成抗菌肽为研究对象, 以腐败希瓦氏菌和大肠杆菌为检测菌株, 验证了该新型鱼源抗菌肽的抗菌活性, 并对其抑菌机理进行研究。
1 材料与方法
1.1 材料与试剂
腐败希瓦氏菌、大肠杆菌,渤海大学食品安全实验室保存;抗菌肽(RIVELTLPRVSVRL,纯度97.775%),合成于上海生物工程公司;营养肉汤、平板计数培养基、LB 营养琼脂, 青岛海博生物技术有限公司;GENMED 正苯基萘胺摄入法细菌膜损伤荧光检测试剂盒, 上海杰美基因医药科技有限公司。
1.2 主要仪器、设备
PE Victor X3 多功能酶标仪, 美国铂金埃尔默仪器;970CRT 荧光分光光度计,上海精密科学仪器有限公司;E-1045 镀金仪,日本日立公司;S-4800 扫描电镜,日本日立公司;SW-CJ-2FD 超净工作台,苏景集团苏州安泰技术有限公司;Biofuge stratus 台式高速离心机, 美国Thermo Fisher 公司。
1.3 试验方法
1.3.1 理化特性预测 通过抗菌肽数据库APD(http://aps.unmc.edu/AP/main.php)预测抗菌肽的理化特性。 进入官网后点击“CalcuLation & Prediction”, 输入氨基酸序列进行预测。 使 用HeliQuest 软件(http://heliquest.ipmc.cnrs.fr/)对抗菌肽序列进行螺旋轮作图分析。
1.3.2 抗菌肽抗菌活性试验 采用琼脂平板扩散法测定其抑菌效果[21]。
1.3.2.1 抑菌活性验证试验 采用牛津杯法[22]。将灭过菌的牛津杯置于无菌平板上, 并将15 mL 含测试菌的琼脂培养基 (培养基中含菌量约为106CFU/mL)倒入每个平板中,待培养基凝固后取出牛津杯, 向每个孔中分别加入体积为100 μL,质量分数为1.0%的抗菌肽溶液。 最后将平板置于37°C 的恒温培养箱孵育,24 h 后观察并测量抑菌圈的直径。 测量3 次,取平均值。
1.3.2.2 抑菌活性稳定性 将1.3.2.1 步骤中的平板置于37°C 恒温培养箱中,观察7 d 内抑菌圈的变化情况。
1.3.2.3 最小抑菌浓度(MIC)测定 采用微量稀释法测定[23]。 将培养至指数期的细菌生长液按照50 μL/孔的用量添至96 孔细胞培养板中,并将50 μL 经二倍稀释的抗菌肽添至每个孔,使各孔中抗菌肽的终质量分数分别为0.500%,0.250%,0.125%,0.063%,0.032%,0.016%。 使用50 μg/mL氨苄青霉素作为阳性对照, 将等体积的无菌去离子水作阴性对照。 将培养板置于37 ℃孵育10 h,用酶标仪测定OD595值。 通过比较测量值,选择与阳性对照没有明显差异的最低浓度作为抗菌肽针对细菌的最小抑菌浓度。 独立测定3 次, 取平均值。
1.3.3 细菌生长曲线 将100 μL 活化的腐败希瓦氏菌和大肠杆菌接种于LB 肉汤培养基中,培养至含量为106CFU/mL。 按照2%的接种量,分别将腐败希瓦氏菌、大肠杆菌接种至新的营养肉汤。分别取2 mg 抗菌肽加入适量测定组菌液中 (60 μL的50%二甲基亚砜中助溶),使最终抗菌肽质量为0.5%。空白组加入等量同浓度的二甲基亚砜,摇床培养(37°C,160 r/min),每隔2 h 测定1 次其在波长595 nm 处的吸光值。 横坐标为培养时间,纵坐标为OD595测量值,绘制细菌生长曲线。
1.3.4 扫描电镜观察 取适量腐败希瓦氏菌和大肠杆菌过夜培养至对数期, 加入抗菌肽使其终质量分数为0.5%,于37°C 继续培养12 h。将培养完成的细菌悬浮液置于离心管中, 以4 000 r/min 离心10 min。随后,先将离心的沉淀部分用无菌水洗涤,再将其置于2.5%戊二醛磷酸缓冲液中固定12 h,用无菌水洗涤3 次,每次10 min。 洗涤后,将细菌沉淀悬浮在无菌水中, 取适量滴在干净的盖玻片上,冷冻干燥处理12 h。通过电镜扫描观察腐败希瓦氏菌和大肠杆菌的形态、结构变化。
1.3.5 细菌外膜通透性的测定 根据GENMED正苯基萘胺摄入法, 研究鲶鱼体表黏液抗菌肽对细菌外膜通透性的影响。 参考细菌膜损伤荧光检测试剂盒说明书,步骤如下:
1)移取1 mL 新鲜菌液(OD600= 0.5)到新的1.5 mL 离心管;
2)放入微型台式离心机离心,转速13 000 r/min,离心时长1 min,小心抽去上清液;
3)加 入1 mL GENMED 缓冲液(Reagent A),充分混匀;
4)将其置于13 000 r/min 的微型离心机,离心1 min,小心取出上清液;
5)重复步骤3)~4)1 次;
6)加入1 mL GENMED 缓冲液(Reagent A),充分混匀;
7)抽取150 μL 菌液加入96 孔板中;
8)加入45 μL 0.5%抗菌肽和5 μL GENMED 染色液(Regent B)混匀,放入25 °C 培养箱培养5 min;
9)快速放入荧光分光光度计测定荧光单位(设置激发波长355 nm,散发波长460 nm);
10)比较不同样品细菌的膜损伤程度。
采用970CRT 荧光分光光度计测定, 将其参数设置为:灵敏度3,扫描速度为高速,EX 缝宽10 nm,EM 缝宽10 nm。
1.3.6 抗菌肽的圆二色谱测定 将抗菌肽溶解于模拟细胞膜疏水环境的PB 缓冲液和2.5%SDS 缓冲液中, 制成一定浓度的抗菌肽溶液。 于室温测定,石英样品池的光程为0.1 cm,带宽1.0 nm,分辨率0.5 nm, 扫描测定波长范围190~250 nm,扫描速度50 nm/min。圆二色性通过平均残基摩尔椭圆率来表示。
2 结果与分析
2.1 理化属性分析

表1 抗菌肽属性预测Table 1 Prediction of the properties of antimicrobial peptides
物性预测显示: 该抗菌肽氨基酸数为14,疏水率50%,净电荷2 z,相对分子质量1 651.034,分子式为C74H135N23O19S0, 蛋白结合势为1.83 kcal/mol。 如图预测显示该序列多肽可以形成α 螺旋,在同一疏水表面的氨基酸残基不少于2 个。 综合理化性质预测表明所合成的多肽具有与细胞膜相互作用的潜力, 且和APD 数据库中的抗菌肽AP00450 相似度高达40%。
根据ExPASy (The Expert Protein Analysis System)蛋白质组学分析网站提供的在线服务软件进行螺旋轮图分析(http://heliquest.ipmc.cnrs.fr/)结果表明该抗菌肽7 个疏水残基中有4 个在同一表面,亲水残基在相反的位置,预测该抗菌肽可能形成一种两亲性结构。研究表明,在目前已知的抗菌肽中,它们氨基酸序列的同源性较低。在阳离子型抗菌肽中,它们通常由12 至45 个氨基酸组成,相对分子质量在5 ku 以下, 最少具有两个净正电荷,具有阳离子特征和两亲性[24]。 本试验合成肽链物性预测结构均符合抗菌肽理化特性。

图1 抗菌肽的螺旋轮分布Fig.1 Helix distribution of antimicrobial peptides
2.2 抗菌肽抑菌活性
2.2.1 抑菌活性验证 图2 显示1.0%的抗菌肽水溶液对腐败希瓦氏菌及大肠杆菌的抑制效果。可以看出, 抗菌肽对腐败希瓦氏菌和大肠杆菌表现出显著的抑菌活性, 抑菌圈大小分别为15.15 mm 和16.56 mm。
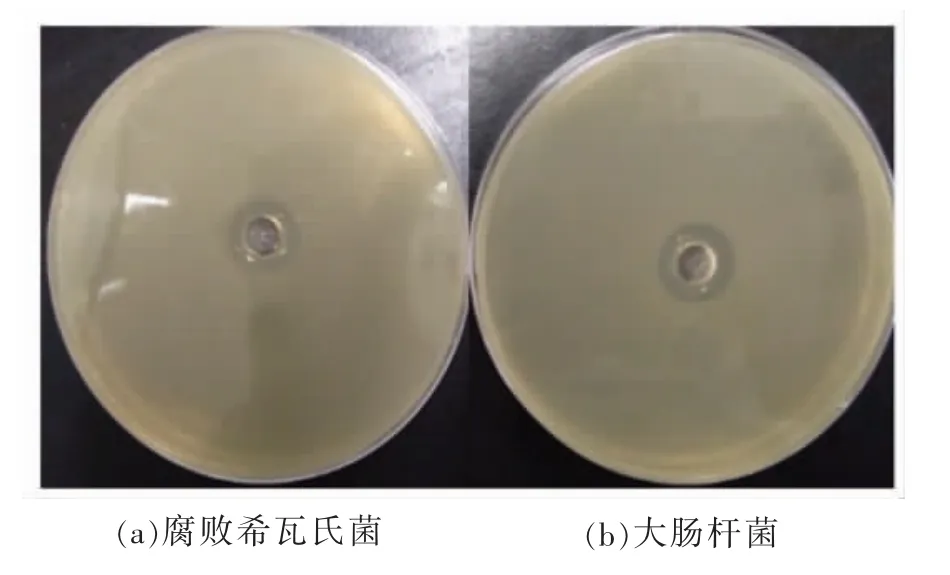
图2 抗菌肽对细菌的抑制作用Fig.2 The inhibitory effect of antimicrobial peptides on bacteria
2.2.2 抑菌活性稳定性 在上述抗菌活性验证试验基础上,观察抗菌肽7 d 内抑菌圈的变化。 观测结果表明抑菌圈的大小没有明显变化, 表示抗菌肽的杀菌稳定性较好。
2.2.3 最小抑菌浓度 分别将经抗菌肽处理的腐败希瓦氏菌及大肠杆菌菌悬液置于酶标仪上测定其在波长595 nm 处的吸光度值。 结果腐败希瓦氏菌、大肠杆菌的最小抑菌质量分数分别为0.063%,0.032%。
2.3 抗菌肽对细菌生长曲线的影响
在不同的生长阶段, 微生物中细菌悬浮液的吸光度值在一定波长范围变化, 并且细菌悬浮液的浓度与吸光度值成正比。 细菌生长可通过细菌悬浮液吸光度曲线的趋势来判断[25]。 图3 显示抗菌肽对细菌生长曲线的影响。 两种指示菌经抗菌肽处理后生长曲线与正常培养的对照组差异明显。 对照组10 h 后呈对数增长,20 h 后达到稳定状态; 而试验组经抗菌肽处理, 细菌未呈对数增长,且整体数量较少,说明抗菌肽对细菌的生长抑制作用显著。
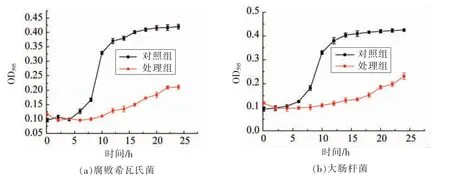
图3 抗菌肽对细菌生长曲线的影响Fig.3 Effects of antimicrobial peptides on the growth curves of bacteria
2.4 抗菌肽对细菌形态的影响
通过观察图4 和图5 可知, 未经抗菌肽处理的指示菌形态饱满,表面光滑且未变形,菌体无缺损;而经0.5%抗菌肽处理12 h 后,菌体发生扭曲变形,内部出现凹陷,且细胞膜表面粗糙、皱缩,并出现孔洞,导致内容物大量泄漏,失去规则的形态结构。 这说明该抗菌肽可能是通过破坏细菌的细胞膜,导致细菌内容物外泄,从而达到杀死细菌的目的。 魏晓晓等[26]用扫描电镜观察,修饰后的牛血红蛋白源抗菌肽JH-3 可引起金黄色葡萄球菌表面皱缩,在大肠杆菌表面形成通道;而谢海伟等[27]发现合成的鲎素抗菌肽可使大肠杆菌等细菌细胞的微观结构发生改变, 细胞表面可观测到坍塌和破裂现象。
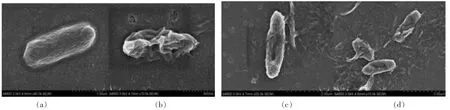
图4 抗菌肽处理腐败希瓦氏菌的扫描电镜图Fig.4 SEM of S. putrefaciens treated with antimicrobial peptides
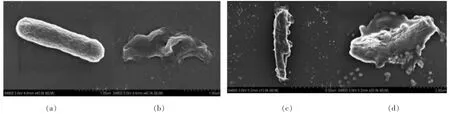
图5 抗菌肽处理大肠杆菌的扫描电镜图Fig.5 SEM of E. coli treated with antimicrobial peptides
2.5 抗菌肽对细菌外膜通透率的影响
通常抗菌肽的抑菌过程首先是穿过细胞壁接触细菌细胞膜, 然后使氨基酸残基与磷脂双分子层在静电作用下发生结合, 抗菌肽将疏水端插入细胞膜的疏水区域来改变膜的结构, 破坏细菌细胞膜的完整性,最终达到抑菌效果[28]。 革兰氏阴性细菌的外膜可防止一些物质损害细胞膜的脂多糖和膜蛋白,对细菌细胞起到保护作用。正苯基萘胺(1-N-phenyl-naphtylamine,NPN)是一种疏水性(hydrophobic)荧光探针,在磷脂环境下产生强烈蓝色荧光。 完整的细菌细胞外膜对正苯基萘胺进行排斥,一旦膜遭到损害,正苯基萘胺便可进入膜磷脂层,从而增强荧光现象,这种荧光现象的强、弱成为常用的评价细胞膜损伤程度的荧光检测信号[29]。 抗菌肽对两种指示菌外膜损伤的作用见图6,与李婷婷等[30]研究结果类似,添加抗菌肽后,两组指示菌试验组荧光值比对照组显著提高(P<0.05),说明指示菌外膜受到损伤,表明抗菌肽通过损害细菌细胞外膜使其死亡。
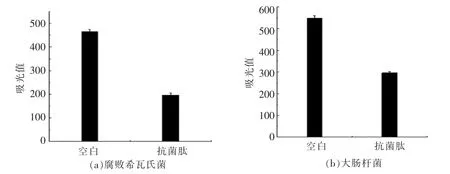
图6 抗菌肽对细菌外膜通透性的影响Fig.6 Effect of antimicrobial peptides on the permeation of bacteria outer membrane
2.6 圆二色谱检测
与抗菌肽的氨基酸残基排列顺序相比, 其二级或高级结构在研究它们的生物学功能方面更加重要。 通过圆二色谱的测定获得抗菌肽二级结构中α-螺旋(α-helix)、β-折叠(beta-pleated sheet)、转角(turn)和不规则卷曲(Random coil)比例。
在该试验中,使用JASCO 715 圆二色谱仪鉴定在不同缓冲液中抗菌肽的二级结构。 与王超炜等[31]测定结果相符,图7a 显示,在PBS 缓冲液中,抗菌肽在波长200 nm 附近有负的谱带,表面抗菌肽在缓冲液中为无规则卷曲结构; 图7b 显示,当周围环境替换为模拟膜环境时(2.5% SDS 溶液),在波长192 nm 附近,抗菌肽有正的谱带,而在波长208 nm 和222 nm 附近有两个负的谱带, 表面抗菌肽在模拟膜环境时出现典型的α-螺旋结构。根据相关报道,二级结构中具有α-螺旋的抗菌肽多数以桶形模型对细菌细胞膜进行渗透, 进而杀死细菌[32]。 综合上述结果推断鲶鱼体表黏液抗菌肽凭借桶板模型机制到达抑菌作用。

图7 抗菌肽在不同缓冲溶液中的圆二色谱图Fig.7 Circular dichroism of antimicrobial peptides in different buffer solutions
3 结论
体外合成的来源于鲶鱼体表黏液的抗菌肽对腐败希瓦氏菌和大肠杆菌均有较为明显的杀菌作用。 该新型抗菌肽对腐败希瓦氏菌和大肠杆菌的生长均有明显抑制作用, 且最小抑菌质量分数分别为0.063%和0.032%。 抑菌机理研究发现,抗菌肽对腐败希瓦氏菌和大肠杆菌的细胞膜、 细胞壁造成明显的损伤, 严重破坏微生物的细胞形态结构。 此外, 抗菌肽还通过增加细菌细胞外膜通透性, 使体内的物质发生泄漏。 该抗菌肽在2.5%SDS 溶液中呈典型的α-螺旋结构。
4 展望
该新型鲶鱼体表黏液抗菌肽虽然对多种细菌有杀伤作用,但是杀菌效率仍有待提高。以该序列为模板,通过在特定位置删减、增添优势氨基酸或者杂合组成新的抗菌肽, 有望在很大程度上提高抗菌肽的抑菌效率。此外,从自然源分离抗菌肽成本较高, 分离过程复杂。 而化学合成肽的价格昂贵、安全性低,这些都限制了抗菌肽的发展。 依靠基因工程技术实现抗菌肽的高效生产将成为新的研究热点。
