TGF-β1对口腔癌相关成纤维细胞在二维和三维共培养条件下迁移的影响
2020-08-29杨津吴飞飞高庆红李小玉MANABUKato程然周红梅
杨津, 吴飞飞, 高庆红, 李小玉, MANABU Kato, 程然, 周红梅
1. 口腔疾病研究国家重点实验室国家口腔疾病临床医学研究中心 四川大学华西口腔医院口腔黏膜病科,四川成都(610041); 2. 四川大学华西口腔医院口腔颌面外科,四川 成都(610041); 3.口腔疾病研究国家重点实验室 国家口腔疾病临床医学研究中心 四川大学华西口腔医院,四川 成都(610041); 4. 三重大学医院肾内科,日本 三重县(514-8507); 5.口腔疾病研究国家重点实验室 国家口腔疾病临床医学研究中心 四川大学华西口腔医院预防科,四川 成都(610041)
癌相关成纤维细胞(carcinoma associated fibroblasts,CAFs)是肿瘤微环境中最重要的间质细胞,在肿瘤的发生发展过程中扮演关键角色[1-2]。本课题组前期研究结果显示:与正常成纤维细胞相比,口腔CAFs 无论在形态结构、生长方式、分泌特性、染色体核型还是基因型等方面均发生了显著变化,而正是这类生物学特性异常活跃的CAFs 促进了口腔癌的发生发展[3-5]。被募集迁移至癌巢区域是CAFs 重要的生物学特性之一[6-7],但有关口腔CAFs 是否发生迁移,目前仅有本课题组前期在二维培养条件下观察到的初步结果[8]。因二维细胞模型较难准确模拟体内环境[9],因此,有必要建立三维细胞模型观察CAFs 的迁移现象,为进一步研究转化生长因子-β1(transforming growth factor-β1,TGF-β1)对CAFs 的迁移调控机制奠定实验基础,本研究拟通过二维和三维细胞共培养模型探讨TGF-β1 对CAFs 迁移的影响。
1 材料和方法
1.1 主要试剂和材料
倒置荧光相差显微镜(Olympus 公司,日本);青链霉素双抗(HyClone,美国);10%胎牛血清(Gibco,美国);高糖型DMEM 培养基(Gibco,美国);胰蛋白酶(HyClone,美国);波形蛋白(vimentin)兔抗人单克隆抗体(Abcam,英国);成纤维细胞活化蛋白(fibroblast activation protein,FAP)兔抗人多克隆抗体(Abcam,英国);α-平滑肌肌动蛋白(αsmooth muscle actin,α-SMA)兔抗人单克隆抗体(Abcam,英国);细胞角蛋白(cytokeratin)兔抗人多克隆抗体(Abcam,英国);生物素-链霉卵白素免疫组化检测试剂盒(索莱宝,中国);polybrene(汉恒生物)。
1.2 标本收集及口腔CAFs 原代细胞分离培养
经患者知情同意,选取2014~2016 年在四川大学华西口腔医院颌面外科收集的新鲜口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC)组织块。将组织置于含有青链霉素双抗的PBS 缓冲液中备用。本实验经四川大学华西口腔医院医学伦理委员会审查通过。用青链霉素双抗和PBS 冲洗组织块,眼科剪剪切至1~3 mm3大小,均匀地排列在瓶底,相互距离约0.5 cm。10%胎牛血清高糖型DMEM 培养基注入培养瓶底部,置于37 ℃,5%CO2孵箱中培养。待组织块周围爬出的细胞铺满培养瓶底90%时,胰蛋白酶消化。传代2 次纯化CAFs。用第3 代纯化细胞做鉴定。具体方法参照本课题组前期建立的组织块法[10]。
1.3 免疫细胞化学染色鉴定
细胞成单层铺于盖玻片上后,用4%多聚甲醛溶液固定细胞。PBS 漂洗后,用0.1%TritonX-100 处理细胞。采用生物素-链霉卵白素免疫组化检测试剂盒进行免疫细胞化学染色。一抗包括波形蛋白(vimentin)兔抗人单克隆抗体、成纤维细胞活化蛋白(fibroblast activation protein,FAP)兔抗人多克隆抗体、α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)兔抗人单克隆抗体和细胞角蛋白(cytokeratin)兔抗人多克隆抗体,PBS 作为阴性对照。于倒置相差显微镜下观察,将胞质中出现淡棕色或棕黄色颗粒判为阳性结果。
1.4 二维培养:细胞划痕实验和Transwell 小室实验
1.4.1 分组 未经处理的CAFs 细胞为对照组,以培养基中加入10 ng/mL TGF-β1 刺激的CAFs 为实验组。
1.4.2 细胞划痕实验 6 孔板中接种1 × 106个CAFs 培养24 h 至铺满,饥饿24 h 后,用10 μL 的枪尖划线3 条、冲洗;分别加入含10 ng/mL TGF-β1 的和不含TGF-β1 的无血清高糖型DMEM 培养基培养;分别取0 h、24 h、48 h 后观察、采图。
1.4.3 Transwell 小室实验 Transwell 小室实验中,Transwell 下室加入500 μL 含0.5%胎牛血清的培养基,实验组下室中加入外源性刺激因子10 ng/mL TGF-β1;上室加入200 μL 密度为2 × 105个/mL 的CAFs 细胞混悬液。培养24 h 后,取出小室,冲洗,4%多聚甲醛固定,结晶紫染色,光镜下观察计数。
1.5 制备绿色荧光蛋白(green fluorescent protein,GFP)(+)CAFs
CAFs 细胞计数1.5×106个后培养24 h,换1 mL新鲜培养基和5 μg 的polybrene。每瓶中加入4.5× 107IU 慢病毒溶液进行转染,慢病毒质粒中插入GFP 片段和平阳霉素抗性基因片段。培养24 h 后换为含10 ng/mL 平阳霉素的新鲜培养基,筛选稳定表达GFP 的细胞,同时,向空白组的CAFs 中加入同等量的平阳霉素,隔天换液培养。待空白组的CAFs 全部死亡后,将GFP(+)细胞培养液换为无平阳霉素的含10%胎牛血清的培养基。
1.6 三维细胞共培养模型的建立
借助GFP(+)CAFs 对现有的三维细胞迁移模型进行改进,建立了肿瘤细胞和CAFs 迁移的三维细胞培养模型(图1),该模型中,基质胶上方为口腔癌细胞株SCC25,基质胶分为上下层,上层为GFP 标记的CAFs,下层为无标记的CAFs,以方便观察上层CAFs 向下层的迁移。

Figure 1 Establishment of a three-dimensional culture model for the migration of CAFs and squamous carcinoma cells. Created with BioRender.com图1 建立肿瘤细胞和CAFs 迁移的三维细胞培养模型
三维培养体系基质成分按照表1 的比例混合,放于冰上备用,制备为组织基质。吸取CAFs 与上述配制的基质混匀,取100 μL(细胞数5 × 105个/mL)加入96 孔板中,置于37 ℃,5% CO2孵箱孵育0.5 h,待基质凝固,制备为下层间质组织;GFP(+)CAFs 与基质混匀,取100 μL(细胞数5 × 105个/mL)加入96 孔板中基质的上层,37 ℃,5%CO2孵箱孵育0.5 h 后,制备为上层间质组织,加入100 μL培养基,再培养24 h。在制备好的间质组织上种植肿瘤细胞,吸取SCC25 细胞混悬液100 μL(细胞数2×105个/mL)加入96 孔板中,培养24 h。

表1 三维培养体系基质成分Table 1 Proportion of gel components
用I型胶原浸泡尼龙膜,置于孵箱中孵育30 min后,用含1%戊二醛的PBS 固定[11],置于4 ℃冰箱中1 h 后PBS 和培养基交替冲洗,浸泡于培养基中,4 ℃储存备用,制备尼龙膜。取出96 孔板中已凝结成组织块的三维细胞培养模型放至培养皿尼龙膜上,浸泡含10%胎牛血清的培养基,培养1 周。隔天换液。实验组的培养皿中的培养基中加入外源性10 ng/mL TGF-β1,对照组中不加入TGF-β1,以比较TGF-β1 对口腔癌细胞和CAFs 细胞迁移的影响。培养1 周后4%多聚甲醛固定24 h,脱水机中脱水,液体蜡包埋后切片。组织切片行HE 染色:将组织切片放入二甲苯中脱蜡,然后置于梯度酒精中进行水化,于苏木素染液中染色水洗,1%盐酸酒精分色,置于伊红染液中染色,梯度酒精脱水,置于二甲苯中透明,中性树胶封片。分别置于普通光学显微镜、荧光显微镜下观察采图。
1.7 统计学分析
所有数据采用SPSS 21.0 软件统计分析,采用非参数检验中的K-S 检验方法对两组数据进行正态性检验,若数据资料服从正分布,则采用studentt检验;若数据资料不服从正态分布,则采用秩和检验。P<0.05 为差异具有统计学意义。
2 结 果
2.1 CAFs 的原代培养和鉴定
原代培养的CAFs 5 d 可见组织块周围有少量细胞爬出,细胞呈长梭形。原代培养的3 株细胞的细胞角蛋白表达均呈阴性,波形蛋白表达均呈阳性,说明细胞来源于间质,而非来源于上皮。
α-SMA 和FAP 常作为鉴定CAFs 的标志蛋白,染色阳性表达(图2),说明培养的细胞为CAFs[12]。

Figure 2 Immunocytochemistry staining to identify CAFs ×40图2 CAFs 免疫细胞化学阳性结果 ×40
2.2 二维培养培养条件下口腔CAFs 的迁移
2.2.1 细胞划痕实验结果 在对照组中,24 h 时可观察到细胞的迁移,48 h 细胞迁移数增多,划痕宽度变小;在实验组中,24 h 时细胞迁移数较对照组多,48 h 时划痕基本愈合(图3a);24 h(t=3.595,P=0.023)和48 h 时(t=19.24,P<0.001,图3b),两组间的平均划痕宽度的差异有统计学意义。
2.2.2 Transwell 小室实验结果 Transwell 小室实验中观察到了CAFs 的迁移现象,加入外源性TGFβ1 刺激因子24 h 后,实验组中平均细胞迁移数达到122 个,而对照组平均细胞迁移数59.33 个,实验组明显较对照组增多(图3c、3d)。两组间的平均细胞迁移数的差异有统计学意义(t=8.132,P=0.001,图3e)。
2.3 三维细胞培养条件下肿瘤细胞和CAFs 迁移的观察
用慢病毒转染制备的GFP(+)CAFs,慢病毒转染率达到了90%以上。借助GFP(+)CAFs 建立了肿瘤细胞和CAFs 迁移的三维细胞培养模型。结果发现,普通光镜下可发现明显的肿瘤上皮层和细胞间质层,肿瘤上皮细胞向间质明显浸润(图4a);在荧光显微镜观察,可发现图中GFP(+)的CAFs 分布在基质胶的全层中,即整个间质层中可观察到GFP 标记的CAFs,提示GFP(+)的CAFs 向下层胶中发生了迁移(图4b)。

Figure 3 Comparison of the two-dimensional cell culture model formigration between the two groups图3 两组间二维细胞培养迁移结果的比较
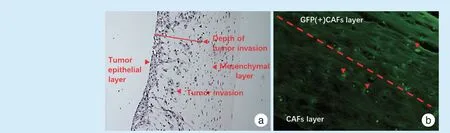
Figure 4 Observation of the three-dimensional culture model for migration图4 三维细胞共培养模型的迁移结果观察
在实验组细胞培养基中加入TGF-β1,HE 染色后,进行比较(图5a),结果示实验组平均浸润深度/三维细胞培养组织全层深度的比值约0.436,对照组约0.433,两组间肿瘤细胞平均浸润深度比差异无统计学意义(t=0.03,P=0.977,图5b);荧光成像比较GFP(+)CAFs在间质层的迁移,发现GFP(+)CAFs已迁移至未标记CAFs 细胞层(图5c),且10 ng/mL TGF-β1对CAFs细胞迁移深度也无明显影响。
3 讨 论
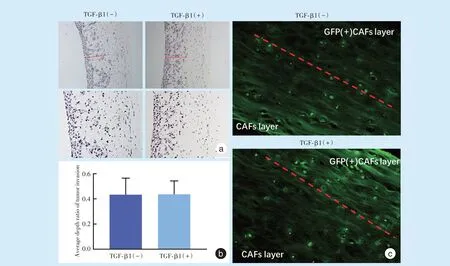
Figure 5 Comparison of the three-dimensional cell culture model for migration between two groups图5 两组间三维细胞培养迁移结果的比较
目前CAFs 研究大多采用二维模型,即划痕实验和Transwell 小室实验[5-6,13]。二维培养条件较难模拟体内环境,缺乏与肿瘤细胞、细胞间基质的相互作用,与体内CAFs 真实生存环境有一定差异[14]。为了能更好地模拟体内环境,研究者们模拟出三维共培养模型[15-16],Horie 等[17]通过建立上皮细胞-CAFs 三维共培养模型,用以研究肺癌细胞与CAFs 间的作用,在组织培养5 d 后,组织切片后可看到上皮细胞的浸润。Ham 等[9]通过三维基质-三阴性乳腺癌细胞培养,方便地模拟CAFs 与三阴性乳腺癌细胞的相互作用,量化其对癌细胞信号传导和耐药的影响。Bertero 等[11]应用了由成纤维细胞诱导的鳞状细胞癌细胞集体侵袭的三维模型。Nakamura 等[18]利用三维培养模型发现平足蛋白(+)CAFs 对肺腺癌肿瘤细胞的促生长作用。三维模型与Transwell 小室等其他共培养体系相比较,实验结果更加直观,且更接近真实环境[19]。课题组对现有的三维共细胞迁移模型进行了改进,以更直观地观察口腔CAFs 的迁移现象。三维培养通过肿瘤上皮层和基质层的建立,能模拟体内的肿瘤微环境,研究肿瘤细胞与CAFs 间的相互作用。本实验中通过对基质分层、上层细胞标记后,可以更加直观地观察到CAFs 的迁移。
TGF-β1 作为肿瘤细胞和CAFs 之间相互作用的重要细胞因子[20-21],既可促进肿瘤的发展[22],也可加强CAFs 的迁移能力。在TGF-β1 调控下,结肠癌CAFs 中的连接蛋白claudin-11 表达上调,可促使CAFs 集中迁移[23]。旁分泌的TGF-β1 在CAFs 诱导的上皮间质转化和乳腺癌细胞转移中起重要作用[22]。并且TGF-β1 的相互旁分泌作用可增强CAFs 诱导的癌细胞侵袭[6-7]。本实验在二维培养条件下,通过细胞划痕实验、Transwell 小室实验观察到了CAFs 的迁移现象,并证实了TGF-β1 可促进CAFs 的迁移。但三维共培养模型中,未发现TGFβ1 对肿瘤细胞和CAFs 迁移的明显影响。二维培养和三维培养需要的TGF-β1 的浓度有差异,三维共培养模式下梯度渗透[16]后,细胞直接接触的TGF-β1 浓度相较于二维培养接触的浓度低,不同的培养方式提示TGF-β1 对细胞迁移的效应呈浓度依赖性。本实验结果也说明二维培养模拟体内具有局限性,三维培养更接近于真实情况,TGF-β1在真实的肿瘤微环境中对CAFs 迁移是否起到作用,还有待进一步研究。
综上所述,使用肿瘤细胞、CAFs 以及胶原建立的三维模型能良好地模拟体内肿瘤微环境的组成、结构和形态,可以更好地模拟肿瘤微环境,模拟体内环境下CAFs 的迁移。三维模型为研究肿瘤微环境中各组分的相关关系[24],模拟细胞迁移、细胞生物力学[25]、肿瘤细胞侵袭浸润[26]、药物干预等[27]提供了实验条件。
