miR-223对肺结核大鼠肺泡巨噬细胞吞噬能力的影响及其机制
2020-08-26江叶舟彭瑶李点
江叶舟,彭瑶,李点
湖南省胸科医院,长沙410006
肺结核是由结核分枝杆菌感染诱发形成,主要临床病理特征为患者肺部出现典型结核结节及肺部干酪样细胞坏死,最终形成空洞[1]。肺泡巨噬细胞(AM)在肺部损伤及病原菌防御中具有重要作用,可通过吞噬、免疫应答清除微生物和感染异物[2]。在多种因素影响下,AM能释放炎症因子,也可释放抗炎症介质,维持内环境稳定,在肺结核发病过程中具有重要作用[3]。miR-223作为高度保守的miRNA之一,可通过抑制其靶基因表达对炎症反应的状态进行调控。研究表明,miR-223表达下降可促进肺结核患者的炎症反应[4]。2019年12月~2020年1月,本研究观察了miR-223对肺结核大鼠AM吞噬能力的影响,并探讨其可能的机制。现报告如下。
1 材料与方法
1.1 材料 动物:雄性SD大鼠40只,16~17周龄,体质量(225±11)g,购自长沙天勤生物科技有限公司。主要试剂:TRIzol试剂购自浙江联硕生物科技有限公司,逆转录试剂盒购自武汉赛维尔生物科技有限公司,RT-PCR检测试剂盒购自上海优予生物科技有限公司;台式低温离心机购自美国Stoelting公司,恒温摇床购自成都苏净科学器材有限公司。miR-223 mimics及其阴性对照质粒均由上海吉玛制药技术有限公司设计合成。
1.2 动物分组与建模干预 将40只雄性SD大鼠随机分为miR-223组、模型组、阴性对照组和正常对照组,每组10只。适应性喂养1周后,miR-223组、模型组、阴性对照组胸部备皮、消毒,以5号针头从右侧肋弓角顶点紧贴剑突侧缘进行胸腔穿刺,进针1 cm左右,注入结核分枝杆菌悬液0.2 mL,拔针后穿刺部位压迫止血2 min;正常对照组注射等量生理盐水[5]。血液检查及结核菌素试验证实肺结核建模成功后,miR-223组、阴性对照组分别经尾静脉注射miR-223 mimics及其阴性对照质粒2 mg/kg,模型组、正常对照组注射等量生理盐水。
1.3 AM分离 各组继续喂养6周后,无菌环境下进行全身麻醉,打开胸腔,将肺部取出,断髓处死。用PBS多次清洗肺叶,流式细胞术分离小鼠AM,经胶原酶Ⅳ消化后获得单细胞悬液。导入到EP管中,1 500 r/min离心5 min;PBS冲洗,在加入RPMI 1640培养基的培养板中重悬细胞。培养2~3 h,吸除上清,PBS冲洗3次;将10 μg/mL脂多糖(LPS)加入培养板中,培养24 h;收集细胞悬液前2 h,加入非经典型自噬抑制剂Brefeldin A(BFA),弃上清,胰蛋白消化后收集AM。
1.4 AM吞噬能力观察 采用流式细胞术。将浓度为0.04 mg/mL的FITC-E.coli悬液注入到各组AM培养基中,无光条件下孵育4 h。无机盐溶液和平衡盐溶液洗涤后,采用流式细胞仪检测AM的平均荧光强度(MFI)和吞噬FITC-E.coli的阳性细胞(形成吞噬荧光微球)百分比(简称吞噬阳性细胞百分比),MFI、吞噬阳性细胞百分比越高表明吞噬能力越强。
1.5 AM形态学观察 采用HE染色。取各组AM,制备细胞爬片,甲醛固定20 min;PBS冲洗3次,苏木精和伊红染色液进行复染,时间分别为6~8 min、10 s。梯度乙醇脱水,二甲苯透明,中性树胶封片。200倍光学显微镜下观察细胞形态。
1.6 AM中miR-223、STAT3 mRNA表达检测 采用实时荧光定量PCR法。取各组AM,胰蛋白酶消化,TRIzol法提取总RNA,反转录成cDNA。PCR引物序列:miR-223上游引物5′-GCCGGCGCCCGAGCTCTGGCTC-3′、下游引物5′-TGTCAGTTTGTCAAATACCCCA-3′,STAT3上游引物5′-GCGGCAGTTTCTGGCCCCTT-3′、下游引物5′-CGGGCCACAATCCGGGCAAT-3′,内参β-action上游引物5′-GAGAGGGAAATCGTGCGTGAC-3′、下游引物5′-GACGTAGCACAGCTTCTCCTTAATG-3′。PCR反应条件:60 ℃预变性,10 min;95 ℃变性,72 ℃退火,各30 s;95 ℃延伸,共循环40次。采用2-ΔΔCt法计算miR-223、STAT3 mRNA相对表达量。
1.7 AM中STAT3蛋白表达检测 采用Western blotting法。取各组AM,以1×105/孔接种于6孔板。加入细胞裂解液,按照4∶1的比例将提取的蛋白溶液和缓冲溶液混匀,煮沸变性。电泳板孔内注入蛋白样品50 μg,转移到PVDF膜上,加脱脂奶粉封闭1 h,TTBS漂洗10 min×3次。加入STAT3及内参GAPDH一抗(稀释比例分别为1∶500、1∶1 000),4 ℃孵育过夜。加入二抗(稀释比例1∶5 000),常温条件下封闭1 h,37 ℃条件下孵育45 min。TTBS漂洗10 min×3次,DAB显色。采用凝胶图象处理系统(Gel-Pro-Analyzer软件)分析目标条带的光密度值,计算STAT3蛋白相对表达量。
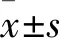
2 结果
2.1 各组AM吞噬能力比较 与正常对照组比较,miR-223组、模型组、阴性对照组MFI及吞噬阳性细胞百分比均降低,且模型组、阴性对照组降低更明显(P均<0.05)。模型组与阴性对照组MFI及吞噬阳性细胞百分比比较差异均无统计学意义(P均>0.05)。见表1。
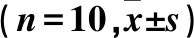
表1 各组AM吞噬能力比较
2.2 各组AM细胞形态比较 正常对照组AM细胞质状态及细胞形态完整,细胞核居中较多,未见吞噬颗粒聚集;miR-223组AM细胞质状态及细胞形态较好,细胞核居中或偏移,少量吞食颗粒聚集;阴性对照组、模型组AM细胞吞噬颗粒聚集,细胞核偏移较为严重。见图1。
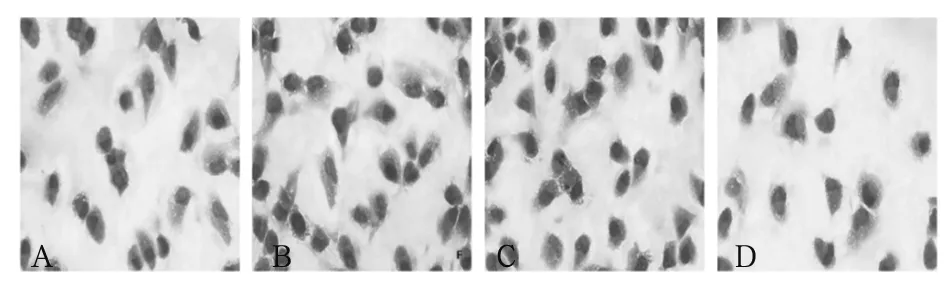
注:A为miR-223组,B为模型组,C为阴性对照组,D为正常对照组。
2.3 各组AM中miR-223、STAT3 mRNA及蛋白表达比较 与正常对照组比较,miR-223组、模型组、阴性对照组miR-223相对表达量均降低,STAT3 mRNA及蛋白相对表达量均升高,且模型组、阴性对照组变化更明显(P均<0.05)。模型组与阴性对照组miR-223、STAT3 mRNA及蛋白相对表达量比较差异均无统计学意义(P均>0.05)。见表2。
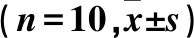
表2 各组AM中miR-223、STAT3 mRNA及蛋白相对表达量比较
3 讨论
肺结核是由于肺结核杆菌感染所引起的慢性传染性呼吸系统疾病,病情严重者甚至可能会导致严重的呼吸系统并发症[6]。研究证实,肺结核发病后会激活巨噬细胞中的多个炎症因子,加上结核分枝杆菌感染,巨噬细胞吞噬病菌后不能将其完全消除,逐渐出现外源性凋亡[7]。miR-223广泛存在于哺乳动物中,具有组织特异性,参与细胞增殖及组织生长,在一定程度上可抑制正常细胞再生[8]。相关文献报道,miR-223在肺结核患者体内可发挥双重作用,在抑制中性粒细胞趋化引起的肺组织损伤的同时,还可降低巨噬细胞中STAT3、NF-κB等表达,通过抑制巨噬细胞凋亡而发挥抗结核免疫的作用[9~11]。本研究结果显示,与正常对照组比较,模型组AM的MFI及吞噬阳性细胞百分比明显下降、细胞形态明显变差、miR-223表达明显降低,说明肺结核会导致大鼠AM吞噬能力下降及miR-223表达降低;而升高大鼠miR-223表达后,大鼠AM的MFI及吞噬阳性细胞百分比明显升高,细胞形态变好。这表明过表达miRNA-223可增强AM的吞噬能力,并有助于恢复细胞形态。
miR-223可调控机体多种靶基因,在炎症反应和感染免疫应答中调控作用显著。STAT通路是调控细胞因子的重要通路,STAT3主要被IL-6家族细胞因子(如IL-11、LIF)通过gpl30受体活化,并受到促炎和抑炎细胞因子的调控[5]。研究发现,STAT3与巨噬细胞的吞噬能力密切相关[12]。STAT3在细胞质、细胞核的相关信号传递中发挥重要作用,STAT3缺乏是巨噬细胞不正常的表现之一,无STAT3表达的巨噬细胞对炎症因子及结核分枝杆菌十分敏感[13]。STAT可参与炎症因子的活化,通过激酶反应使其磷酸化,磷酸化的STAT对特定靶基因予以调控,进行细胞核内DNA转录,调节相关蛋白进行抗炎级联反应,最终影响细胞的增殖、分化和凋亡[13,14]。miR-223、STAT3均与炎症的发生发展有关,但其相关性及对肺结核大鼠吞噬细胞的影响尚不明确。研究发现,miR-223在TLR配体刺激后的表达下调伴随着STAT3表达升高,miR-223靶点预测发现STAT3的3′UTR区有miR-223的非保守结合位点,说明miR-223可通过直接靶向STAT3而调控炎症反应[15]。本研究结果显示,肺结核大鼠AM中的STAT3蛋白表达明显高于正常大鼠,而当升高细胞miR-223表达后肺结核大鼠AM中的STAT3蛋白表达明显降低;结合既往研究结果,说明miR-223对肺结核大鼠AM吞噬能力的影响可能是通过降低STAT3表达而实现的。
综上所述,肺结核大鼠AM中miR-223表达降低,过表达miR-223可增强AM的吞噬能力,其机制可能与抑制STAT3信号通路有关。
