伊沙佐米对人胃癌细胞株SGC-7901生物学行为的影响及其机制
2020-08-26姜炅戴社教陈芬荣董蕾刘欣
姜炅,戴社教,陈芬荣,董蕾,刘欣
西安交通大学第二附属医院,西安710000
胃癌是最常见的恶性肿瘤之一,其主要治疗手段是手术切除[1]。尽管早期胃癌切除术后患者的预后能得到明显改善,但由于癌细胞的耐药性及侵袭、转移能力强等特点,导致胃癌患者的生存率偏低[2,3]。伊沙佐米是一类影响泛素-蛋白酶体系统的小分子靶向药物,能直接抑制蛋白酶体,从而发挥抗肿瘤作用。临床随机对照试验已证实,伊沙佐米治疗复发性多发骨髓瘤效果较好[4,5],美国、欧洲以及中国均已批准其应用于临床[6]。近年来研究发现,伊沙佐米可抑制骨肉瘤、结肠癌以及黑色素瘤等恶性肿瘤的进展[7~9],但其对胃癌的影响尚缺乏研究。2019年3~9月,本研究观察了伊沙佐米对于胃癌细胞生物学行为的影响,并探讨其可能的机制。现报告如下。
1 材料与方法
1.1 材料 细胞:人胃癌细胞株SGC-7901购于湖南湘雅医学院。主要药物及试剂:伊沙佐米购于日本武田公司;Transwell小室购于美国Corning公司,RPMI 1640培养基和胎牛血清均购于美国Gibco公司,TRIzol购于美国Invitrogen公司;兔抗Wnt、β-catenin及NF-κB抗体购于美国Santa Cruz公司,β-actin兔抗购于北京中杉金桥有限公司。
1.2 细胞培养及分组处理 将SGC-7901细胞培养于含有10%胎牛血清的RPMI 1640完全培养基中,37 ℃、5% CO2饱和湿度培养箱中培养。取对数生长期、状态良好的SGC-7901细胞,随机分为12.5 μmol/L组、25 μmol/L组、50 μmol/L组、100 μmol/L组和对照组,分别加入终浓度为12.5、25、50、100 μmol/L的伊沙佐米及相同体积PBS。
1.3 细胞增殖能力观察 采用CCK-8法。将对数生长期的SGC-7901细胞用0.25%胰酶进行消化,制成密度为1×106/mL的单细胞悬液,以1×104/孔接种于96孔板。将细胞按照1.2进行分组处理,每个浓度设置3个复孔。各组分别于作用24、48、72 h,加入10 μL CCK-8溶液,37 ℃条件下孵育2 h。采用酶标仪检测450 nm波长处的光密度(OD)值。
1.4 细胞凋亡能力观察 采用流式细胞术。取对数生长期的SGC-7901细胞,制成密度为1×105/mL的单细胞悬液,以2×105/孔接种于12孔板。参照1.2进行分组处理,培养24 h后收集细胞,使用流式细胞仪检测细胞凋亡率。
1.5 细胞迁移、侵袭能力观察 采用Transwell迁移、侵袭实验。迁移实验:取对数生长期的SGC-7901细胞,制成密度为1×105/mL的单细胞悬液,取100 μL加入Transwell上室,参照1.2进行分组处理。Transwell下室加入500 μL的RPMI 1640完全培养基,培养24 h后取出上室,甲醛固定,结晶紫染色。随机选取5个不同视野,显微镜下计数穿膜细胞数,取平均值。侵袭实验需在滤膜表面涂5 μg Matrigel,其余步骤与迁移实验相同。
1.6 细胞Wnt、β-catenin、NF-κB蛋白表达检测 采用Western blotting法。各组分组处理24 h,使用RIPA提取总蛋白,按照蛋白浓度与5×SDS蛋白上样缓冲液以1∶4混合。煮沸变性后,10% SDS-PAGE分离样品,将蛋白转移到PVDF膜上。用含5%脱脂奶粉的TBS-T室温封闭2 h,加入Wnt、β-catenin、NF-κB一抗(稀释比例分别为1∶1 000、1∶1 500、1∶1 500),室温孵育2 h;加入辣根过氧化物酶标记的二抗(稀释比例为1∶2 000),室温孵育2 h。暗室中加入ECL试剂,使用Bio-Rad照相系统进行照相,并用其附带软件分析条带灰度值,计算Wnt、β-catenin、NF-κB蛋白相对表达量。
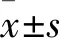
2 结果
2.1 各组不同时间点细胞增殖能力比较 随着时间的延长,各组细胞增殖能力均呈升高趋势。相同作用时间下,对照组、12.5 μmol/L组、25 μmol/L组、50 μmol/L组、100 μmol/L组细胞增殖能力依次降低,两组间比较P均<0.05。见图1。

图1 各组不同时间点的生长曲线(CCK-8法)
2.2 各组细胞凋亡率比较 对照组、12.5 μmol/L组、25 μmol/L组、50 μmol/L组、100 μmol/L组细胞凋亡率分别为1.99%±0.83%、6.72%±1.42%、17.79%±2.19%、28.50%±5.18%、60.94%±7.47%,组间两两比较P均<0.05。见图2。
2.3 各组细胞迁移、侵袭能力比较 对照组、12.5 μmol/L组、25 μmol/L组、50 μmol/L组、100 μmol/L组迁移实验穿膜细胞数分别为(827±11)、(623±13)、(477±21)、(385±38)、(192±9)个,侵袭实验穿膜细胞数分别为(811±35)、(601±15)、(419±22)、(372±13)、(174±21)个,组间两两比较P均<0.05。
2.4 各组Wnt、β-catenin、NF-κB蛋白表达比较 对照组、12.5 μmol/L组、25 μmol/L组、50 μmol/L组、100 μmol/L组Wnt、β-catenin、NF-κB蛋白相对表达量依次降低,组间两两比较P均<0.05。见表1、图3。

图2 各组细胞凋亡情况(流式细胞术)
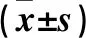
表1 各组Wnt、β-catenin、NF-κB蛋白表达情况

图3 各组Wnt、β-catenin、NF-κB蛋白表达情况(Western blotting法)
3 讨论
伊沙佐米是一类蛋白酶体抑制剂,能直接结合并抑制蛋白酶体,使异常蛋白在细胞内积聚;或可通过减少抑癌基因产物降解,而抑制癌细胞活动,促进癌细胞凋亡[4,5]。Tibullo等[10]研究发现,伊沙佐米能够促进结直肠癌细胞凋亡,其机制可能是诱导DR5表达上调,导致TRAIL/死亡受体信号通路靶向CRC敏感。目前关于伊沙佐米对胃癌细胞增殖、迁移、侵袭、凋亡等生物学行为影响的研究较少。本研究结果显示,相同作用时间下,对照组、12.5 μmol/L组、25 μmol/L组、50 μmol/L组、100 μmmol/L组细胞增殖能力及迁移、侵袭实验穿膜细胞数均依次降低,细胞凋亡率依次升高;这表明伊沙佐米可抑制SGC-7901细胞增殖、迁移及侵袭,并促进细胞凋亡,且这种影响随着伊沙佐米浓度的升高而更加明显。
NF-κB通路可参与细胞凋亡,与肿瘤的发生、发展密切相关。NF-κB作为核转录因子,可控制细胞DNA转录,并参与细胞对有害刺激的反应。在癌细胞中,NF-κB通常呈过表达[11]。研究发现,NF-κB异常表达可降低免疫系统对癌细胞的清除,并促进癌细胞转移。此外,NF-κB还可通过调节抗凋亡基因肿瘤坏死因子受体相关因子(TRAF)来减少细胞凋亡[12]。研究发现,其他的蛋白酶体抑制剂如硼替佐米等亦能抑制NF-κB表达[13],推测硼替佐米等抑制蛋白酶体后,NF-κB的上游蛋白IκB降解减少,而IκB可抑制NF-κB活性。此外还有研究认为[14],NF-κB的前体分子必须经泛素化和蛋白酶体降解后,才可转变为活性分子,因此抑制蛋白酶体可减少NF-κB生成。Wnt信号通路的关键蛋白包括Wnt、糖原合成酶激酶3β(GSK-3β)和β-catenin。Wnt分泌到细胞外,与细胞膜上的受体相互作用并将信号传递给细胞,从而抑制GSK-3β生成。β-catenin可以进入细胞核并形成转录复合物,同时激活Wnt信号通路的靶基因,如cyclinD1和c-myc,从而促进细胞增殖。另一方面,GSK-3β可通过磷酸化作用促进β-catenin降解,并抑制细胞增殖[15]。本研究结果显示,对照组、12.5 μmol/L组、25 μmol/L组、50 μmol/L组、100 μmol/L组Wnt、β-catenin、NF-κB蛋白相对表达量依次降低,表明伊沙佐米对胃癌细胞生物学行为的影响可能与其抑制Wnt/NF-κB信号通路有关。伊沙佐米的这种作用机制可能是通过减少GSK-3β降解实现的,未来需进一步探讨其分子机制。
