化学性交感神经切除对肌筋膜激痛点炎症和肌卫星细胞成肌分化的影响
2020-08-26袁仕国颜丽满武凯徐明奎李义凯邹宇聪
袁仕国 颜丽满 武凯 徐明奎 李义凯 邹宇聪
1南方医科大学第三附属医院,广东省骨科研究院(广州510630);2海南省中医院骨伤科(海口570203);3广州中医药大学第四临床医学院(广州510006)
肌筋膜疼痛综合征(myofascial pain syndrome,MPS)在疼痛中心占比可高达95%[1],但也是临床最常被忽视的疾病之一[2]。MPS 的关键特征是肌筋膜激痛点(myofascial trigger points,MTrPs),按压可产生局部颤搐反应、牵涉痛和自主神经症状[3]。部分临床症状,如局部肤温高、出汗异常、颤搐反应等,指向与自主神经过度活跃有关[4]。研究[5]显示MTrPs 可能受交感神经影响,MTrPs 内的交感-感觉相互作用可能会导致局部疼痛和牵涉痛以及出现交感神经症状,因此临床治疗有必要重新评估针对交感神经的治疗。心肌损伤后会导致心交感神经芽生重构并高支配[6-7],骨骼肌和心肌同属于横纹肌,骨骼肌损伤后是否也会发生交感神经重构和高支配,目前还没有定论。研究[8-10]发现白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)等炎症因子对机体损伤及修复起着复杂的作用。研究[8-10]也发现MTrPs 局部存在炎症因子的高表达。因此,MTrPs 局部交感神经存在怎样的变化,靶向交感神经的治疗是否能促进MTrPs 修复,对骨骼肌损伤修复的关键干细胞-肌卫星细胞(muscle satellite cells,MuSC)及炎症因子等有何影响都成为本研究关注点。本研究拟在大鼠上探索MTrPs 造模后交感神经的支配情况,并予以化学性交感神经切除(chemical sympathectomy,CS),观测相关的炎症因子变化,评估肌卫星细胞激活、成肌分化和骨骼肌修复的情况,探索和拓展MPS的病理机制和新的治疗靶点可能。
1 材料与方法
1.1 实验动物8 周的健康雄性SD 大鼠18 只,体质量为220~250 g,购自南方医科大学动物实验中心,动物许可证号:SCXK(粤)20160041。常规饲养,动物房维持(65 ± 5)%的湿度和(25 ± 3)℃的温度,自由饮水、饮食。所有实验均在南方医科大学实验动物伦理委员会的批准下进行,符合动物管理与使用伦理准则。
1.2 实验仪器与试剂根据文献[12-13]自制木质打击器1 台(打击面直径1 cm,总质量为1 200 g,打击高度为20 cm,动能为2.352 J)。动物试验跑台(上海欣软信息科技有限公司,XR-PT-10A),全波长多功能读数酶标仪(美国Thermo 赛默飞,Varioskan LUX),实时荧光定量PCR 仪(美国Thermo 赛默飞,ABI Stpone plus),光学显微镜(日本OLYMPUS,BX-53)。6-羟基多巴胺氢溴酸盐(6-hydroxydopamine hydrobromide,6-OHDA)(中国阿拉丁,H4381),Rat TNF-α ELISA-Kit(中国Multi Sciences,EK382/3-48),Rat Noradrenaline-(NE)ELISA-Kit(中国Cloud-Clone Corp,CEA907Ge),Rat Interleukin 6,IL-6 ELISA KIT(中国CSB,CSBE04640r),Anti-TH Rabbit pAb抗体(中国ZEN BIO,511027),PAX7 抗体(美国Affinity,AF7584),RTPCR 引物由上海生工提供。
1.3 大鼠分组及干预
1.3.1 大鼠分组将18 只大鼠按照随机表法分配到3 组中,每组6 只:A 组为空白对照组,B 组为MTrPs 造模组,C 组为MTrPs 造模+CS 组。
1.3.2 MTrPs 造模B、C 组大鼠采用打击结合离心运动的造模方法进行MTrPs 造模[12-13]。第1 天进行右侧股内侧肌打击损伤,第2 天进行力竭运动。每周进行打击和跑台运动1 次,连续4 周,然后再恢复4 周。
1.3.3 化学性交感神经切除C 组大鼠在第8 周MTrPs 造模完成后开始,每3 天腹腔注射6-ODHA 1 次,用量为100 mg/kg,连续腹腔注射2 次以完全阻断交感神经[14]。A组和B组注射等量生理盐水。
1.3.4 取材化学性交感神经切除10 d,过量麻醉处死大鼠取材。按文献方法取材,具体方法:暴露右股四头肌,轻轻按压探寻股内侧肌打击部位及周围的肌紧张带,可触及明显的紧张带和/或膨大的结节,并予以针灸针刺入此处,引出颤搐反应者即为MTrPs。A 组取右股内侧肌相应部位。标本取材约1 cm3。
1.4 组织切片处理
1.4.1 固定与切片标本取材后于40 g/L 多聚甲醛4 ℃固定24 h,30%蔗糖脱水约24 h 至标本沉底,OCT 包埋,10 μm 厚冰冻切片。
1.4.2 苏木素-伊红(Hamematoxylin-eosin,HE)染色常规HE 染色:苏木素染色2.5 min,伊红染色2 min。光镜下观察,每个标本随机取5 个切片,每个切片采集5 个200 倍视野图片,使用Image J 软件分析肌细胞所占面积,计数挛缩结节数量,最终取其均数,下同。
1.4.3 免疫荧光切片于山羊血清常温封闭1 h,Pax7 和TH 一抗浓度为1∶150,4 ℃孵育16 h,避光加入浓度为1∶400 的二抗,4 ℃孵育2 h,4′,6-二脒基-2-苯基吲哚封片,荧光显微镜拍照。
1.5 ELISA 测定NE 和炎症因子IL-6、TNF-α表达在4 ℃下MTrPs组织匀浆加入去离子水(1∶9),匀浆液10 000 r/min 离心30 min,上清液12 000 r/min 离心60 min。各样品严格按照ELISA 试剂盒说明书操作,并采用Curve Expert 2.20 软件进行标准曲线拟合,计算样本各指标浓度值进行统计分析。所有样品均一式两份进行检测。
1.6 RT-PCR 测定MyoG、MyoD 基因表达按100 mg组织加入1 mL TRIzol,匀浆,加入1/5体积氯仿,其余按常规步骤提取RNA。依次加入抑制剂和逆转录酶进行反转录。取0.2 mL 无酶管,分别加入如下反应体系:12.5 μL 2 × qPCR Mix,2.0 μL 7.5 μmol/L 基因引物,2.5 μL 反转录产物和8.0 μL ddH2O,每个反转录产物配制3 管复孔,进行实时定量扩增(表1)。结果通过2-ΔΔCt方法计算的MyoD和MyoG 基因表达的倍数变化。

表1 MyoG 和MyoD 引物序列Tab.1 MyoG and MyoD primer sequences
1.7 统计学方法应用SPSS 19.0 软件进行统计分析,所采集数据用()表示。Levene 法进行方差齐性检验。方差齐时,多组间均数比较采用单因素方差分析(one-way ANOVA),组间两两比较采用SNK-q法比较;方差不齐时用Welch 法进行近似方差分析,组间两两比较采用Dunnett′s T3 法比较;以P<0.05 为差异有统计学意义。
2 结果
2.1 一般资料大鼠造模后无骨折、皮肤破溃、感染等。C 组在注射第2 次后死亡1 只。
2.2 各组肌细胞病理形态的变化A 组肌细胞呈规则排列的多边形或长条形,间隙均匀,无断裂,无明显炎症细胞浸润(图1A、B)。B 组的肌细胞形成挛缩结节、间隙明显增宽,同时肌细胞萎缩、断裂,可见炎症细胞浸润;横截面上呈现出类圆形和不规则形,纵截面上呈扭曲长条形(图1C、D)。C组肌细胞明显较B 组再生;可见少量挛缩结节,较B 组减少;肌细胞横截面上呈大小不等的多边形或类圆形,炎症细胞浸润基本消失(图1E、F)。
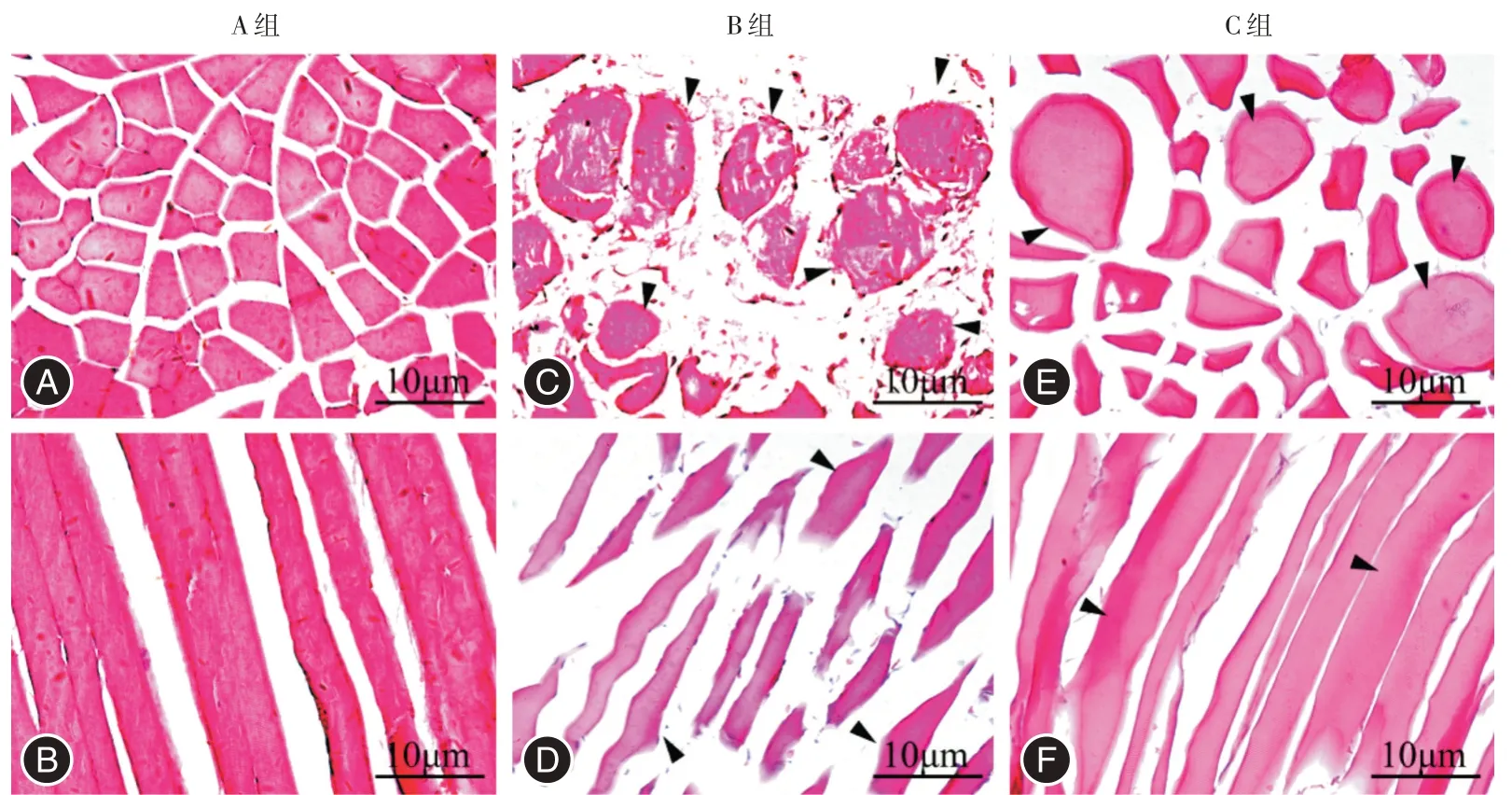
图1 各组骨骼肌HE 染色(箭头所示为挛缩结节)Fig.1 HE staining of skeletal muscle in each group(arrows show contracture knots)
2.3 各组肌细胞面积比例和挛缩结节数量3组中横截面和纵截面的肌细胞面积比例均为A >C >B,差异有统计学意义(F=22.31、34.59,P<0.01,图2A、B,表2)。说明交感神经阻断可促进肌细胞面积恢复。挛缩结节数量均为B >C >A,差异有统计学意义(F= 32.83、326.15,P<0.01,图2C、D,表2)。结果说明CS 可减少挛缩结节。
2.4 IL-6、TNF-α和NE 的表达A、B、C 3 组中MTrPs 局部的IL-6 分别为(6.87 ± 2.73)、(87.99 ±20.09)、(47.66 ± 15.91)pg/g,TNF-α分别为(32.39±31.72)、(665.82±124.62)、(230.29 ± 96.15)pg/g,均为B >C >A,差异有统计学意义(F=45.07、73.33,P<0.01,图3A、B)。而NE 分别为(293.55±60.37)pg/g、(722.67 ± 185.61)pg/g、(60.70 ± 10.87)ng/g,B >A >C,差异有统计学意义(F= 46.15,P<0.01,图3C)。说明CS 处理后NE 明显降低,且可降低IL-6 和TNF-α炎症因子的表达。
2.5 MyoD 和MyoG 基因的表达A、B、C 3 组中MTrPs 局 部MyoD 分 别 为(0.84 ± 0.14)、(1.95 ±0.36)、(1.20 ±0.16),B >C >A,差异有统计学意义(F= 31.95,P<0.01,图4A)。MyoG 分别为(0.42±0.19)、(0.53 ± 0.22)、(0.93 ± 0.17),3 组差异有统计学意义(F= 10.33,P<0.01,图4B),C 组最高,组间比较显示虽然B 组数值较A 组高,但差异无统计学意义(P= 0.77)。即造模后成肌分化因子MyoD 基因激活表达,但成肌分化的终末因子MyoG 在B 组上升不明显,而C 组较B 组相对降低MyoD 和提升MyoG 基因的表达,且仍较正常对照的A 组高。
表2 各组肌细胞面积比例和挛缩结节数量Tab.2 Proportion of muscle cell area and number of contracture knots in each group ±s

表2 各组肌细胞面积比例和挛缩结节数量Tab.2 Proportion of muscle cell area and number of contracture knots in each group ±s
注:组间两两比较,**P <0.05,*P <0.01,#P >0.05
组别A 组B 组C 组F 值P 值例数6 6 5肌细胞横切面积比例(%)72.68±11.59#31.21±13.01*53.93±5.14#22.31<0.01肌细胞纵切面积比例(%)72.78±10.97#29.05±9.21*52.73±5.85#34.59<0.01横截面挛缩结节数量4.17±1.47*67.00±18.91*38.60±13.54*32.83<0.01纵截面挛缩结节数量7.06±2.42*98.85±30.11*59.59±19.92*326.15<0.01
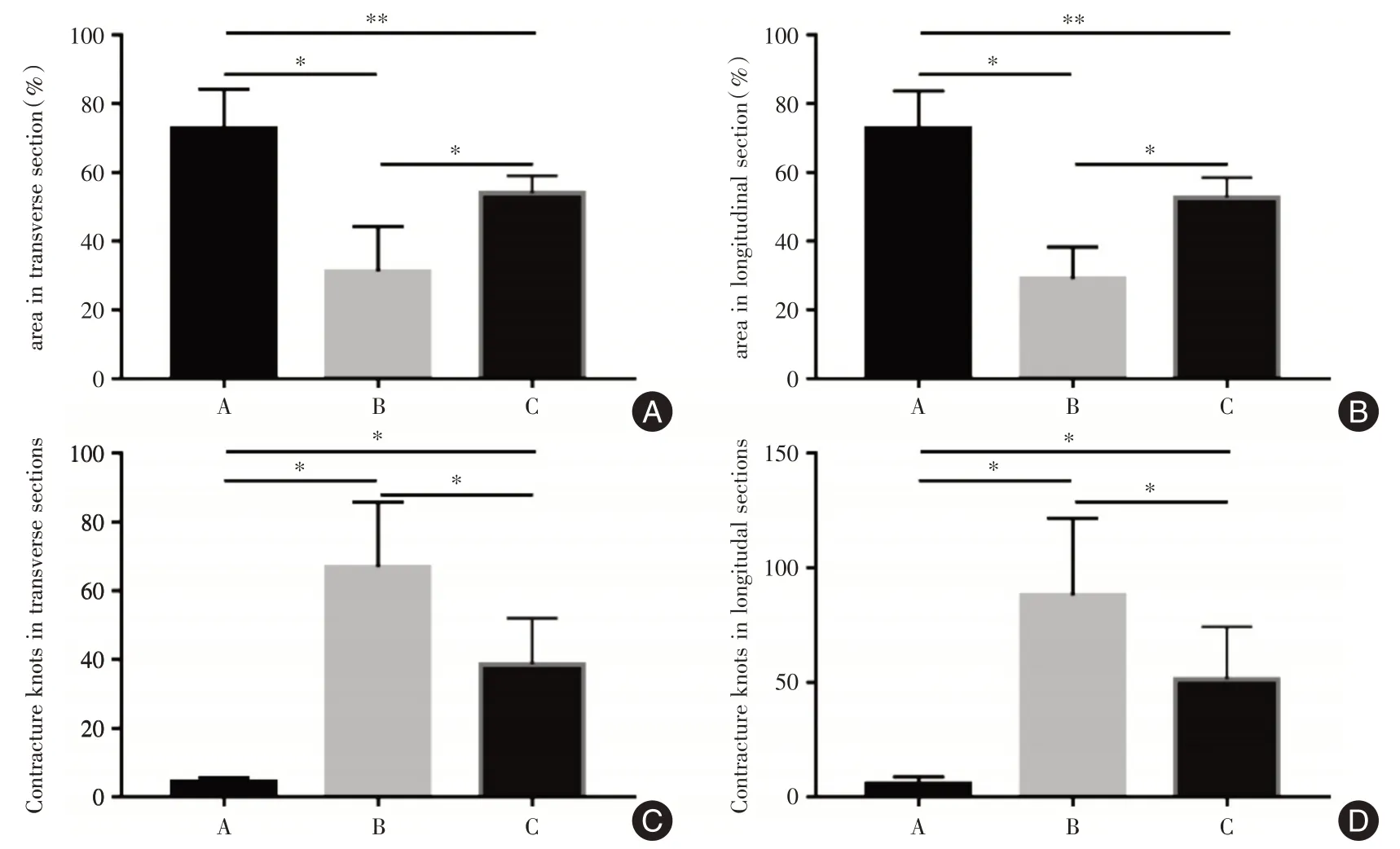
图2 各组肌细胞面积比例和挛缩结节数量Fig.2 Proportion of muscle cell area and number of contracture knots in each group

图3 各组IL-6、TNF-α和NE 的表达Fig.3 Expression of IL-6,TNF-α and NE in each group
2.6 TH的免疫荧光检测A、B、C 3组TH的荧光强度值横截面上分别为(2.51 ± 0.39)、(3.74 ± 0.42)、(1.04±0.19)μm2/(mm2·103),纵截面上分别为(1.70±0.41)、(4.66±0.72)、(1.03±0.24)μm2/(mm2·103),B >A >C,差异有统计学意义(F= 75.97、81.73,P<0.01)。即MTrPs 造模后TH 高表达,交感神经存在重构和高支配现象。CS 可明显下调TH 的表达,即CS 可明显抑制交感神经活性。见图5、图6A、B。

图4 各组MyoD 和MyoG 基因的表达Fig.4 MyoD and MyoG gene expression in each group
2.7 Pax7 的免疫荧光检测A、B、C 3 组Pax7 的荧光强度值横截面上分别为(4.29 ± 1.29)、(1.09± 0.26)、(2.80 ± 0.48)μm2/(mm2·103),纵截面上分别为(4.53 ±1.25)、(1.03±0.41)、(2.58±0.60)μm2/(mm2·103),差异有统计学意义,A >C >B(F=30.73、25.94,P<0.01,图6C、D 和7)。即MTrPs 造模后Pax7 低表达,MuSC 大量激活并分化,并有耗竭趋势。MTrPs 造模后,给予CS 可明显上调Pax7 的表达,即CS 可抑制MuSC 的过度激活分化,对维持MuSC 的数量具有重要的意义。
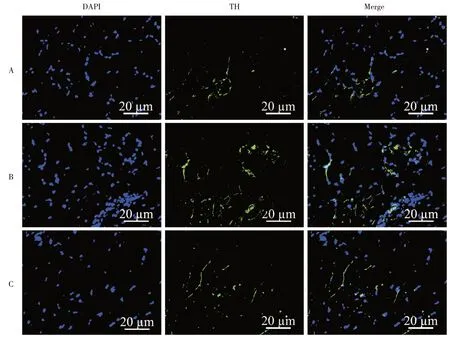
图5 TH 的免疫荧光的表达(200×)Fig.5 Expression of TH immunofluorescence(200×)
3 讨论
MPS 是由MTrPs 引起的感觉、运动和自主神经症状的综合征,常由急慢性肌肉损伤导致的,适度的炎症细胞如单核细胞浸润可促进肌肉的修复。炎症细胞的过度浸润则导致纤维化[15],肌肉组织失去原有的功能,对功能恢复是不利的。炎症因子可激活并促MuSC 分化,但过度的炎症刺激导致其成肌分化受抑制,并可能导致MuSC 的耗竭[16]。需要调节炎症细胞和炎症因子合适的表达以促进MTrPs 成肌修复、快速修复,达到良好的功能和形态的修复。
本实验中发现MTrPs 造模后,MTrPs 骨骼肌萎缩,并且造模组同时肌细胞还形成挛缩结节,且数量众多。这些组织病理学发现与先前的研究一致[17]。MTrPs 造模后IL-6 和TNF-α均显著升高,炎症细胞明显浸润[9]。IL-6 和TNF-α是众多炎症因子的代表,IL-6 既可促进又可抑制炎症[18]。而炎症因子可激活MuSC,MuSC 激活后其干性的标志之一Pax7 消失[19]。MuSC 激活后进行增殖,重新归于静止并恢复MuSC 的数量并保持其干性,或分化为成肌或成纤维细胞等。本实验中发现MTrPs 造模后MyoD 明显高表达,而Pax7 显著降低,即MuSC大量激活,但成肌生长因子MyoG 则升高不明显,提示MuSC 激活后可能因局部微环境的变化向非成肌方向分化。同时Pax7 显著降低,提示MTrPs中可能微环境的变化会导致MuSC 的数量减少甚至耗竭,从而导致肌肉持续萎缩、无法成肌修复。
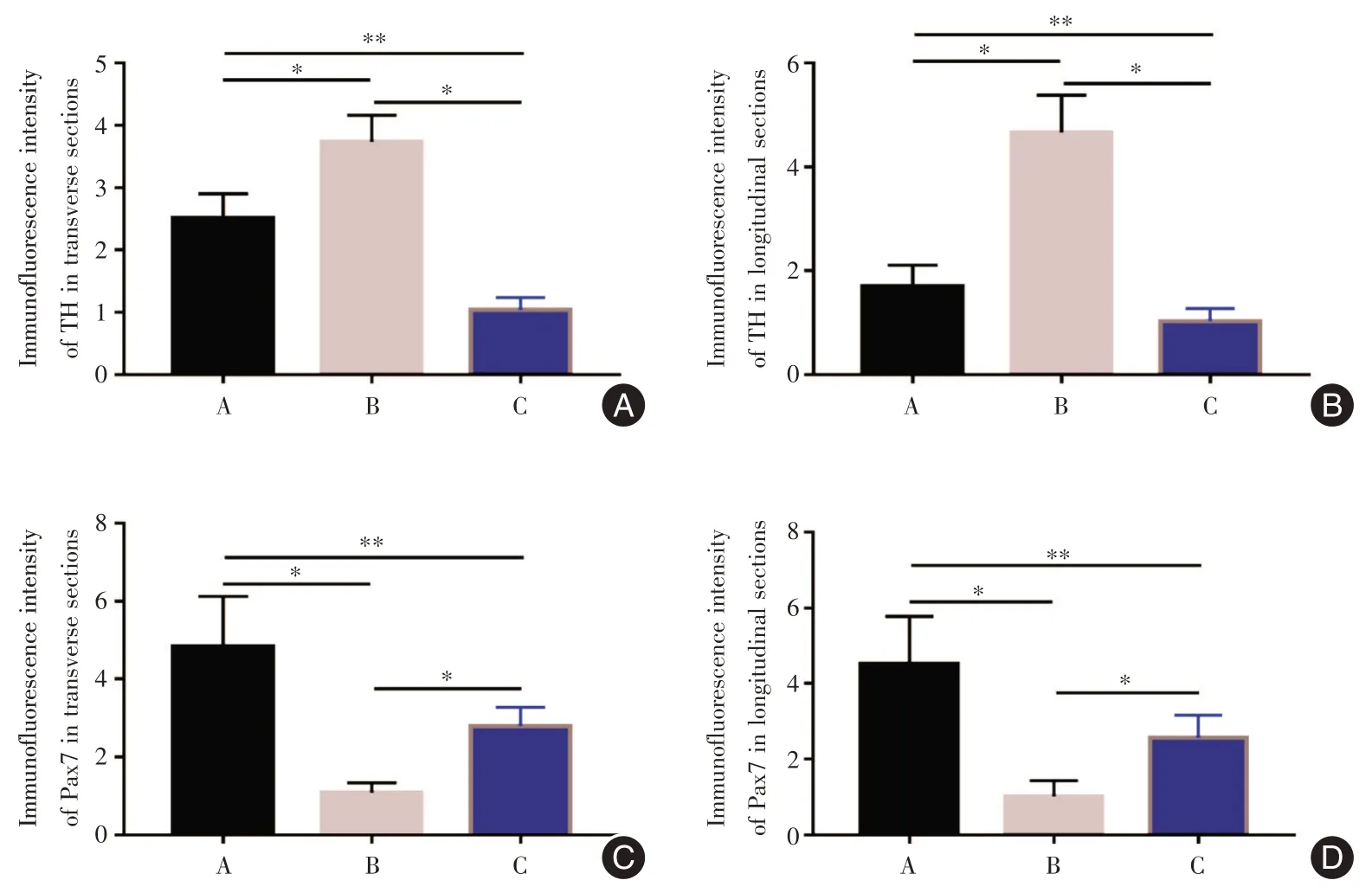
图6 各组TH 荧光强度值Fig.6 Fluorescence intensity of TH in each group
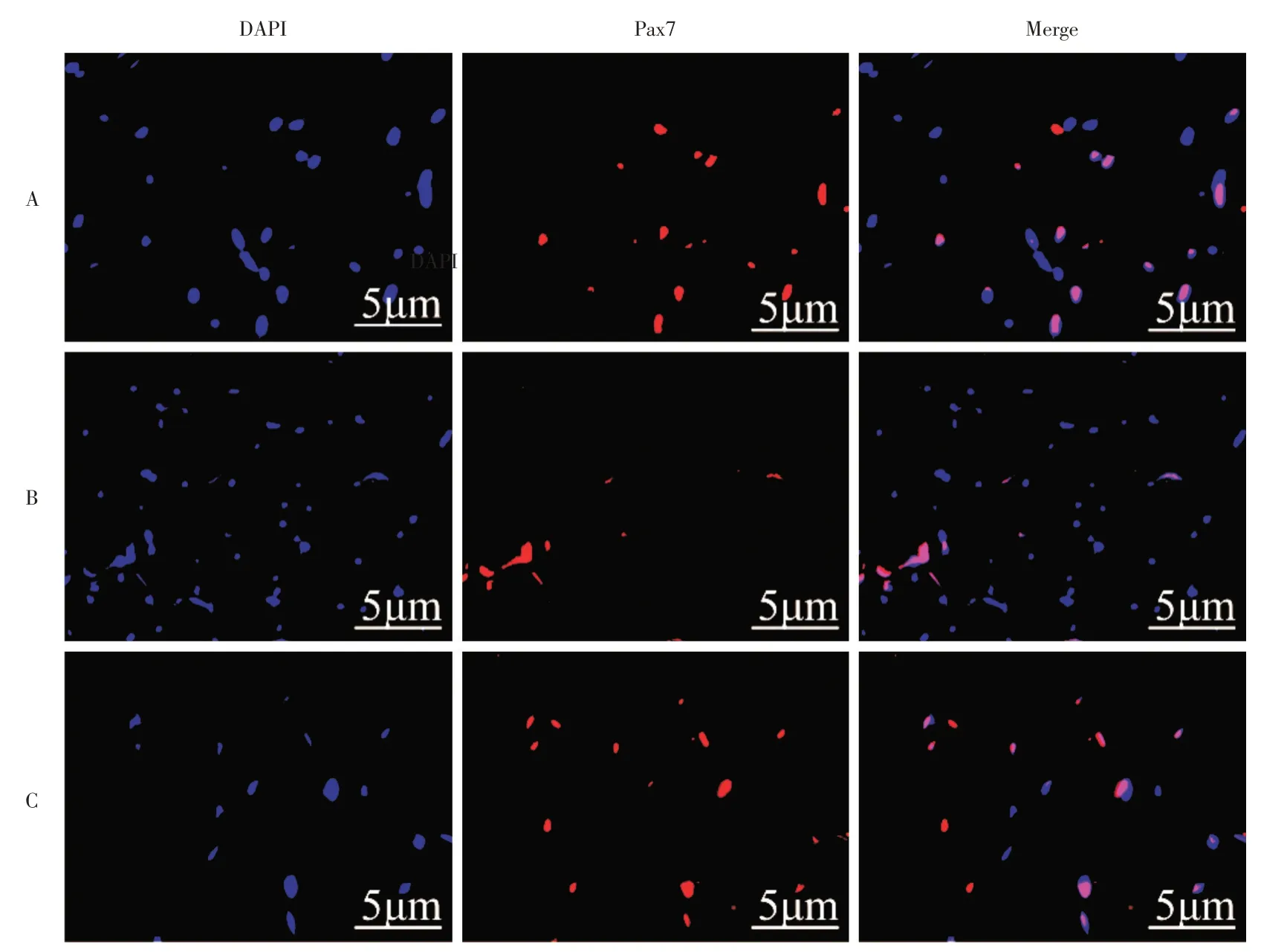
图7 各组骨骼肌MTrPs 局部Pax7 表达(400×)Fig.7 Local MTrPs Pax7 expression of skeletal muscle in each group(400×)
MPS 患者局部颤搐反应、出汗异常、肤温异常以及交感神经皮肤反应等症状指向MTrPs 局部可能存在交感神经重构和异常支配[20]。目前普遍认可的观点认为神经递质释放异常是MTrPs 的中心环节[21]。文献报道患者上部斜方肌的MTrPs 的NE 浓度较高,而较高浓度的神经递质诱发形成MTrPs[22-23]。本实验发现MTrPs 局部NE 浓度明显较空白对照组高,而CS 处理后NE 的表达明显降低,与此同时MTrPs 的肌细胞面积明显增加,炎症细胞浸润基本消失,炎症因子IL-6 和TNF-α均显著降低。表明CS 可以促进MTrPs 成肌修复。然而矛盾的是,CS 处理后MTrPs 局部的MyoD 和MyoG基因表达反而较单纯造模组降低,但Pax7 反而较单纯造模组高,表明抑制交感神经的高支配有利于维持MuSC 的干性。这种抑制MuSC 的过度激活并维持其干性的作用机制,可能是CS 促进成肌修复的重要原因。
综上所述,本实验在动物模型中成功构建了MTrPs,证明了MTrPs 发生了交感神经的重构,导致其高支配,这可能对MTrPs 的病理认识以及MPS 的诊治有益。抑制交感神经高支配,有利于维持MuSC 的干性,抑制MuSC 的过度激活,并促进成肌的终末分化,从而促进成肌修复。但是,本实验为初步的在体动物实验,由于缺乏时间梯度的研究,缺乏详尽的作用机制研究,仍需要全面系统的实验证明之。
