过氧化钙缓释技术在地下水污染修复中的应用研究
2020-08-25蒲生彦侯国庆李博文
蒲生彦,侯国庆,吕 雪,李博文
(1.成都理工大学生态环境学院,四川成都610059;2.国家环境保护水土污染协同控制与联合修复重点实验室,四川成都610059;3.中国环境科学研究院环境基准与风险评估国家重点实验室,北京100012)
地下水的溶解氧(DO)水平是控制污染地下水原位生物修复的关键参数。 由于地下水溶解氧含量较低,在自然条件下很难发生好氧微生物降解,污染严重的地区常常出现厌氧条件。为了加速工业污染场地的原位生物修复, 经常需要向受污染区域提供氧气〔1〕。 部分固体氧化剂(Na2CO3·1.5H2O2、CaO2、MgO2等)可以在水中缓慢溶解,并落入反应受限的区域,这些组分迅速在其表面释放氧, 表现出受溶解过程的化学动力学控制〔2〕。 过氧化钙(CaO2)与其他金属过氧化物(MgO2、ZnO2)相比,在水和土壤中使用相对绿色安全,对环境影响较小。
过氧化钙在水中的溶解度很低,与水反应很慢,是最稳定的无机过氧化物之一, 与含水介质接触时能以可控速率缓慢与水反应并释放出氧气, 为土壤和地下水连续供氧。过氧化钙可通过H2O2与石灰反应制得,在现场很容易制备,成本低廉,操作简便〔3〕,因此成为地下水污染生物修复中好氧微生物的新供氧源。过氧化钙与水反应的产物H2O2还能进一步分解为羟基自由基(·OH)〔4〕,是一种非选择性强氧化剂,能氧化分解水体中的多种有机物〔5〕。 但过氧化钙缓释技术实际应用于地下水污染修复工程还面临着需进一步延长氧气释放时间, 克服试剂直接注入时pH 升高过快等诸多局限。
本文调研了大量文献, 较系统地梳理了过氧化钙提高溶解氧、释放自由基的过程机制,影响过氧化钙缓释性能的关键因素, 总结了过氧化钙的包封技术以及纳米过氧化钙制备等方面的研究进展, 以期为后续研究过氧化钙缓释技术用于地下水污染修复提供有益参考。
1 过氧化钙缓释技术研究现状
与其他过氧化物或化学氧化剂相比, 过氧化钙具有更好的热稳定性, 更长的释放时间和可接受的成本,无二次污染,在实验室大量研究基础上成功应用于现场修复。在工程应用中,过氧化钙以粉末状或浆状被引入地下水和土壤中〔6〕,为提高过氧化钙在复杂地下水环境条件下的释氧能力, 技术人员对过氧化钙进行了改性操作, 主要包括可控释放和材料的纳米化。
1.1 控氧释放技术
在实际应用过氧化钙进行地下水修复时, 直接添加过氧化钙会导致地下水中的DO 或H2O2浓度达到非常高的水平, 远超过污染物氧化或降解的需求。 高浓度的溶解氧和过氧化氢会造成原料浪费和影响持续供给问题,并对地下微生物产生毒性。部分研究发现将过氧化钙采用其他材料包封改性, 通过改变过氧化钙的反应性来控制H2O2和O2的释放速率。表1 总结了典型的可控过氧化钙释放技术,涉及渗透反应性屏障技术和包封过氧化钙释氧技术。

表1 受控过氧化钙缓释技术研究
渗透反应性屏障(PRB)是一种被动的地下水原位修复技术,通常设置在污染羽的下游,以便有机污染物与反应屏障中的材料接触, 其氧释放速率可通过混凝土压块的大小来控制〔3〕。 在PRB 中使用富氧带或屏障能够增强微生物的活性〔16〕,是一种高效控制地下水中溶解的碳氢化合物和其他易生物降解污染物的方法。在受污染的含水层或污染物柱的流动路径中安装含有多种反应介质(包括零价铁、活性炭、石灰和氧气释放化合物)的PRB,通过增强吸附、沉淀、化学和生物降解作用来消除地下水中的污染物,可实现长期控制的目的〔17〕。 Cuicui Liu 等〔8〕通过透水反应屏障修复PAH 污染的地下水, 实验发现100 d内加入50 g 过氧化钙的反应器的溶解氧质量浓度比空白反应器的氧质量浓度始终高1~7 mg/L。此外,大量研究数据表明,过氧化钙具有促进反应性屏障中污染物生物降解的潜力, 能够强化对地下水中三氯乙烯(TCE)〔18〕、PCE〔12〕、MTBE〔7〕、BTEX〔10〕和铵态氮〔11〕等污染物的修复效果。 与目前使用的其他修复技术(如抽出处理、原位冲洗)相比,具有较低的维护成本、可就地处理、无需地面设施和无地下水回注的优点。
用其他材料包封过氧化钙形成复合材料可提高修复性能,封装材料包括混凝土〔12〕、海藻酸盐〔13〕、聚乙烯醇〔10〕等。将过氧化钙掺入封装材料制备成团块,可以避免在水体恢复和地下水修复中应用时, 蓄水层渗透性显著降低。 包封过氧化钙的复合材料中也常加入pH 缓冲液, 以控制过氧化钙在应用过程中pH 升高。 在地下水中添加过氧化钙通常会使环境pH 迅速提高到10~12, 虽然地下水有缓冲能力,可抵消pH 变化, 但实验中常加入环境友好型添加剂(KH2PO4、(NH4)2SO4和柠檬酸等)来中和过氧化钙与水反应生成的氢氧化钙,同时可为微生物提供营养物质〔19〕。 一些添加剂如硼酸、磷酸等也能稳定释放过氧化氢〔20〕。改性后的过氧化钙复合材料不仅能增加氧的释放周期,还能缓解释氧过程中pH 快速升高的现象。
1.2 过氧化钙纳米化
将修复试剂应用于地下水污染的原位修复主要有2 种技术,一种是PRB 技术,另一种是原位注入技术。 原位注入技术要求修复试剂在地下环境中具有一定的迁移能力。在实际修复过程中,由于过氧化钙的粒径过大,在介质中很难扩散迁移,甚至常发生团聚。 过氧化钙不能随着地下水的流动而进行有效的迁移扩散, 限制了对污染物的有效去除与修复效果。为提高反应速率和材料的扩散性能,研究人员在研制纳米级过氧化钙(nCaO2)方面做出许多努力。
过氧化钙进行纳米改性可以显著降低其粒径,提高比表面积,优化过氧化钙的性能。纳米过氧化钙的改性方法分为物理法和化学法。 其中物理方法是以机械接地单元为基础制备Ca(OH)2纳米粒子,并与H2O2发生后续反应〔3〕。 化学方法则使用化学稳定剂来避免钙化合物前驱体〔如Ca(OH)2、CaCl2和Ca(NO3)2〕与H2O2反应生成纳米粒子 的 不可 逆 团聚〔21〕。 纳米过氧化钙较常规具有以下特点:(1)高反应性, 过氧化钙的巨大比表面积增加了过氧化钙与污染物的反应位点, 使得过氧化钙去除污染物的速率非常快,大大缩短了环境修复时间〔22〕;(2)良好的分散性和迁移性,改性后的纳米CaO2颗粒直径和粒径均匀分布,因而颗粒分散性和迁移性更好,不会出现严重的团聚现象;(3)吸附性〔23〕,纳米CaO2具有巨大的比表面积,污染物更容易吸附在其表面。
实验室研究表明,纳米过氧化钙的添加对地下水无明显不良影响,并具有高效去除地下水中As(Ⅲ)〔24〕和有机污染物的潜力〔25〕。Yajie Qian 等〔26-27〕降解2,4-DCP 时发现,用相同质量浓度(10 mg/L)的nCaO2和CaO2降解30 mg/L 2,4-DCP,nCaO2可在5 d 内完全降解2,4-DCP,而CaO2的降解率只有75%。 nCaO2的比表面积为62.23 m2/g,几乎是CaO2的3 倍(24.08 m2/g),能提供更多的反应位点。 纳米过氧化钙颗粒的粒度小、比表面积大,在土壤和地下水中能很好地分布和迁移,其强吸附性、高反应性可以加快颗粒与污染物的反应,缩短反应时间,达到更加快速、有效去除污染物的目的。表2 总结了纳米过氧化钙在地下水污染修复中的研究进展。

表2 纳米过氧化钙在地下水污染修复中应用研究进展
2 过氧化钙缓释过程机制及主要影响因素
2.1 氧气的释放
过氧化钙持续释放氧的能力为给水体、 土壤连续供给氧气提供了可能。随着与水反应的进行,尽管副产物Ca(OH)2会使水的pH 升高,但过氧化钙在提高氧浓度和持续供给氧气方面具有优越的特性,其释放氧气的过程机理如图1 所示。
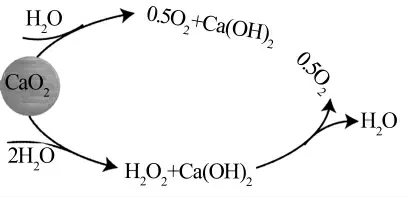
图1 过氧化钙可能的氧气释放机理
根据化学计量学, 过氧化钙的含氧量为0.222 2 g/g。Shejiang Liu 等〔31〕以开发好氧微生物供氧技术为主要目的, 采用间歇实验法研究了不同条件下过氧化钙的释氧速率、过氧化钙添加量对pH 的影响,研究发现过氧化钙(0.45~2.5 g/L)的释氧过程包括3个阶段:第1 阶段在15 min 内完成,其中溶解氧迅速增加到溶解氧最大值的30%~50%(约为7.2~12 mg/h),不同浓度的过氧化钙对此阶段氧的释放速率有明显影响;在第2 阶段(15 min~12 h),溶解氧的增加速率比第1 阶段慢, 过氧化钙浓度的变化对氧的平均释放速率影响不大, 释氧速率约为0.48 mg/h,随着溶解氧含量的增加,过氧化钙与水的反应进一步受限;第3 阶段(12~48 h),氧气的释放速率为0.084 mg/h,此阶段不同浓度过氧化钙的溶解氧浓度均达到最大值并保持稳定,因此氧释放速率与过氧化钙的浓度无关。 整个过程中水体pH 在5 min 内迅速升高到最大值, 然后pH 随时间变化几乎保持不变,随着过氧化钙浓度的增加,最大pH 也随之增加。
关于过氧化钙是先生成H2O2再由H2O2释放氧气,还是过氧化钙直接反应生成氧气,目前的文献报道仍存在争议〔32-33〕。 T.Schmidtke 等〔32〕比较了催化剂对土壤有机反应和无机反应的催化作用, 结果表明不加入催化剂时没有氧气产生, 加入过氧化氢酶作催化剂的实验ORC 释放了大量氧气,猜测ORC 氧气的释放与催化剂及H2O2形成有关。但其他研究表明CaO2可直接产生O2, 并不通过中间体H2O2产生〔33〕。Hefei Wang 等〔33〕研究了CaO2的溶解特性、O2和H2O2的释放特性, 认为过氧化钙反应过程中氧是直接从氧化钙溶液中释放出来,过氧化氢并非中间产物。因为向反应器中添加CaO2时,H2O2和O2的浓度急剧增加, 而在实验后期H2O2和O2的浓度几乎不随时间增加。表明过氧化氢释放的终止时间与O2的终止时间有很好的相关性, 在整个氧化钙溶解过程中,H2O2和O2的生成曲线高度一致。 此外,从氧气释放速率随时间的变化情况可知, 只有少量过氧化氢存在时,过氧化钙溶解初期的释氧速率最高。随着反应进行,氧化还原速率不断降低。 当H2O2浓度达到最大值时,O2释放率降低到非常小的值。 可见CaO2直接产生O2,并不通过中间体H2O2来产生。
2.2 自由基的释放
关于过氧化钙的自由基释放机理仍存在争议,许多研究对过氧化钙产生自由基的机理提出了不同解释。S.Qin 等〔34〕假设过氧化钙上存在自由基,并在细胞反应实验中检测到自由基(·OH)的产生。J.Ramo等〔35〕发现过氧化钙上过氧化氢阴离子(HOO-)的产生,但并没有进一步研究。P.Christel 等〔36〕处理过氧化钙得到过氧化钙和过氧化氢的结晶CaO2·2H2O2,发光光 谱 表 明CaO2·2H2O2可 以 释 放 单 线 态 氧(1O2)。Yong Ma 等〔5〕证明了过氧化钙表面活性氧还包括另一种超氧阴离子()。 显然,过氧化钙产生的自由基是CaO2降解污染物的主要因素,但目前尚未明确其自由基释放机制,需要进一步研究。
Yong Ma 等〔5〕通过化学发光法、UV-Vis 光谱和特殊的自由基有效清除剂测定了各种自由基清除剂对氯离子释放强度的影响,探讨了自由基(·OH、等)在氧化钙上可能的生成机制(如图2 所示)。以往研究发现, 过氧化钙能在潮湿的空气中发生缓慢的分解反应(1),CaO2与H2O 反应可以缓慢生成H2O2,因而CaO2有“固体过氧化氢”的称号〔27〕,通过在碱土金属过氧化物的悬浮液中获得单电子,H2O2能够容易地经历氧化还原以提供·OH, 随后系统进行反应(3)和(4);自由基存在时间很短(如·OH~10-6s;0.1 s),很快被反应(5)和(6)消耗,基于以上讨论提出了CaO2与水的总反应作为反应(7)。对于不同的碱土金属过氧化物,悬浮液的条件(如溶解度和pH)相同,自由基的形成过程也可能相似。 不同碱土金属过氧化物生成自由基的主要区别在于每一步的反应速度。 例如·OH 是MgO2的主要自由基,因为其反应(2)的速度比反应(3)的快;而是BaO2反应生成的主要自由基,反应过程中反应(3)的反应速度比反应(2)的速度快。1%CaO2水溶液的pH 约为12,在强碱性条件下HO2·容易转化为, 故CaO2反应形成的主要自由基为。 这项研究不仅证实了过氧化钙能释放·OH,而且还证实它也能释放。·OH 和是CaO2的主要自由基, 与其性质相似的碱土金属过氧化物(MgO2仅释放·OH,BaO2仅释放)相比,可以同时释放·OH 和的CaO2表现出良好的转化性能。

图2 过氧化钙的自由基产生释放机理
2.3 缓释过程的主要影响因素
在过氧化钙转化为O2的过程中,O2和H2O2释放的2 条途径形成了一个具有竞争关系的平行反应体系。提高温度和pH 可以降低H2O2的产率,提高O2产率。 Hefei Wang 等〔33〕研究过氧化钙转化为过氧化氢和氧气的机理时发现,在固定(10、20、35 ℃)温度下,降低pH 可降低O2的产量,提高H2O2产量。在固定pH(4~9.5)下,温度升高能降低过氧化氢的生成量,提高O2的产量,这与之前的研究一致〔37〕。 释放的过氧化氢和氧气总量与理论上使用的过氧化钙相符。 pH 和温度对最终生成H2O2、O2的影响相反。 这是因为H2O2和O2都是从CaO2中释放出来的,2 种释放途径是相互竞争的。
表3 为Hefei Wang 等〔33〕测定的不同pH、温度下过氧化氢和氧气的释放速率。
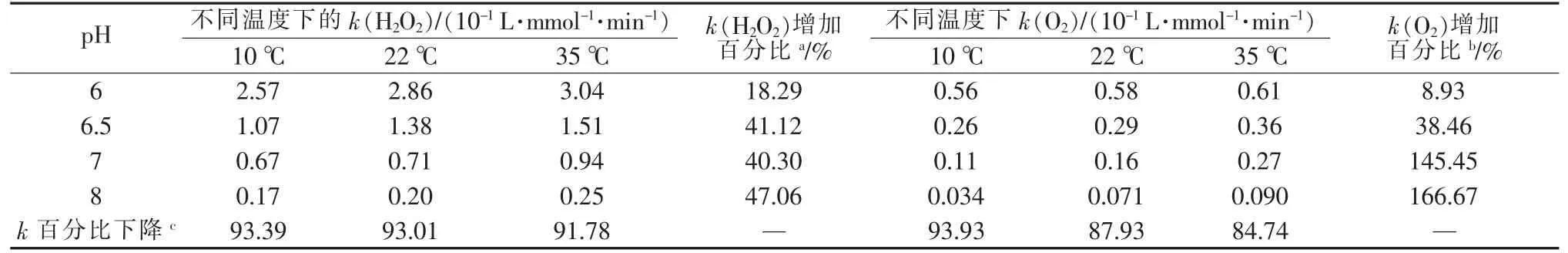
表3 不同条件下过氧化氢和氧气的释放速率常数
由表3 可见,在相同条件下,k(H2O2)数值明显大于k(O2),表明过氧化钙转化为过氧化氢和氧气时释放H2O2是主要反应。 虽然提高pH 会显著降低释放速率常数,但在相同温度下k(H2O2)的下降百分比相对大于k(O2)。 这意味着随着pH 的增加,k(H2O2)的下降速度要快于k(O2)。 这一发现表明其他条件不变时,增加pH,相对于O2的产生,H2O2形成会被更严重地抑制。 因此,pH 增加会增加O2的产量。 此外,在固定pH 下,温度升高可以提高H2O2和O2的释放速率,但在较高的pH 下,k(O2)对温度更为敏感。 pH 为6.5 时k(O2)增长率仅为38.46%,随着温度的升高,pH 为8 时k(O2)增长率达到166.67%。因此,与过氧化氢释放速率相比,温度升高会导致氧气释放速率更大幅度地增加。 这意味着随着温度的升高,氧气的产生量将上升。
3 实际案例
经过多年的实验室研究, 改性过氧化钙已被用于实际污染场地的修复。 Guoxin Huang 等〔11〕提出了一种过氧化钙释氧微球和斜沸石为填料的PRB 系统,用于去除地下水中的铵态氮。 实验中氨氮几乎完全耗尽,主要转化为,少量转化为, 说明生物硝化作用对的去除起主导作用。在此基础上将该系统用于全尺寸连续式PRB墙体系统,在实际应用中取得良好的效果。 ORIN 公司直接向被石油污染的地下水中注入纳米过氧化钙,通过增强的生物修复化学成功修复了被石油污染的土壤和地下水。4 个月时间内,不饱和污染物水平从2 900 mg/L 降至低于检测值〔3〕。 ORIN 公司还尝试使用专用的高压泵向污染土壤、地下水注入硫酸钠和纳米过氧化钙混合试剂, 在注入修复剂过程中监测到羽状流井中的关键地下水参数(如DO、pH、氧化还原电位、电导率)增加,4 个月内污染物从4 700 μg/L 降至1.8 μg/L〔38〕。 与传统的修复方法相比,使用纳米过氧化钙化学注射不仅修复效率高,而且更加快捷、便宜。 Aztech 技术公司〔3〕在原位化学氧化中使用过氧化钙产生自由基氧化石油污染场地的污染物, 过氧化钙缓慢溶解释放的过氧化氢在合适的催化剂(如溶解的铁)的存在下,发生改良Fenton化学反应,施用修复剂后现场监测井中的溶解氧、比电导和氧化还原电位都有上升,达到预期的修复效果。
4 总结与展望
过氧化钙缓释技术能持续为地下水环境供氧,通过增强好氧生物降解作用强化地下水污染的修复,能降解各种污染物包括染料、农药、氯化烃、石油烃、内分泌干扰物,固定重金属和杀死微生物。 过氧化钙的改性研究克服了其在地下水环境中的快速消耗、污染物去除过程中pH 快速升高等问题,提升了过氧化钙的迁移速率、 与污染物的反应速率及其降解效率。然而目前研究尚存在诸多局限,如过多关注过氧化钙降解污染物的效果, 对其修复反应机理研究不够深入; 过氧化钙的改性技术仍处于实验室研究阶段, 存在工艺繁琐等问题, 难以实际大规模利用; 地下水中存在的天然物质及共存离子对过氧化钙缓释修复地下水污染的影响尚不清晰, 无法满足不同应用场景中的多样化需求。
在未来研究中应进一步关注以下问题:
(1)过氧化钙释放过程与污染物的吸附与解吸、氧化与降解机理方面需进一步深入研究。
(2)更多关注过氧化钙可控释放、与污染物之间的相互作用,深入研究地下水中存在的天然有机质、共存离子对修复过程的影响机制。
(3)目前研究大都处于实验室阶段,工程实践案例相对缺乏, 应积极探索过氧化钙缓释技术与其他修复技术的兼容性, 提高联合修复方案对地下水环境适应性,满足实际工程应用多样化需求。