气道内超声-引导鞘管技术在诊断肺周围型病变中的应用研究
2020-08-25黄禹陈娉娉李静
黄禹 陈娉娉 李静
广东省人民医院呼吸内科,广州510030
发生于段级支气管开口以下的肺部病灶称为肺周围型病变。肺周围型病变影像表现多样,从分布范围上可分为局限性或弥散性,从形态密度上可分为实性或非实性。临床上以局限的实性病灶或弥散的渗出性病灶多见。局限的实性病灶包括孤立性肺结节 (直径<3 cm)、局限性肿块型 (直径>3 cm),表现为单发类圆形或不规则形致密影,此类病灶多见于肺良恶性肿瘤、非细菌类感染性病变(结核、真菌)等。弥散的渗出性病灶表现为多发斑片、云雾状密度较淡的阴影,此类病灶多见于感染性病变,也有部分肺腺癌呈此表现。周围型病变于气管镜直视下难以发现,活检确诊率低(16.7%~65.6%),常需行纤维气管镜或CT 引导经皮肺穿刺取病理组织检查以确诊[1-2]。CT 引导经皮肺穿刺对于心脏大血管旁、膈肌旁、离体表较远的病灶风险高且难以成功,故本文探究气道内超声(endobronchial ultrasonography,EBUS)-引导鞘管(guide sheath,GS)技术在诊断肺周围型病变中的价值。
EBUS是将超声探头送入气道内,可对肺周围型病变进行扫描的新技术。目前,已有数项研究报道了EBUS在观察支气管旁结构中的应用,肯定了其在精确定位和诊断肺周围型病变等方面的价值[3-6]。这提示我们,用EBUS作为引导可提高经支气管镜肺活检 (transbronchial lung biopsy,TBLB)的成功率。目前国内尚很少有关于EBUSGS技术的研究报道,本研究评价了此技术在诊断肺周围型病变中的有效性和安全性,并与传统的TBLB技术比较,证实了EBUS-GS技术的优势。
1 对象与方法
1.1 研究对象 选择2011年12月1日至2017年4月1日于广东省人民医院行支气管镜检查的患者66例。本研究符合《赫尔辛基宣言》的原则。
入选标准: (1)CT 检查发现肺周围型病变;(2)常规支气管镜检查无法发现肺周围型病变;(3)无任何不能耐受支气管镜检查的疾患。
排除标准:(1)麻醉药物过敏;(2)有显著出血危险或出血素质;(3)正接受抗血小板聚集药物或抗凝药物治疗;(4)严重的重要脏器 (心、肺、肝、肾、脑等)急慢性疾患或功能不全;(5)严重高血压;(6)一般情况严重衰弱;(7)严重肺大疱及肺纤维化;(8)不能配合检查及知情不同意者。
1.2 仪器和方法
1.2.1 仪器 可弯曲气管镜 (BF-1T260,日本,奥林巴斯);腔内超声主机 (Endoecho EUM2000,日本,奥林巴斯),引导鞘与配套的活检钳(K-203,日本,奥林巴斯),超声探头驱动器(MAJ-935,日本,奥林巴斯);腔内超声探头(UM-BS20-26R,外径2.0 mm;UM-DP20-25R,外径2.5 mm,日本,奥林巴斯)。
1.2.2 EBUS-GS引导下TBLB 在完成常规的支气管镜检查后,将超声探头插入GS中,经支气管镜活检通道将已置入超声探头的GS送向CT 提示的位置,直至术者感到阻力,探头难以前行时启动EBUS扫描,此时一般先出现的是正常肺组织的EBUS图像,然后将超声探头往外匀速、缓慢、轻柔拉出并观察EBUS 图像的变化,一旦发现典型的EBUS图像,将探头从GS内撤去,而GS保留在原位,再经GS置入活检钳取得足够的病理标本(图1、2)。
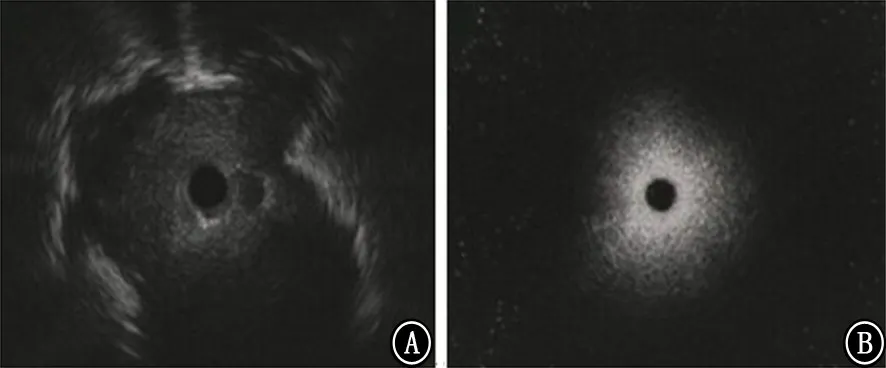
图1 肺周围型病变与正常肺组织的气道内超声图像 A:典型的肺周围型病变图像,可见病灶内部呈实性低回声,病灶边缘出现清晰的强回声带;B:正常肺组织充满空气,超声束难以进入、迅速衰减,肺实质在气道内超声下呈致密、均匀分布的细斑点状强回声
1.2.3 常规TBLB 完成常规支气管镜检查后,经支气管镜活检通道插入活检钳,伸向CT 提示的病灶区域,当术者感到阻力,稍后退打开活检钳后抵住前方咬取肺组织,直至获得足够的标本。

图2 EBUS-GS引导TBLB的步骤 A:已置入超声探头的GS经气管镜活检通道伸入病变部位;B:发现典型的EBUS图像后,将探头从GS内撤去,而GS保留在原位;C:经GS插入活检钳行TBLB术
1.2.4 诊断阳性率的比较 比较2组患者病理诊断的阳性率。结果阴性的患者通过CT 引导下经皮肺穿刺、胸腔镜、开胸手术、肺泡灌洗液结核菌涂片及培养、抗感染疗效追踪等方法以明确诊断。
1.3 统计学分析 采用SPSS 13.0软件分析。计量资料以x-±s表示;计数资料以频数 (%)表示,采用χ2检验进行比较。所有的检验都是双侧的,统计学检验的显著性差异标准:P<0.05为差异有统计学意义。
2 结果
2.1 受试者临床资料及病理结果 66例患者中,男41 例 (EBUS-GS 组19 例,TBLB 组22 例),女25 例 (EBUS-GS 组12 例,TBLB 组13 例),年龄范围为36~75岁。42例恶性病变,24例良性病变。恶性病变中腺癌26 例 (39.4%),鳞癌11例(16.7%),小细胞癌5 例 (7.6%)。良性病变中肺炎12例 (18.2%),结核9例 (13.6%),肺脓肿2例% (3.0%),隐球菌病1例(1.5%)。见表1。
2.2 2种诊断方法的诊断阳性率 EBUS-GS组25例患者扫描中发现了病灶,对肺周围型病变的诊断阳性率为80.6% (25/31)。EBUS发现病灶的患者84.0% (21/25)获得了阳性结果。该组诊断阳性率为67.7% (21/31)。常规TBLB 组的诊断阳性率为37.1% (13/35)。EBUS-GS组具有更高的诊断率(χ2=6.163,P<0.05)。EBUS-GS组未能获得EBUS病灶图像的6例患者,无一例获得阳性病理结果。
2.3 活检的次数 为了取得足够、合适的组织标本,EBUS-GS组活检142次,平均每例患者行活检4.58次;常规TBLB组活检共276次,平均每例患者行活检7.89次。EBUS-GS组需要施行的活检次数更少(t=-5.443,P<0.05)。
2.4 并发症 本次研究中,2组活检后主要并发症为咯血、胸痛,偶发气胸。共33 例 (50.0%)患者出现咯血,主要是痰中带血或少量咯血,可在操作过程中经纤维支气管镜的活检通道注入凝血酶、肾上腺素、冰盐水等处理后出血停止,无一例出现大咯血 (>100 ml/次)。共24 例 (36.4%)患者出现胸痛,胸痛均可耐受,无需处理,3 d内自行缓解。只有1 例 (1.5%)患者出现气胸,肺压缩<20%,吸氧、静卧1周后气体吸收。见表2。

表2 2组患者并发症的发生情况 [例 (%)]

表1 66例患者的一般情况
3 讨论
EBUS-GS引导TBLB 来诊断肺周围型病变是一项新技术。其优势在于通过EBUS 的精确定位能力在病灶处楔入GS使医师能够在病灶处重复取样,并保护其他部位不受活检的影响,故具有很高的临床价值。Herth等[6]研究了50例患者,证实EBUS引导和X 线引导下行TBLB 诊断肺周围型病变之间没有显著性差异[7]。此外,既往研究将EBUS与GS相结合的技术用于肺周围型病变的诊断,大大提高了诊断成功率[8-10]。Yoshikawa等[11]在无X 线透视的情况下用EBUS-GS来诊断肺周围型病变,获得了61.8% 的诊断率,但未比较EBUS-GS引导TBLB与常规TBLB在诊断能力上的差异。本研究探索了EBUS-GS引导TBLB和无X 线引导的常规TBLB 在肺周围型病变诊断上的差别,评估了新技术的可行性、有效性和安全性。
EBUS-GS引导TBLB 主要适用于腔内型病变和已侵犯支气管壁的腔外型病变。因支气管肺癌大多数起源于支气管黏膜上皮,故大部分的癌灶都有支气管可通往。超声探头直径仅2 mm,可通过管径极小的细支气管到达绝大部分的腔内型肺周围型病变。小部分已侵犯支气管壁的腔外型病变,探头一般可到达肺周围型病变附近,对病变支气管附近的组织360°扫描成像,进而引导活检钳对病变支气管邻近的腔外型病灶透壁活检,以咬取到病灶组织。但当腔外病灶未侵犯内径足够大(探头可以通过)的支气管时,探头只能到达病灶附近,其所发出的超声波易被支气管周的空气反射干扰而难以到达腔外病灶,难以将腔外病灶清晰显示。因此,EBUS操作前需分析患者的影像学资料,判断有无通向肺周围型病变的支气管。若无通向肺周围型病变的支气管,EBUS 检查也难以发现病灶。Yamada等[12]发现,探头位于病灶内的诊断率最高(83%),探头邻近病灶稍低 (61%),位于病灶外时最低,只有4%。这表明,探头得以进入病灶或邻近病灶是保证EBUS 准确定位的关键。故对于超声探头无法到达或接近的腔外病变,临床上应选用CT 引导下经皮肺穿刺活检。
本研究中,EBUS-GS 组的诊断阳性率为67.7%,常规TBLB 组的诊断阳性率为37.1%,EBUS-GS组获得更高的诊断率。无EBUS 引导时,只能根据CT 图像来估计肺周围型病变所属的亚段支气管,然后经纤维支气管镜将活检钳送入该亚段所属的各分支内活检。而在EBUS-GS 引导下,可先让超声探头逐个进入该亚段各细支气管内超声探查,直至发现病灶,然后调整探头位置,尽量让EBUS-GS处于肺周围型病变的中心区,再退出探头且不移动引导鞘,而后插入引导鞘配套的活检钳在此处反复活检。也就是说,常规TBLB 是位置不确定下进行活检,而EBUS-GS引导TBLB是位置较为确定的前提下进行活检,后者的诊断率高于前者。
对于CT 增强扫描上表现为明显强化 (尤其强化的幅度在40 Hu以上)的肺外周病变,临床上常认为是血供丰富的病灶。对于这种病灶,常规活检后容易出现大出血,操作视野会因此而模糊不清,令再次活检受到严重影响,也增加了操作风险,延长了操作时间。对于此类病例,运用EBUS-GS引导活检有着一定的优势。通过超声探头的预先扫描,可观察鞘管楔入部位是否存在血管,如果存在血管,则可调整鞘管的位置,选择扫描未发现血管的区域再取活检。同时,在病灶处楔入了鞘管,活检后病灶的出血一般顺着鞘管流出,不会影响纤维支气管镜的操作视野,且通过鞘管就能让活检钳在病灶处反复顺利取样,大大降低了操作风险、操作难度、操作时间,也提高了活检准确性。
虽然EBUS-GS对肺周围型病变有着较强的诊断能力,操作中笔者也发现了一些影响其诊断能力的因素。(1)患者的呼吸活动是影响活检准确性的主要因素。一方面呼吸活动会使鞘管难以毫无移位地停留在病灶内,患者在吸气状态时,病灶会随着肺组织的舒张而不能贴紧活检钳,令活检钳咬空。对此,笔者采取的对策是:当超声探头扫描到病灶后,嘱患者在呼气末屏住呼吸,同时微调鞘管位置,将鞘管调整到探头扫描到的病灶横截面为最大时的位置,这个位置一般为病灶的中部,病灶中部支气管受侵犯常最明显,管腔常最狭窄,鞘管可卡得最紧而不易移位。行活检时,嘱患者在呼气末屏气,同时打开活检钳,可旋转纤维支气管镜镜身,活检钳向侧方移动压紧支气管壁,当感觉到活检钳前方已抵住支气管壁,再关闭活检钳活检。(2)探头不能进入病变所在的段级支气管,尤其是上叶尖段。由于部分段级支气管角度太大,超出内置超声探头鞘管的可曲度,导致鞘管难以进入病变所在的支气管。(3)高分辨率CT 未能发现通向病灶的细支气管,这提示超声探头无法靠近病灶,因探头距离病灶过远而无法显示病灶。(4)非实性病灶由于其周含气较多,且未侵入细支气管内,探头常难以紧贴病灶,探头发出的超声波被病灶周围的气体反射干扰,从而影响了EBUS对病灶的准确定位。
EBUS-GS组未能发现病灶的6例患者,无一例能获得阳性病理结果。究其原因:(1)探头的大小和活检钳相当,探头若无法进入通往病灶的支气管,活检钳亦无法进入通往病灶的支气管。(2)探头在细支气管内时可紧贴其壁,探查其周360°的结构,若EBUS 未能发现病灶,则说明探头无法靠近病灶,同理,活检钳亦难以靠近病灶。这提示我们,对于难以承受活检并发症的患者,如病灶血供非常丰富,活检有可能导致窒息性大咯血的发生。(3)患者肺功能差,不能耐受气胸。(4)存在严重的COPD、肺纤维化、未控制的哮喘,活检易导致张力性气胸的发生,应先行EBUS 检查,若EBUS未能发现病灶,则不必要冒较大的风险续行活检。
本研究中,EBUS-GS组施行更少的活检次数就可得到足够的组织标本,平均每例患者可少活检3.31次,这主要得益于EBUS-GS的定位能力。通过EBUS 的先行扫描,基本确定了病灶的位置,而引导鞘在病灶内的留置则确保了将活检钳引导到病灶内。故较少的活检次数就能达到较好的活检效果。而减少活检次数显然有助于减少操作时间、患者的痛苦及并发症的发生。
与之前的研究[13-16]相比,本研究有如下优势及创新:(1)详细介绍了EBUS-GS的使用方法及注意事项,可更准确地指导医师,特别是尚未开展此技术的医师正确地应用EBUS-GS;(2)创新地总结了影响诊断能力的因素,并根据临床实践提出了解决方案,提示临床上遇到该技术诊断率不高的情况时,可从所列出因素思考并加以解决,待解决因素可由后续研究进一步探究;(3)对研究结果及相关不良反应进行丰富及详细论述,分析其技术优势及原因,尤其在安全性方面,提出对于难以承受活检并发症的患者,活检易导致张力性气胸的发生,应先行EBUS 检查,若EBUS 未能发现病灶,则不必续行活检的结论,具有临床提示意义。
综上所述,本研究初步表明:EBUS-GS引导TBLB的可行性、安全性及临床价值高,是一项有效的技术手段,因此笔者相信,在肺周围型病灶的诊断中,这项技术会发挥越来越重要的作用。
利益冲突所有作者均声明不存在利益冲突
