细鳞鲑(Brachymystax lenok)肝脏对镉暴露的反应
2020-08-25李爽,高凌
李 爽,高 凌
(北华大学林学院,吉林 吉林 132013)
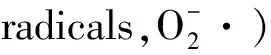
细鳞鲑(Brachymystaxlenok)为鲑形目鲑科细鳞鱼属冷水鱼,分布于俄罗斯中东部、蒙古北部、哈萨克斯坦东北部,以及我国东北部的乌苏里江、松花江、牡丹江和鸭绿江等.细鳞鲑具有非常高的经济和生态价值,是水域食物链的重要组成部分,近年来,由于过度捕捞和污染而濒临灭绝[8].
由于工业化和城市化进程加快,20世纪末21世纪初,我国重金属污染加剧[9].其中,镉(Cd)污染成为松花江的重要金属污染物,但镉对细鳞鲑的毒性作用数据十分匮乏.本次研究将研究镉对细鳞鲑的急性毒性、镉在细鳞鲑肝脏内的累积以及潜在的氧化作用.作为细胞内脂质过氧化的产物,丙二醛(Malondialdehyde,MDA)变化可以表征镉引起的细胞内氧化还原内稳态的波动,SOD活性变化表征抗氧化防御系统的反应.研究结果有助于理解细鳞鲑对重金属暴露的反应,为我国珍惜冷水鱼的资源保护提供基础资料.
1 材料和方法
1.1 细鳞鲑
细鳞鲑幼鱼取自吉林水产科学研究院,体长(2.32±0.33)cm,体质量(72.70±3.55)g.试验鱼用0.1%NaCl清洗后在实验室适应2周.幼鱼光∶暗比为12∶12.采用虹鳟饲料(北京思诺)每日按鱼体质量的2%进行投喂,每天投喂两次.温度为(16±1)℃.
1.2 急性毒性和金属暴露
氯化镉(cadmium chloride,CdCl2)购于Sigma公司,纯度>99%,溶于超纯的MilliQ水,以10 mg/L储存.试验中使用的氯化镉体积质量为0、0.40、0.63、1.00、1.60、2.56 mg/L.试验在2 L玻璃控温水族箱中进行,每箱10尾幼鱼.暴露持续96 h,观测24、48、72和96 h死亡率并将死鱼移除.每个试验3个重复.
1.3 金属分析
每个浓度随机取3尾鱼肝脏,80 ℃下干燥至恒温,使用65%HNO3在110 ℃下消解.所有样品使用电感耦合等离子质谱(珀金埃尔默公司NexION 300)测定金属含量.金属累积通过鱼体肝脏干重计算(μg/g).
1.4 抗氧化系统分析
暴露结束后,每个浓度随机取3尾鱼肝脏,称重后于-80 ℃冷冻备用.测量时,每个样品加入样品体积4倍的0.75%NaCl溶液充分匀浆,4 ℃、2 500 r/min下离心15 min,取上清液.采用考马斯亮蓝法测定蛋白质含量,用生物试剂盒(南京建成)测定SOD,硫代巴比妥酸(TBA)法测定MDA含量.
1.5 数据处理
96 hLC50及其95%的置信区间使用Origin软件计算(8.0 SR4,OriginLab Corporation,USA),采用Shapiro-Wilk检验法进行数据正态分布检验,使用Friedmann ANOVA分析各处理间差异,满足正态分布和同质性假设的96 hLC50值进行单因素方差分析(Dunnett 检验),MDA和SOD值用非参数的Wilcoxon秩和检验,P<0.05为差异显著.
2 结果与讨论
2.1 镉对细鳞鲑的急性毒性
镉对细鳞鲑的24、48、72和96 hLC50及其95%置信区间见表1.在暴露浓度成倍增长的情况下,达到50%死亡率所需的暴露浓度并没有呈现相应变化,仅从1.15 mg/L降为0.69 mg/L.由此可见:在金属的致死性暴露中,暴露浓度对死亡率的影响强于暴露时间,这与张倩茹等[10]利用镉对沙蚕毒性作用的研究结果类似,即暴露时间和暴露浓度影响暴露结果,但暴露浓度的作用更明显.
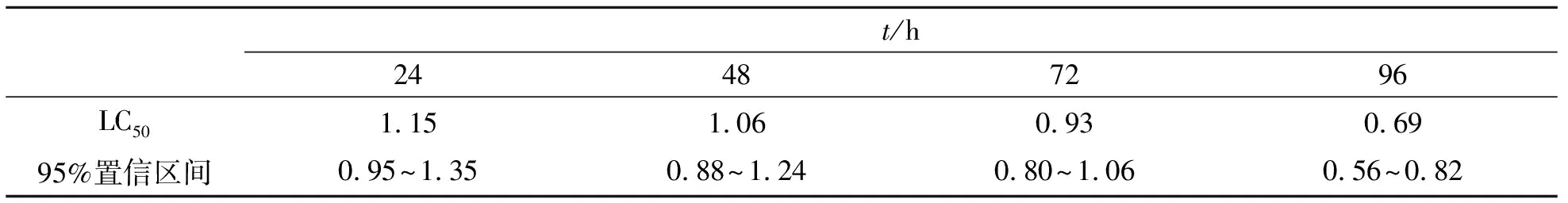
表1 镉对细鳞鲑24、48、72和96 hLC50及其95%置信区间
2.2 细鳞鲑肝脏内镉含量
细鳞鲑暴露于1/5或1/10 LC5048 h和96 h后肝脏镉浓度见图1,暴露中没有死亡.由图1可知:暴露显著改变了细鳞鲑肝脏内的镉含量,这与黄应平等[11]对镉的研究结果相似.与肌肉相比,在镉对鲢鱼幼鱼的暴露中,肝脏中镉累积受暴露的影响最显著.在赵艳民等[12]对铜暴露下日本青鳉体内的累积特征研究中也证实了肝脏是铜累积变化最明显的鱼体组织.由此可见,肝脏是细鳞鲑重金属暴露研究中的重要器官之一.
2.3 细鳞鲑肝脏内的MDA含量
细鳞鲑肝脏内的MDA含量见图2,结合肝脏细胞内的镉累积可知:无论是48 h还是96 h,1/10 LC50暴露下显著变化的镉含量并没有导致细胞内MDA的显著变化;而1/5 LC50暴露后,细胞内MDA含量明显增加.这可能与生物体可承受的毒性作用阈值有关,在该阈值下,有毒物质的累积并不能形成有害的毒性作用,而在该阈值以上,有毒物质的暴露才显现明显的毒性作用.万玉山等[13]研究了四溴双酚A和镉复合污染对不同生物体的安全阈值后指出,蚯蚓和斑马鱼四溴双酚A的安全阈值分别为0.95、0.44 mg/L,镉安全阈值分别为71.17、0.42 mg/L.
2.4 细鳞鲑肝脏内的SOD活性
细鳞鲑肝脏内的SOD含量见图3.由图3可知:对于SOD,无论暴露48 h还是96 h,1/10 LC50的镉暴露浓度明显增加了其活性,且在1/10 LC50的暴露浓度下,SOD的活性随暴露时间的增加而增加.1/5 LC50暴露浓度的48 h暴露SOD活性和对照没有明显区别,但明显低于1/10 LC50的48 h暴露;1/5 LC50暴露浓度的96 h暴露SOD活性明显低于对照和1/10 LC50暴露浓度.总体上,细鳞鲑肝脏内的SOD水平呈现先升高后降低的趋势,即暴露中SOD活性先激活升高然后受到抑制.这与GUAN等[14]对五氯酚暴露下鮈鲫(Gobiocyprisrarus)体内SOD的变化研究结果一致,即同为低浓度激活而高浓度抑制.这可能是由于SOD作为生物体抗氧化防御系统的“第一道防线”,在镉浓度较低时可以起到一定的防御作用,但在浓度较高时,造成蛋白质失活,作为酶性蛋白,SOD活性受到影响.结合暴露中细鳞鲑肝脏内MDA水平的变化,当SOD活性被激活时,即在1/10 LC50的镉暴露中,MDA水平没有明显升高,细胞抗氧化防御系统的保护作用使得细胞没有呈现明显的脂质化,而当暴露水平升高到1/5 LC50时,SOD活性受到抑制,细胞的抗氧化防御系统部分失效,MDA水平显著升高,细胞呈现一定的脂质化.
3 结 论
细鳞鲑是松花江流域著名的冷水性鱼类,更是松花江流域的代表性稀有鱼类.镉是松花江流域主要的重金属污染物,镉对细鳞鲑的毒性作用鲜有报道.本次研究显示:镉暴露可以造成细鳞鲑的氧化损伤,较高浓度下MDA变化明显.细鳞鲑的抗氧化防御系统在镉暴露中具有一定的保护作用,SOD可作为细鳞鲑镉暴露的生物标志物之一.本研究提供了镉对细鳞鲑抗氧化防御系统损伤的基础数据,但细鳞鲑抗氧化防御系统在镉作用下的调节、反馈机制,镉污染对细鳞鲑种群动态的影响以及镉污染生态系统中细鳞鲑的分布区域变化仍有待进一步研究.
