DRD2 基因多态性对汉族病人术后阿片药物镇痛剂量的影响*
2020-08-25柯雪茹王明春曹兴华
柯雪茹 雷 波 王明春 曹兴华
(新疆维吾尔自治区中医医院手术麻醉科,乌鲁木齐 830001)
阿片类药物是术后镇痛最主要的药物,在临床治疗中,个体间术后疼痛程度和阿片药物需求的差异会导致术后镇痛效果不佳[1]。国外有学者发现个体间术后疼痛敏感性和阿片类药物的用量的差异可以达到50 倍[2],这种巨大的个体差异是导致术后镇痛效果欠佳的主要原因。近年来,越来越多研究表明,基因多态性与疼痛敏感性和术后镇痛存在重要联系[3,4]。中枢多巴胺能通路是影响疼痛感知调控及阿片药物的主要作用通路,多巴胺可激活中枢不同部位的多巴胺受体,从而影响疼痛信号的处理和阿片类药物的作用,多巴胺受体2 (dopamine receptor D type 2, DRD2) 主要位于纹状体、伏隔核、中脑导水管周围灰质,是黑质纹状体多巴胺能神经元的主要靶点[5,6],为了进一步了解DRD2 受体基因多态性与术后疼痛治疗的关系,本研究以汉族术后疼痛病人为研究对象,分析术前疼痛敏感度和术后镇痛及阿片类药物消耗与多巴胺受体D2 基因多态性的关系,由于目前尚无多巴胺受体D2 基因多态性对疼痛敏感及术后疼痛影响的研究报道,本研究可为术后疼痛病人镇痛个体化治疗提供新的思路。
方 法
1.一般资料
本研究通过新疆维吾尔自治区中医医院伦理委员会批准,且实验方法及实验过程中可能出现的不适均提前告知病人,所有入组病人或其家属均已签署知情同意书。本研究选取2018 年2 月至2018 年9 月在我院行择期上腹部手术的汉族病人。
纳入标准:美国麻醉医师学会 (American Society of Anesthesiologists, ASA) I-II 级;年龄:20~70 岁;男女不限;择期上腹部手术,主要包括胃癌根治术、肝段切除术、Whipple 手术等;汉族。
排除标准:手术后因并发症3 个月内再次手术者;有长期服药史;慢性疼痛;严重心肺功能障碍;严重肝肾功能障碍;不合作者;抑郁症;其他精神神经功能障碍。
临床资料收集:记录病人年龄、性别、手术时间、切口长度、体质量等基本信息。本研究共入组133 例病人,男性77 例(57.9%),女性56 例(42.1%),年龄范围为20~65 岁,平均年龄(47.1±8.4)岁,体重(62.3±7.7) kg。
2.仪器与试剂
PCR 仪和台式高速离心机(美国Eppendorf 公司)、核酸纯化试剂盒(上海生工生物工程有限公司)、Taq DNA 聚合酶和限制性内切酶[宝日医生物技术(北京)有限公司]。
3.方法
(1)试验性疼痛评估:在设有抢救措施的治疗室内完成试验性疼痛测试,通过压力测试仪逐渐以1 kg/s 匀速递增的压力刺激1 cm2固定测试区域,测试区域为病人右前臂内侧腕横纹上2 cm处。根据病人表述,记录病人首次感觉到疼痛压迫时的压力数值,记为压力痛阈 (pressure pain threshold, PPT),以及病人感觉到疼痛无法耐受时的压力数值为压力耐痛阈 (pressure pain tolerance, PTO)。重复3 次测试,每次间隔30 min,计算并记录均值。
(2)术后镇痛:所有病人均采用气管内静吸复合全身麻醉,术后将病人送入麻醉恢复室,拔出气管插管,视觉模拟评分法(visual analogue scale, VAS)评分3 分以下病人给予自控镇痛(patient controlled analgesia, PCA):舒芬太尼0.4 μg/ml 和盐酸昂丹司琼 8 mg 溶解于250 ml 0.9% 氯化钠注射液中,再正确接入静脉输注管线,安装好输注装置,设置参数前校准时间并清除所有历史记录,设置负荷量为25 ml,背景输注速度为4 ml/h,PCA 剂量为4 ml,锁定时间为15 min,记录每个病人所用电子泵的序列号以备查验。
(3)术后疼痛评估:使用VAS 进行术后疼痛评估,术后48 h 内通过VAS 评分对病人术后6 h、12 h、24 h 及48 h 疼痛程度进行评分。
(4)基因型检测方法:病人入手术室完成静脉置管后采集静脉血8 ml 加入EDTA 抗凝的无菌真空管,标记编号后储存于-20℃冰箱保存,采用聚合酶链式反应 (polymerase chain reaction, PCR) 分析DRD2 (rs6276、rs4274224)基因多态性。具体实验步骤:外周血DNA 提取(Ezup 柱式血液基因组DNA 抽提试剂盒,B518253,上海生工生物工程股份有限公司)、纯化和保存DNA、DNA 浓度值测定、PCR 扩增-琼脂糖凝胶电泳检测PCR [PrimeSTAR®HS DNA Polymerase, R010A,宝日医生物技术(北京)有限公司]、酶切和基因分型(SanPrep 柱式PCR产物纯化试剂盒,B518141,上海生工生物工程股份有限公司)、琼脂糖凝胶电泳检测酶切产物、结果分析和统计。
4. 统计学分析
数据采用SPSS 20.0 软件包进行分析,用Hardy-Weinberg 平衡检验样本群体代表性,采用均数±标准差(x±SD)及频率的形式对所有变量进行统计描述,DRD2 基因的2 个多态性位点(rs6276 和rs4274224)的基因型和等位基因频率差异比较采用卡方检验。P < 0.05 为差异有统计学意义。
结 果
1.病人一般资料
分别对不同DRD2 rs6276 和rs4274224 基因型病人术前一般情况进行统计(见表1)。133 例不同基因型病人间的年龄、性别、身高、体重和体质指数(body mass index, BMI)无显著性差异(P > 0.05,见表1)。
2.基因型检测结果
根据Hardy-Weinberg 平衡检验,DRD2 rs6276和rs4274224 基因型分布表达符合遗传平衡,样本具有群体代表性。rs6276 和rs4274224 两个多态性位点基因型和等位基因频率的分析如下(见表2)。
3.不同基因型PPT 和PTO 检测结果
如表3 所示,术前不同DRD2 rs6276 基因型病人PPT 和PTO 差异有显著性(P < 0.05),A/G 及G/G基因型病人的PPT 和PTO 均低于A/A 基因型。同时分析rs4274224 基因型分布与PPT、PTO 值间的关系,说明各基因型病人PPT 和PTO 值无显著性差异(P > 0.05),DRD2 rs4274224 基因多态性可能与疼痛敏感性无关。
4.术中使用的阿片药物总量比较
rs6276 不同基因型术中使用的阿片药物总量比较,A/A 基因型病人术中阿片用量(414±39 μg)低于A/G (476±46 μg)及G/G (489±57 μg)基因型,差异具有统计学意义(P < 0.05)。rs4274224 不同基因型术中使用的阿片药物总量分别为A/A 基因型(466±62 μg)、 A/G 基因型(471±53 μg)及G/G 基因型(479±47 μg),各组基因型的术中阿片用量差异无统计学意义(P > 0.05)。
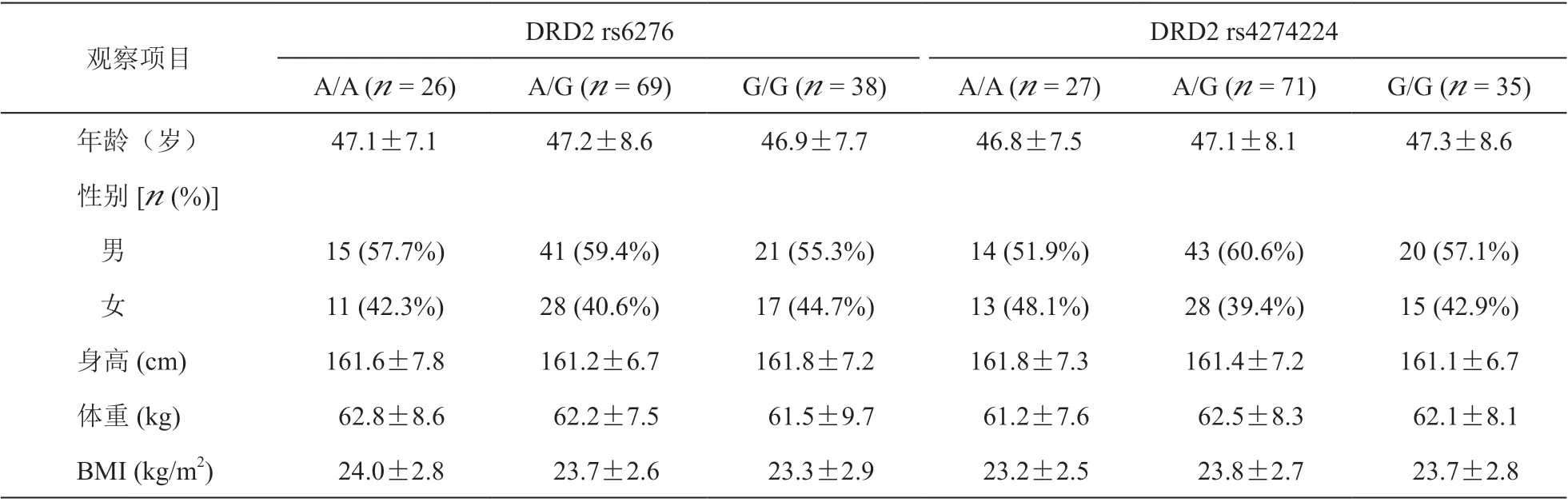
表1 DRD2 rs6276 和DRD2 rs4274224 不同基因型病人的一般资料(x±SD)
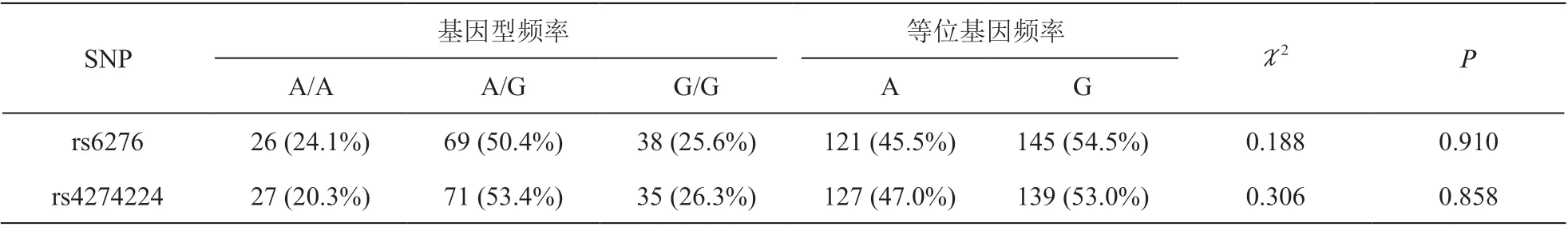
表2 DRD2 rs6276 和rs4274224 多态性位点的基因型和等位基因频率(x±SD)
5.不同基因型病人术后疼痛程度、阿片剂量及镇痛不全比例
如表4 所示,rs6276 A/A 基因型病人携带术后6 h、12 h、24 h 及48 h VAS 评分均显著低于其他基因型病人(P < 0.05)。从表5 中数据可看出,rs4274224 三种基因型病人术后6 h、12 h、24 h、48 h VAS 评分间无统计学差异(P > 0.05)。rs6276 不同基因型阿片用量及镇痛不全比例比较,A/A 基因型病人术后阿片用量及镇痛不全比例均低于A/G及G/G 基因型,差异具有统计学意义(P < 0.05)。rs4274224 不同基因型阿片用量及镇痛不全比例比较,差异无统计学意义(P > 0.05)。
讨 论
多巴胺可激活中枢不同部位的多巴胺受体,从而影响疼痛信号的处理和阿片类药物的作用,多巴胺受体2 (DRD2) 主要位于纹状体、伏隔核、中脑导水管周围灰质,是黑质纹状体多巴胺能神经元的主要靶点[5,6]。健康人群中枢神经系统的功能核磁和PET 的研究发现伏隔核的DRD2 与试验性疼痛的严重程度有关,DRD2 活性越高疼痛程度越轻[7]。动物实验和临床研究表明多巴胺能通路基因变异与实验性疼痛、临床急慢性疼痛及阿片类药物需求有关,如多巴胺D2 受体可通过TNF-α 依赖的KLF15 因子表达增强神经性疼痛,而通过对初级运动皮质区进行刺激,多巴胺D2 受体还可在疼痛下行控制中发挥重要作用[8~10]。
DRD2 基因定位于染色体11q22-23,以往关于DRD2 rs6276 多态性的研究较多集中在基因型与精神疾病、抑郁[11,12]等方面,而上述基因型与术后疼痛的相关研究较少。在本研究的133 例病人中,rs6276 A、G 等位基因和三种基因型的分布频率符合Hardy-Weinberg 遗传平衡法则,处于Hardy-Weinberg 平衡状态,说明本研究所选样本人群具有一定代表性,与冯国华等[13]曾报道汉族人群DRD2 rs6276 多态性中A、G 等位基因的分布频率和各基因型的分布频率相近,但由于受试者性别、地域及样本数量均有差别,与文献结果比较,相同基因型的分布频率与会存在一定差异。采用适当方法进行术前筛查,有助于预测术后疼痛并进行有针对性的镇痛管理,尤其是对那些可能经历严重术后疼痛的高风险病人,可以极大改善镇痛效果。为了便于筛选可能出现严重术后疼痛的高风险人群,可以对病人进行术前PTT 及PTO 测试,作为术后镇痛管理的参考指标,在本研究中,通过术前测定试验性疼痛对rs6276 基因多态性疼与痛敏感性的关系进行分析发现,A/A 基因型病人PPT 及PTO 显著低于A/G 和G/G 基因型,各基因型术前PPT 和PTO与术后VAS 评分均呈负相关,病人术前PPT 和PTO越高,术后疼痛程度越低。Jääskeläinen 等[14]发现DRD2 基因多态性可以影响热敏感及疼痛敏感性,并且与神经性疼痛的易感性有关,多巴胺系统及DRD2 受体在疼痛和镇痛中起到了重要作用。Qadri等[15]在一项包含948 例病人的研究中发现,DRD2 rs6276 基因多态性与急性疼痛存在关联,其中A/A基因型病人的疼痛评分要显著低于A/G 和G/G 基因型。本研究使用阿片类药物的133 例病人中,A/A基因型(26 例)病人阿片药物剂量低于A/G 基因型(69 例)和G/G 基因型(38 例),差异有统计学意义,表明携带G 等位基因的病人疼痛较A 基因型难以控制,说明DRD2 rs6276 基因型可影响术后疼痛病人阿片药物需求量。

表3 rs6276 和rs4274224 三种基因型病人PPT 和PTO 比较(x±SD)
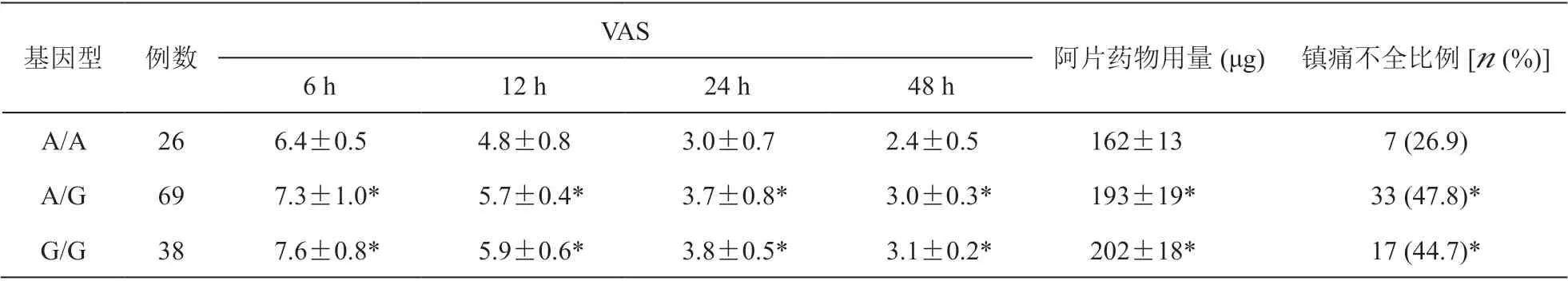
表4 rs6276 不同基因型病人术后VAS、阿片剂量及镇痛不全比例的比较(x±SD)
与DRD2 rs6276 相似,目前关于多巴胺 D2 受体rs4274224基因多态性与术后疼痛相关研究较少,已有研究多与抑郁、情绪控制[16,17]等有关。在本研究的133 例病人中,rs4274224 A、G 等位基因和三种基因型的分布频率分布符合Hardy-Weinberg 遗传平衡法则,处于Hardy-Weinberg 平衡状态,说明本研究所选样本人群具有一定代表性。同时,比较rs4274224 不同基因型病人PPT 和PTO 间差异,显示rs4274224 不同基因型病人PPT 和PTO 无显著差异。在一项关于镰刀状细胞贫血症的研究中,Wonkam 等发现DRD2 rs4274224 基因多态性与急性疼痛危象有关[18],但是在本研究中rs4274224 三种基因型病人在术前PPT 和PTO 检测、术后疼痛得分及镇痛不全比例的差异均无统计学意义。上述结果说明DRD2 rs4274224 基因多态性与疼痛敏感和术后镇痛无相关性,这可能与遗传背景的差异有关,也有可能是由于样本量太小造成。今后研究中还需要采用更大的样本,对该位点与疼痛敏感和术后镇痛的关系进行验证。
本研究主要探究DRD2 (rs6276、rs4274224) 基因多态性、疼痛敏感与阿片镇痛剂量的关系。研究发现,DRD2 rs6276 的三种基因型中,A/A 型病人比A/G 型和G/G 型病人痛耐受阈更高,所需阿片镇痛剂量更少,说明rs6276 基因多态性与疼痛敏感性相关,可能影响病人术后阿片镇痛剂量。本研究对于术后疼痛的个性化治疗具有重要价值,可作为术后疼痛个体化用药的参考,但仍需要大样本、多因素的深入研究,对不同病人的心理健康、术前焦虑及手术中失血等多种因素进行统计分析,从而进一步探究DRD2 基因多态性对疼痛敏感及术后阿片镇痛的影响。
