SPME/SDE-GC-MS分析宁德养殖大黄鱼挥发性化合物
2020-08-24魏育坤魏好程伍菱杨燊邱绪建黄志勇倪辉
魏育坤,魏好程,伍菱,2,3,杨燊,4,邱绪建,4,黄志勇,倪辉,2,3,*
(1.集美大学食品与生物工程学院,福建厦门361021;2.水产品深加工技术国家地方联合工程研究中心,福建厦门361021;3.福建省食品微生物与酶工程重点实验室,福建厦门361021;4.厦门市食品生物工程技术研究中心,福建厦门361021)
大黄鱼(Larimichthyscrocea),鲈形目(Perciformes),石首鱼科(Sciaeni-dae),黄鱼属,别名黄鱼、大黄花鱼、黄瓜鱼等,是传统“四大海产”之一,我国近海主要经济鱼类[1]。大黄鱼是我国养殖规模最大的海水鱼,养殖主要集中在福建宁德,2018年大黄鱼产量高达14万吨,占全国总产量的70%,总产值超百亿元。大黄鱼肉嫩味美、富含蛋白质、微量元素和维生素,对体质虚弱的人具有很好的食疗效果,由于具有令人愉快的风味,深受消费者的喜爱[2]。除食用新鲜的大黄鱼外,大黄鱼已被加工成黄鱼鲞、酒糟黄鱼等加工产品。相关研究表明,鱼肉中的挥发性化合物复杂,种类繁多,不仅对鱼肉风味起着重要的影响[3],而且是反映鱼新鲜程度[4]及进行品质溯源的重要指标[5];因此,对大黄鱼的挥发性成分进行检测、监控具有重要的意义。
目前,萃取鱼类挥发性物质的手段主要包括:同时蒸馏萃取(simultaneous distillation-extraction,SDE)[6]、固相微萃取(solid-phase microextraction,SPME)[6]、超临界流体萃取 (supercritical fluid extraction,SFE)[7]和溶剂辅助风味蒸发萃取(solvent assisted flavour evaporation,SAFE)[8]等。其中,SPME技术是具有无溶剂性、操作简便、高效和灵敏度高等特点[9],是目前最常用手段之一;但是SPME技术偏向于提取低沸点的挥发性化合物,对高沸点物质的提取效率低。SDE技术融合了水蒸气蒸馏和有机溶剂萃取两种技术,提取的物质侧重于对中、高沸点的化合物[10],这一优点弥补SPME技术上的缺点。因此,国内外学者常采用SPME和SDE相结合的方法提取样品中的挥发性化合物。Chang等[6]利用SDE和SPME两种方法提取鳕鱼中挥发性化合物,发现SDE提取得到24种挥发性成分,SPME提取得到69种挥发性成分,其中SDE和SPME提取成分中有10种相同成分。徐永霞等[11]采用SPME结合SDE法从猪肉汤中提取出77种挥发性风味成分,其中SPME检测出醛类物质较多,SDE检测到醇类和酯类较多。上述研究表明,SPME法和SDE法对不同种类化合物的萃取能力存在差异,两种方法结合分析同一样品挥发性化合物,可以更加全面的反映样品的风味成分。研究学者通常采用气相色谱-质谱联用(gas chromatography-mass spectrometry,GC-MS)、气相色谱-质谱/嗅闻[12](gas chromatography-mass spectrometry/olfactometry,GC-MS/O)、气相色谱-火焰离子化检测器[13](gas chromatography-flame ionization detector,GCFID)、飞行时间质谱联用[14](time-of-flight mass spectrometry,TOF-MS)等技术分析食品中挥发性化合物。其中,气相色谱-质谱联用技术操作简单且分离效果好,被广泛的用于检测食品中复杂挥发性化合物。
近几年,已有研究学者研究大黄鱼的挥发性化合物。杨茗媛等[15]利用电子鼻和SPME-GC-MS对大黄鱼的挥发性成分进行了分析,表明新鲜大黄鱼的腥味物质主要是己醛、庚醛和辛醛,并且伴随着对大黄鱼加热温度的升高,腥味物质呈现减少趋势。徐军方等[16]利用电子鼻和SPME-GC-MS对比不同冷藏条件下大黄鱼风味的变化,发现低温冻藏可以有效保留大黄鱼的风味。Mu等[17]利用SPME-GC-MS分析野生大黄鱼与养殖大黄鱼挥发性化合物的差异,研究发现与野生大黄鱼相比,养殖大黄鱼醛类和烃类物质的含量高,酯类物质含量较低;同时发现,区别野生大黄鱼与浙江宁波养殖大黄鱼的主要成分是辛醛和1-辛烯-3-醇,但大黄鱼的挥发性成分尚未得到充分鉴定。
本研究以我国大黄鱼主产区--福建宁德市养殖的冻鲜大黄鱼为研究对象,采用的SPME和SDE两种方法对大黄鱼中挥发性化合物萃取,并结合GC-MS和相对气味活度值(relative odor activity value,ROAV)进行分析研究,鉴定大黄鱼的主要挥发性成分,尤其是香气贡献成分,为全面了解大黄鱼风味品质及建立溯源技术提供科学依据。
1 材料与方法
1.1 材料与试剂
冻鲜大黄鱼:宁德市横屿岛水产有限公司,经宰杀、去内脏,其个体长约30 cm、重500 g左右。
环己酮、正构烷烃(C8-C40)、乙醇、正己烷(色谱级):Sigma公司。
1.2 仪器与设备
QP-2010 Plus气相色谱质谱串联仪、Rtx-5MS(30 m×0.25 mm,0.25 μm) 色谱柱、65 μm CAR/PDMS萃取头:日本岛津公司;57330-U手动SPME进样器:美国Supelco公司;Likens-Nickerson同时蒸馏萃取装置:郑州鑫瑞化验厂;HH-1数显恒温水浴锅:国华电器有限公司;XB-CPJ高速多功能粉碎机:永康市久品工贸有限公司。
1.3 试验方法
1.3.1 大黄鱼样品前处理
冻鲜大黄鱼在流水的条件下解冻约2 h,去掉鱼头、鱼鳍、鱼鳞、黑皮和主骨,用绞肉机捣碎鱼肉,并分装,置于-18℃的环境下保藏,备用。
1.3.2 SPME提取大黄鱼挥发性化合物方法
SPME法提取挥发性化合物方法参照相关的文献[18],准确称取10 g冻鲜大黄鱼置于50 mL的顶空瓶,加入10 mL的蒸馏水和10 μL浓度为1 mg/mL的内标物环己酮,密封顶空瓶,置于70℃的水浴锅中平衡30 min。将经250℃老化后的萃取头通过瓶盖插入顶空瓶中,萃取头暴露在顶空瓶的顶空位置,吸附30 min。吸附结束后,迅速将萃取头插入GC-MS进样口,解吸3 min,由GC-MS进行后续的分析鉴定。
1.3.3 SDE提取大黄鱼挥发性化合物方法
SDE法提取挥发性化合物方法参考文献[19],准确称取50 g经搅碎的冻鲜大黄鱼肉样和200 mL的蒸馏水于1 000 mL的圆底烧瓶,量取100 mL正己烷于500 mL的平底烧瓶,将两个烧瓶分别连接在同时蒸馏萃取装置的两端,并采用电热套进行加热。通过控制两边电压,达到同时沸腾的状态,整个萃取的过程时长80 min。收集萃取液,添加过量的无水硫酸钠,去除萃取液中多余的水分,静置过夜,经旋转蒸发仪浓缩至1 mL,密封,置于-18℃的环境下保存。GC-MS分析前,取100 μL样品,用正己烷稀释4倍,加入1 μL浓度为1 mg/mL的内标物环己酮,进样量1 μL进行GCMS分析。
进行数字线划图工作的开展时,一般采用全数字摄影测量工作站的方式完成测量任务,同时运用有关图像编辑软件予以编辑处理,确保具体的格式为DWG。此过程中应做到下述几点:其一,开展地形图测绘时,应建立与数字匹配的地面模型,并明确具体方向。而此环节中出的差异,由于运用了自动交互操控的方式,因此需以具体操控步骤予以科学安排测量工作内容,让误差处于可控状态下;第二,测绘地形图以前,应保证定位的科学性,让各个因素均存在相应准确的线型、颜色和标准的代码;第三,采用加大地形图测绘人员培训力度的方式,提升其专业能力,让所采集的地物和地貌信息误差率得以下降,达到最小的目的。
1.3.4 GC-MS分析大黄鱼挥发性化合物条件
色谱条件:气相色谱柱为Rtx-5MS色谱柱(30 m×0.25 mm,0.25 μm)。载气为高纯氦气(纯度99.999%),柱流量3 mL/min,不分流进样。
升温程序:进样口温度为220℃,初始温度50℃保持5 min,以6℃/min的速度升温至250℃保持5 min。
质谱条件:离子源温度230℃,电离方式EI,电离能量70 eV,接口温度250℃,扫描方式设为SCAN模式进行定性分析,离子碎片的扫描范围m/z 35~450。溶剂延迟时间2.5 min。定量分析时质谱扫描方式设为SIM模式。
1.4 挥发性化合物的定性分析
对比质谱数据库(NIST08、NIST08s、FFNSC1.3)进行相似度检索,根据不同化合物的基峰、质荷比进行串联检索与人工解析,化合物鉴定标准为其质谱匹配度大于80%。计算待测化合物的保留指数并与文献中报道的保留指数对比定性。保留指数的计算参照Kratz和Vandendool[20]的方法:
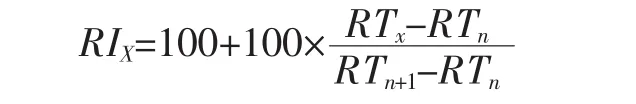
式中:RIX为目标化合物的保留指数;RTx为目标化合物的保留时间,min;RTn+1、RTn为目标化合物出峰前后相邻两个正构烷烃的出峰时间,min。
1.5 挥发性化合物的定量分析
定量分析采用内标法进行定量,根据环己酮的浓度估算待测物的含量,计算公式为:

1.6 相对气味活度值法(ROAV)确定大黄鱼关键香气成分
参照刘登勇等[21]的方法,大黄鱼关键香气成分采用ROAV值进行评价,定义对香气贡献最大的组分为ROAVs=100,其他挥发性化合物的ROAV值计算公式如下:
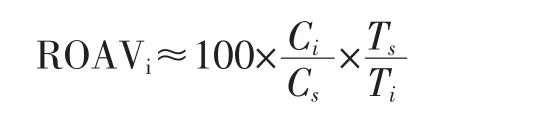
各挥发性化合物的ROAV≤100,本研究认为ROAV≥1的挥发性化合物是大黄鱼的关键香气成分,0.1≤ROAV<1的挥发性化合物对大黄鱼整体的风味有修饰作用[22]。
1.7 统计分析
通过Microsoft Office Excel 2010软件计算试验数据的平均值和标准偏差,并绘制柱形图。
2 结果与分析
2.1 SPME和SDE提取大黄鱼中挥发性化合物定性分析
采用SPME和SDE两种方法提取大黄鱼中的挥发性化合物,结合GC-MS分析,得到的总离子流图如图1所示。

图1 大黄鱼SPME和SDE提取物中挥发性化合物的总离子流图Fig.1 Total ion current chromatogram of volatile compounds of SPME and SDE extracts from large yellow croaker
从图1发现,SPME出峰靠前且较集中,而SDE出峰分布广泛且后期出峰多,说明SPME法适用于提取低沸点的挥发性化合物,SDE法适合提取中、高沸点的挥发性化合物。这个现象与Li等[23]采用SPME和SDE对草鱼汤挥发性化合物的出峰情况相似。
根据相似度检索、特征离子碎片分析以及参照相关文献,鉴定结果如表1所示。
由表1可知,SPME提取到29种挥发性化合物,包括醛类12种、醇类3种、酮类3种、芳香烃化合物4种、烃类5种和酯类2种;SDE提取到26种挥发性化合物,包括醛类6种、醇类2种、酮类5种、烃类2种、酯类4种和其他类7种;两种方法共同提取到6种挥发性化合物,分别为壬醛、癸醛、反,反-2,4-癸二烯醛、2-十一碳烯醛、2,6,10,14-四甲基-十五烷、十六烷酸乙基酯。SPME-GC-MS前期检测到己醛、反,反-2,4-庚二烯醛、辛醛和反-2-辛烯醛沸点很低,但是SDE-GC-MS中未检测到;SDE-GC-MS后期检测到2,4-二-叔丁基苯酚、棕榈酸、十六碳酰胺、油酸酰胺、硬脂酸酰胺和芥酸酰胺,其沸点普遍很高,在SPMEGC-MS中未检测到,这可能是SDE萃取是在高温下反复蒸煮进行的,对低沸点化合物萃取能力弱[24]。SPME和SDE两种方法提取大黄鱼挥发性化合物经GC-MS检测,共鉴定出7大类49种挥发性化合物,相关学者[2]采用SPME提取养殖大黄鱼挥发性化合物,检测出39种挥发性化合物,说明两种方法提取大黄鱼挥发性化合物更全面。
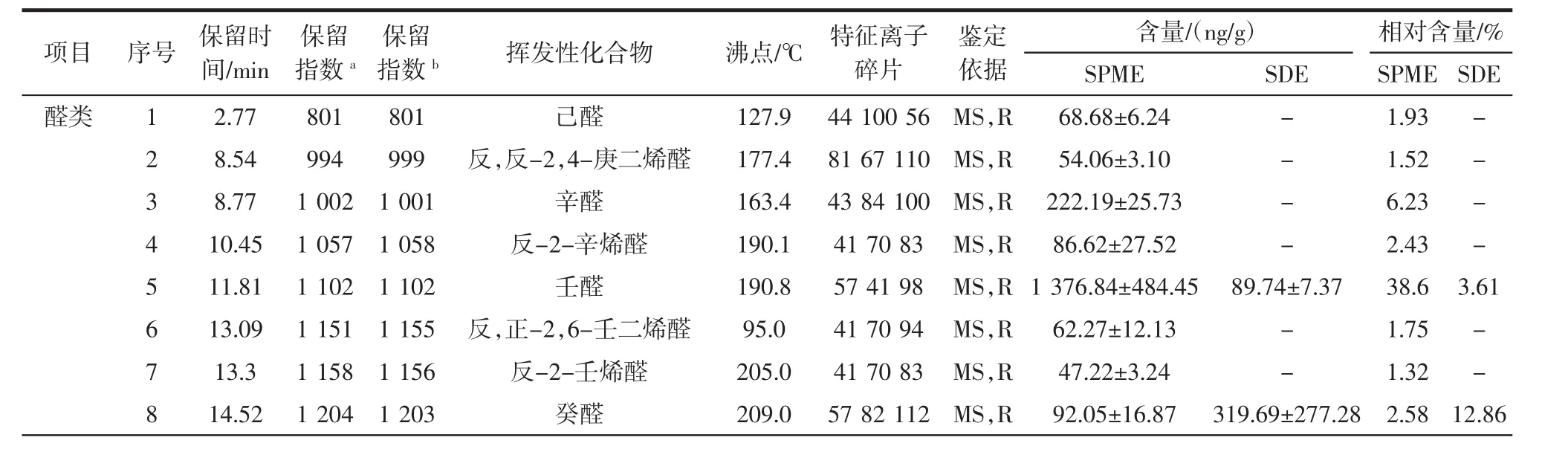
表1 大黄鱼SPME和SDE提取物中挥发性化合物鉴定结果Table 1 Identification of volatile compounds of SPME and SDE extracts from large yellow croaker
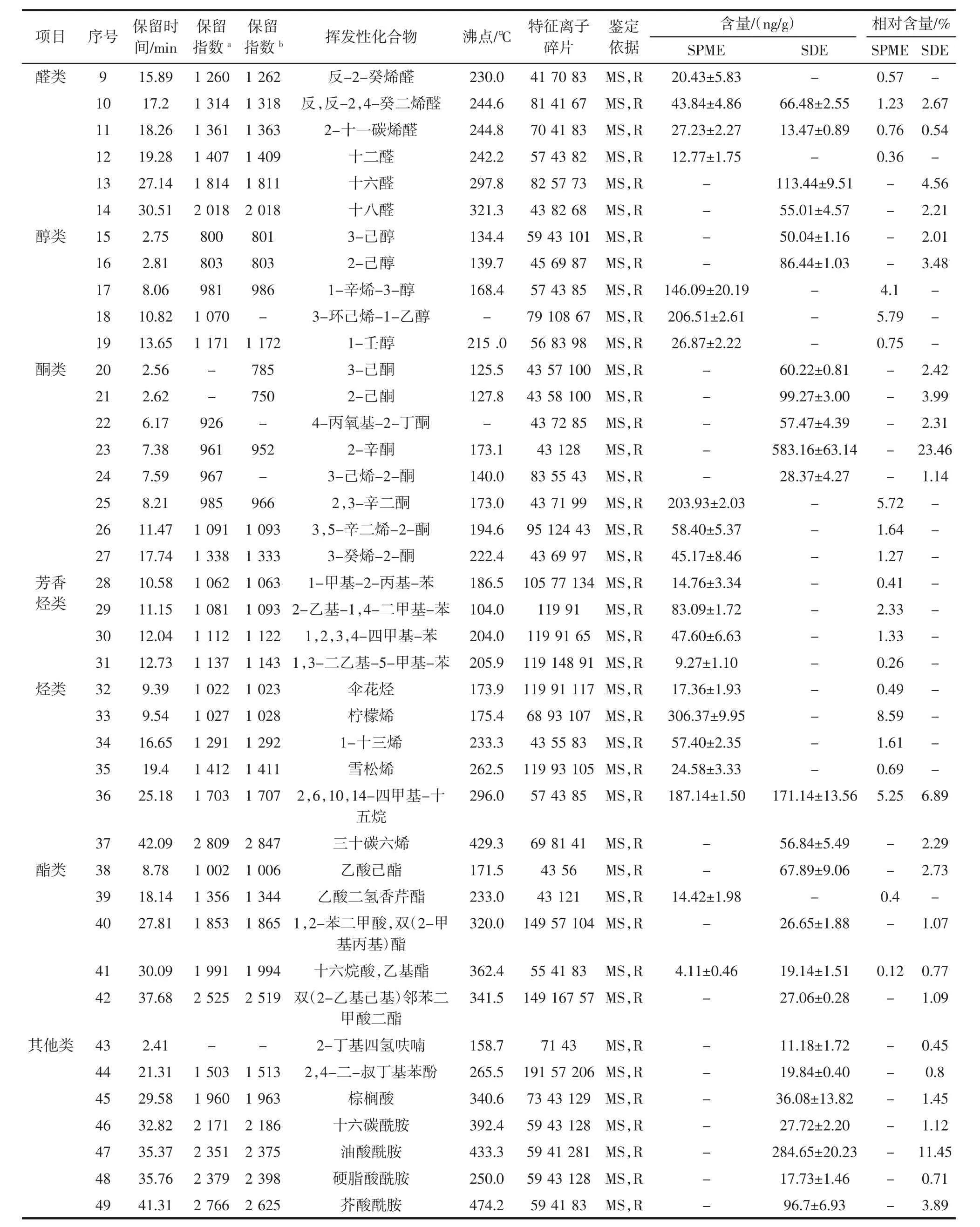
续表1 大黄鱼SPME和SDE提取物中挥发性化合物鉴定结果Continue table 1 Identification of volatile compounds of SPME and SDE extracts from large yellow croaker
2.2 SPME和SDE提取大黄鱼中挥发性化合物定量分析
根据内标法计算各挥发性化合物的浓度和相对含量,结果如表1所示,各类化合物的相对含量如图2所示。

图2 SPME和SDE提取大黄鱼挥发性化合物的类别含量图Fig.2 Classification of volatile compounds of SPME and SDE extractions from large yellow croaker
从图2中发现,SPME和SDE两种方法结合GC-MS检测到同类挥发性化合物的相对含量具有明显的差异,SPME-GC-MS检测到相对含量最多的化合物是醛类(59.27%),其次是烃类(16.62%)、醇类(10.64%)、酮类(8.62%)、芳香烃(4.34%)和酯类(0.52%),SDE-GC-MS检测到相对含量最多的化合物是酮类(33.55%),其次是醛类(26.38%)、烃类(9.14%)、酯类(5.64%)、醇类(5.47%)和其他类(19.81%)。此现象表明SPME对醛类、醇类、烃类和芳香烃化合物提取效果好,而SDE对酮类和酯类化合物提取效果好。因此,采用两种方法结合分析,避免单一的提取手段对不同种类挥发性化合物的选择性,对大黄鱼中的各类挥发性化合物定量更充分。
从表1可知,SPME提取大黄鱼含量最高的挥发性化合物是壬醛(1 376.84 ng/g),但经SDE提取到壬醛含量较低(89.74 ng/g),杨茗媛等[15]在研究浙江舟山市养殖大黄鱼的背部挥发性化合物发现,壬醛的含量最高(1 452.10 ng/g),并且随着温度的升高,含量呈现下降的趋势。SDE提取到含量最高的挥发性化合物是2-辛酮(583.16 ng/g),该物质在相关学者[18]采用 SPME提取大黄鱼风味的研究中未被发现。SPME提取癸醛、反,反-2,4-癸二烯醛和十六烷酸乙基酯的浓度比SDE提取的浓度低,可能是萃取头吸附面积有限引起的[25]。SPME提取2-十一碳烯醛的含量比SDE提取的含量高,从7.23 ng/g降至13.47 ng/g,在相关学者[16]对大黄鱼的挥发性化合物研究中未被报道。
上述研究表明,SPME和SDE两种方法对提取的挥发性化合物存在一定的选择性,两种方法结合GCMS分析大黄鱼的挥发性化合物,可以更加全面的了解挥发性成分信息。
2.3 大黄鱼的关键香气成分分析
挥发性化合物对大黄鱼的贡献程度取决于它在样品中的相对含量和感官阈值。根据相关文献已报道的香味阈值,计算各挥发性化合物的ROAV值,结果如表2所示。
由表2可知,SPME提取大黄鱼的挥发性化合物,得到9种关键的香气成分以醛类、醇类和烃类为主,ROAV值由高到低依次为:辛醛、壬醛、反-2-辛烯醛、反,反-2,4-癸二烯醛、1-辛烯-3-醇、反,正-2,6-壬二烯醛、反-2-癸烯醛、癸醛和柠檬烯,对大黄鱼风味有修饰作用的挥发性化合物是反-2-壬烯醛、己醛、十二醛和反,反-2,4-庚二烯醛。SDE提取大黄鱼的挥发性化合物,得到3种关键的香气成分,以醛类为主,分别是反,反-2,4-癸二烯醛、癸醛和壬醛,对大黄鱼风味有修饰作用的挥发性化合物是2-己酮。
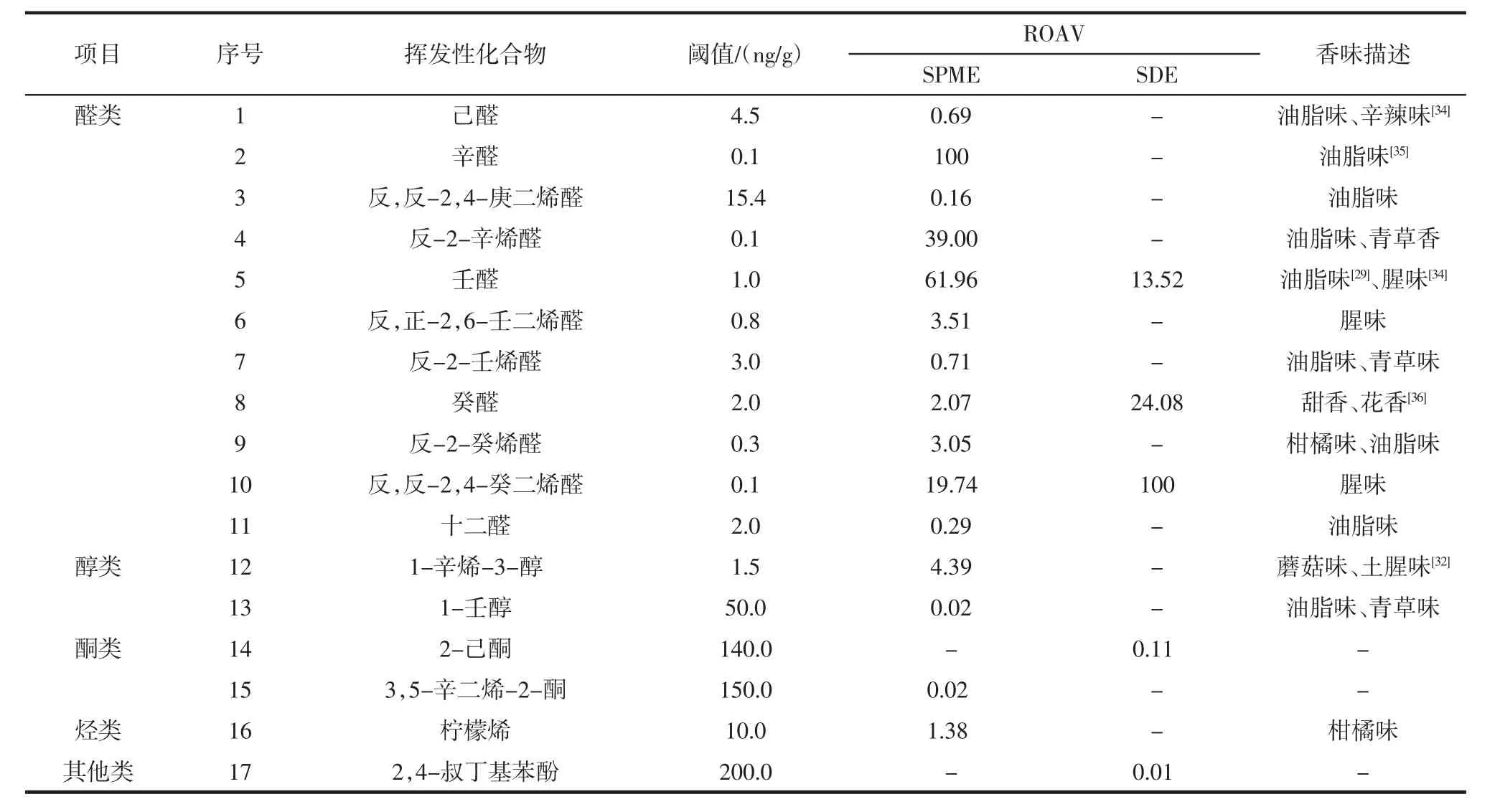
表2 SPME和SDE提取大黄鱼挥发性化合物的相对气味活度值Table 2 Relative odor activity value(ROAV)of volatile compounds of SPME and SDE extractions from large yellow croaker
醛类物质主要来源于脂肪组织发生氧化反应,且该类物质的阈值较低[26],对鱼体的风味影响颇大,被认为是鱼肉的主要风味。辛醛[27]、壬醛[27]、反,反-2,4-癸二烯醛[28]是油酸氧化的产物和亚油酸经氧化成氢过氧化物裂解的产物,辛醛具有油脂味,壬醛具有油脂味、腥味,反,反-2,4-癸二烯醛具有油脂味;癸醛是氨基酸降解的产物[29],具有甜香和花香;其它醛类的关键香气成分是反-2-辛烯醛、反,正-2,6-壬二烯醛和反-2-癸烯醛,主要呈现油脂味和腥味。醇类物质是脂质氧化、氨基酸代谢的产物[30],不饱和醇类物质阈值较低[31],对大黄鱼的风味有影响。SPME提取的不饱和醛类物质1-辛烯-3-醇[32]由亚油酸经氧化为氢过氧化物裂解的产物,且具有土腥味和蘑菇味,且该物质普遍存在于鱼的挥发性化合物中。烃类物质可能是类胡萝卜素的分解产物[33],SPME提取的关键香气成分柠檬烯呈现柑橘味。
3 结论
本研究采用SPME和SDE结合GC-MS分析大黄鱼挥发性化合物,共检测出49种挥发性化合物,其中SPME法29种,SDE法26种。两种方法对不同种类挥发性化合物提取能力不同,SPME提取的挥发性化合物以醛类、醇类、烃类和芳香烃化合物为主,SDE提取的挥发性化合物以酮类和酯类化合物为主。SDE提取到2-十一碳烯醛和2-辛酮在相关研究中未被报道。经ROAV分析确定了9种关键香气成分,对大黄鱼风味贡献较大的物质是辛醛、壬醛、反-2-辛烯醛和反,反-2,4-癸二烯醛。通过两种方法提取大黄鱼挥发性化合物与单一的提取方法对比得知,两种方法提取的挥发性化合物更全面、更准确,该结果为全面了解大黄鱼风味品质及建立溯源技术奠定基础,之后需要结合嗅闻技术及香气重组进一步确定大黄鱼的香气构成。
