自组装原花青素纳米复合物的构建及表征
2020-08-24吴雪娇吴艳李旭娇郭锐刘鑫盛漪
吴雪娇,吴艳,李旭娇,郭锐,刘鑫,盛漪
(上海交通大学农业与生物学院上海食品安全工程技术研究中心,上海200240)
原花青素(Proanthocyanidin)是一类含双黄酮衍生物的天然多酚类化合物的总称,由儿茶素、表儿茶素和没食子酸结合而成。原花青素中较多的酚羟基以及其特定的分子立体化学结构、聚体之间的协同作用使其具有极强的抗氧化活性,是一种具有发展前景的化学抗氧化剂的替代品[1]。在医药领域,摄入原花青素不仅可以预防氧化应激引起的疾病,如心血管疾病等,还可用于抗溃疡、抗炎和抗癌[2]。但是,原花青素在应用中存在一定的局限性,主要包括以下几个方面:1)不适宜的风味(苦涩味);2)对环境条件(酸碱度、氧气、温度和光)敏感[3-4];3)酚羟基结构易于氧化;4)生物利用度低,半衰期短[5]。
纳米载体系统可以用来提高原花青素的生物利用度,起到保护及靶向运输的作用[6-7],充分发挥原花青素的抗氧化活性。自组装技术是指在平衡条件下,两亲性聚合物通过非共价键作用,自发缔结成热力学稳定、具有核壳结构的纳米粒的过程,它具有操作简便,不需要使用有机溶剂的优势。为了可以口服使用并尽量减少载体诱导的不良细胞毒性,食品级大分子是生物聚合物的最佳选择,它们不仅具有生物降解性和生物相容性,而且还可以发挥特殊的生物功能。
酪蛋白是牛奶中的一种伸展性蛋白,其独特的伸展结构能够平衡高净电荷和低内疏水性,与多酚的结合力强。但是酪蛋白在水中溶解性较低,酪蛋白-多糖自组装接枝物与其构造单元相比,具有更好的两亲性和表面活性作用[8],可以抑制由于高浓度或与多酚相互作用而导致的相应蛋白的沉淀,在多酚的包埋研究中发挥有独特的优势。
目前,有关包埋水溶性物质的纳米颗粒制备的研究较少[9]。本文利用糖接枝的酪蛋白与原花青素进行结合,构建了一种纳米复合物。以接枝度、褐变度和蛋白溶解度为指标,对酪蛋白和麦芽糊精自组装后的产物的物化性质进行评价,并通过红外光谱和圆二色谱从微观上分析蛋白和多糖之间结合的机制。以包埋率为指标选择最优的原花青素纳米复合物的构建工艺,并对其进行表征。
1 材料与方法
1.1 材料与试剂
酪蛋白、硼酸钠:上海泰坦科技股份有限公司;麦芽糊精、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、β-巯基乙醇、原花青素:上海麦克林生化科技有限公司;邻苯二甲醛(O-phthalaldehyde,OPA):萨恩化学技术(上海)有限公司;考马斯亮蓝G250:国药集团化学试剂有限公司;所用试剂均为分析纯。
1.2 仪器与设备
高速离心机(H2050R-1):湘仪离心机仪器有限公司;冷冻干燥机(BILON2000F):上海比朗仪器制造有限公司;电子天平(PL 203)、pH 计(FE20):梅特勒-托利多仪器(上海)有限公司;纳米粒度-Zeta电位仪(NanoBrook Omni):美国布鲁克海文仪器公司;紫外分光光度计(UV-1810):北京普析通用仪器有限责任公司;傅里叶红外光谱仪(Nicolet 6700):苏州佐藤精密仪器有限公司;圆二色谱仪(J815):日本JASOC公司;高分辨场发射扫描电子显微镜(Sirion 200):美国FEI公司。
1.3 方法
1.3.1 酪蛋白-麦芽糊精自组装接枝物的制备
称取质量比1∶2的酪蛋白和麦芽糊精,酪蛋白浓度为10 mg/mL,用0.2 mol/L磷酸盐缓冲液(pH 7.0)溶解,磁力搅拌器搅拌均匀,25℃下水合24 h后,冷冻干燥。将冻干物碾碎,过80目筛,用带孔的锡箔纸封好。在相对湿度79%、温度60℃的条件下,使其在恒温恒湿箱中反应不同时间,得到自组装接枝物,存放于4℃下备用。
1.3.2 酪蛋白-麦芽糊精自组装接枝物的物化性质研究
1.3.2.1 接枝度
蛋白与多糖的自组装通过蛋白的ε-氨基和多糖的还原端羰基之间的共价偶联反应进行[10],因此以氨基数目计算接枝度表示反应进行的程度。
OPA法[11]:OPA试剂为将40mg的OPA溶解于1mL甲醇中,加入2.5 mL0.2 g/mL SDS,25 mL 0.1 mol/L硼酸钠及100 μL β-巯基乙醇,用去离子水定容至50 mL。测定时,取4 mL OPA试剂于试管中,加入样品液200 μL,混匀后于40℃反应2 min,在340 nm下测定其吸光值At。在OPA溶液中加入200 μL去离子水代替样品液作为空白对照A0。
接枝度计算公式:
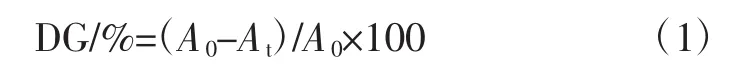
式中:A0为未反应时样品的吸光度;At为反应t时刻样品的吸光度。
1.3.2.2 褐变度
取酪蛋白-麦芽糊精反应产物,用去离子水溶解,配制为浓度10 mg/mL的均匀溶液,以去离子水作为空白对照,在420 nm处测定不同反应时间下的吸光值,以吸光度的大小反应其褐变程度。
1.3.2.3 蛋白溶解度
将接枝物溶解于不同pH值的磷酸盐缓冲液中,调节pH值由3.0~7.0,10 000 r/min的转速下离心10 min(4℃)。用考马斯亮蓝法测定上清液中溶解的蛋白质含量。
蛋白质溶解度的计算公式[12]:

1.3.3 酪蛋白-麦芽糊精自组装接枝物的表征
1.3.3.1 傅里叶-红外光谱分析
分别称取酪蛋白、麦芽糊精及接枝物适量(2 mg),以质量比1∶50的量加入一定量的溴化钾,待样品和溴化钾充分混合均匀后,压成薄片,在400 cm-1~4 000 cm-1的波数范围扫描。
1.3.3.2 圆二色谱分析
将接枝物溶于去离子水中,调节蛋白质浓度为0.1 mg/mL,在25℃下使用圆二色谱仪扫描分析蛋白质样品二级结构的构象变化。扫描波长190 nm~250 nm,样品池光程为10 mm,扫描速率100 nm/min,扫描步长1.0 nm。每个样品扫描3次,对光谱解析后计算蛋白二级结构的含量[13]。
1.3.4 原花青素纳米复合物的制备
将一定量的原花青素溶于去离子水中,搅拌至全部溶解。将酪蛋白-麦芽糊精接枝物溶解于磷酸盐缓冲液中,将原花青素溶液缓慢倒入接枝物混合溶液中,在常温下搅拌均匀,-18℃下冷冻过夜后冷冻干燥,获得纳米复合物。
1.3.5 原花青素纳米复合物构建过程中单因素优化
1.3.5.1 芯壁比
选定酪蛋白-麦芽糊精接枝物(酪蛋白/麦芽糊精质量比1∶2,接枝时间15 h)浓度为10 mg/mL,磷酸盐缓冲液pH 7.0,原花青素/接枝物的质量比分别为1∶10、2 ∶10、3 ∶10、4 ∶10和 5 ∶10。
1.3.5.2 接枝物浓度
选定酪蛋白-麦芽糊精接枝物(酪蛋白/麦芽糊精质量比 1 ∶2,接枝时间 15 h)浓度分别为 2.5、5、10、25、50 mg/mL,磷酸盐缓冲液 pH 7.0,原花青素/接枝物的质量比为2∶5。
1.3.5.3 接枝反应时间
选定酪蛋白-麦芽糊精接枝物(酪蛋白/麦芽糊精质量比 1 ∶2,接枝时间分别为 0、5、10、15、20、25 h)浓度为10 mg/mL,磷酸盐缓冲液pH 7.0,原花青素/接枝物的质量比为2∶5。
1.3.5.4 环境pH值
选定酪蛋白-麦芽糊精接枝物(酪蛋白/麦芽糊精质量比为1∶2,接枝时间15 h)浓度为10 mg/mL,磷酸盐缓冲液 pH 值分别为 3.0、4.0、5.0、6.0、7.0 和 8.0,原花青素/接枝物的质量比为2∶5。
纳米复合物表面原花青素的测定:取1 g样品加入45 mL无水乙醇,洗涤5 min后过滤,滤液移入50 mL容量瓶中,加入5 mL蒸馏水,用无水乙醇定容。取样液0.5 mL,加入具塞试管,然后加入5 mL正丁醇-盐酸(95∶5,体积比)溶液,封口,在90℃水浴中加热2 h,于546 nm处测定吸光值。
纳米复合物中总原花青素的测定:取1 g样品放入研钵中,加5 mL蒸馏水研磨破壁,加入45 mL无水乙醇过滤,滤液移入50 mL容量瓶,用无水乙醇定容。取样液0.5 mL,加入具塞试管,然后加入5 mL正丁醇-盐酸(95∶5,体积比)溶液,封口,在90℃水浴中加热2 h,于546 nm处测定吸光值。

1.3.6 粒径及电位分析
选择配有He/Ne激光器(λ=633 nm)的Nano-Zs90马尔文粒径分析仪,散射角为90°。将待测样品装入聚苯乙烯比色皿中(折光指数1.33),测定温度25℃,保温3 min,记录纳米复合物的平均粒径和多分散指数。采用Zeta-Nano分析仪对纳米复合物的表面带电情况进行测量。
1.3.7 扫描电镜观察
将少量待检测微粒涂抹于导电胶上,使用离子喷镀仪喷金,喷金电流15 mA,喷镀时间60 s,于10 kV电压下观察样品。
1.4 数据处理
使用软件SPSS处理数据,试验结果重复3次取平均值,计算标准差(S.D.)。使用软件Graphpad prism绘图。
2 结果与分析
2.1 自组装接枝度的测定
蛋白与多糖自组装所得两亲性生物聚合物的性质受到多种因素影响。其中,接枝度直接反映了蛋白的糖基化程度,是接枝物最重要的理化性质之一[14]。
Turan等[15]研究发现,乳清分离蛋白与葡聚糖的最佳接枝比为1∶3;Cheng等[16]试验证明,当大米蛋白与葡聚糖的质量比达到2∶1时,其接枝度最大,为22.98%。这表明,特定的蛋白质和糖分子之间存在最适宜的质量比使得其接枝度达到最大,适当的质量比既能增加反应的速率,又能降低不期望反应的发生。通过预试验,本试验选定酪蛋白/麦芽糊精的质量比为1∶2。本试验研究了反应时间对自组装所得接枝物的接枝度的影响,结果如图1所示。
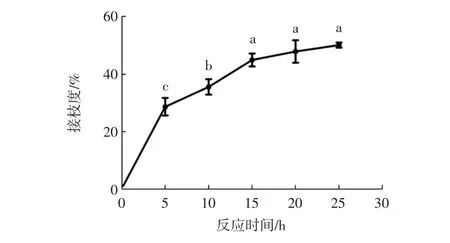
图1 不同反应时间下接枝度的变化Fig.1 Changes of grafting degree under different reaction time
由图1可知,反应时间延长,接枝度随之增加,25 h时,接枝度最大,为(50.16±0.90)%。反应时间到达15 h后,接枝度变化不大(p>0.05)。在此反应过程中,接枝度增长率的变化可能是因为在不同反应阶段形成了不同的产物,不同产物的形成所需要的反应时间和反应物的浓度等因素有关,所以会导致接枝度的变化率的改变。Li等[12]利用D-葡萄糖、黄原胶与大豆分离蛋白结合发现,随着反应时间由6 h增加到24 h,其糖基化程度有所降低。导致这种不期望结果的原因可能是随着反应时间的延长,蛋白质之间的相互作用增加,与D-葡萄糖、黄原胶共同竞争和大豆分离蛋白之间的结合位点,从而导致接枝度的降低[10]。所以,需要合理控制反应的时间。
2.2 不同反应时间下褐变度的变化
酪蛋白与麦芽糊精的自组装反应也是一种蛋白与多糖之间的干法美拉德反应。随着反应的进行,酪蛋白-麦芽糊精接枝产物会发生褐变现象。美拉德湿法反应一般较为彻底,褐变程度较严重,褐变指数最小一般在0.2左右,在反应后期,会产生棕褐色物质,即类黑精,而干法美拉德反应的褐变程度较低。
不同反应时间下,接枝物褐变程度的变化见图2,不同反应时间下产物颜色的变化见图3。
图2中,美拉德反应时间在0~25 h之间时,褐变指数基本维持在0.25左右。图3可以直观的发现,产物的颜色呈现淡黄色。黄色可能是由于多糖的热分解脱水(焦糖化)造成的[17]。麦芽糊精因为在葡萄糖C-4碳原子处具有羟基残基,所以不容易发生Amadori反应,使得其美拉德反应能够控制在初级阶段,可以很好的控制美拉德产物的颜色,并防止后期有害大分子的生成,适合于食品工业的应用。
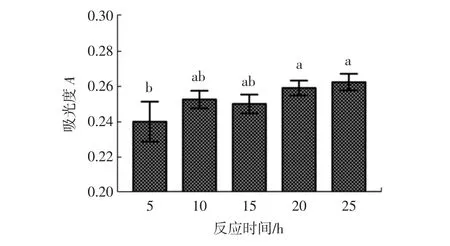
图2 不同反应时间下褐变度的变化Fig.2 Changes of browning degree under different reaction time

图3 不同反应时间下产物颜色的变化Fig.3 Change of product color under different reaction time
2.3 自组装反应对接枝物溶解度的影响
溶解性是蛋白的一个重要属性,它可以影响蛋白的乳化性和凝胶性等其它特性。天然酪蛋白在其等电点附近净电荷约为零,蛋白易沉淀。糖接枝蛋白自组装反应对接枝物溶解度的影响见图4。
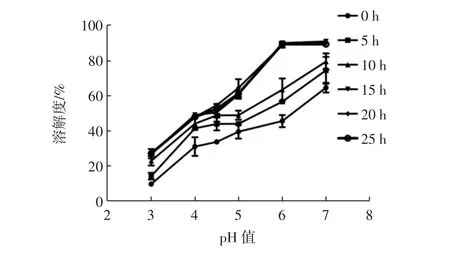
图4 糖接枝蛋白自组装反应对接枝物溶解度的影响Fig.4 Effect of self-assembly of glycoprotein on solubility of graft copolymer
图4显示,当酪蛋白与麦芽糊精进行自组装反应后,其溶解度显著提高。这是因为在自组装产物中,酪蛋白和麦芽糊精通过次级力形成较弱的复合物,暴露了更多的亲水基团,有利于蛋白的溶解。Jiménez-Castaño等[18]研究发现,蛋白质-多糖结合物比蛋白质本身具有更多的亲水性基团,与亲水性多糖结合可提高蛋白质与水分子的亲和力,并在不利条件下限制蛋白质的相互作用。随着反应的进行,后期可能会产生不溶性的聚合物,同时会发生蛋白质的交联反应,这些因素阻碍了接枝反应的进行,使得其溶解度不再变化或变化不明显(p<0.05)。
2.4 傅里叶-红外光谱分析
测定蛋白、多糖及其接枝物的红外光谱图,分析其官能团的特征吸收峰的变化。其中,酪蛋白的傅里叶-红外光谱图见图5。
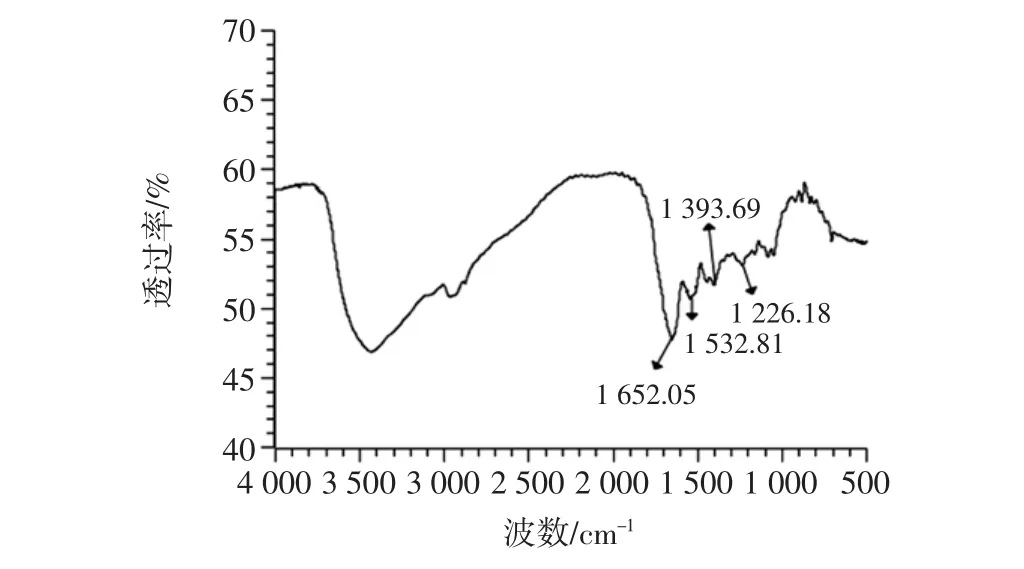
图5 酪蛋白傅里叶-红外光谱图Fig.5 Fourier-infrared spectra of casein
图5酪蛋白的特征谱中,显示出较强的酰胺I、II、III带,它们大致位于波数1 630 cm-1~1 680 cm-1、1 530 cm-1~1 560 cm-1、1 260 cm-1~1 420 cm-1之间[19]。酰胺 I带是由肽键的C=O伸缩振动引起,酰胺II带是C-N伸缩振动以及N-H弯曲[20]。1 540 cm-1处的吸收峰是由酰胺II带的-NH拉伸振动引起。1 400 cm-1处的吸收峰是酰胺III带的C-N振动。1 250 cm-1的吸收峰属于肽键的C-H拉伸振动。
麦芽糊精的傅里叶-红外光谱图见图6。
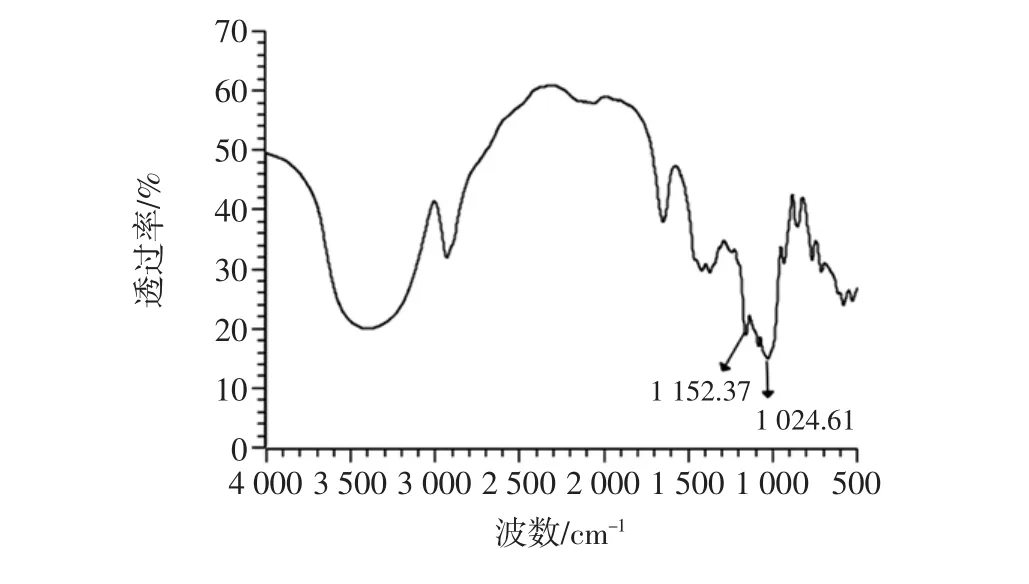
图6 麦芽糊精傅里叶-红外光谱图Fig.6 Fourier-infrared spectra of maltodextrin
在图6麦芽糊精的红外光谱图中,波数为1180 cm-1~953 cm-1的一系列重叠峰是由C-C、C-O、C-O-C的伸缩振动和C-H的弯曲引起的[20]。
酪蛋白-麦芽糊精自组装接枝物的傅里叶-红外光谱图见图7。
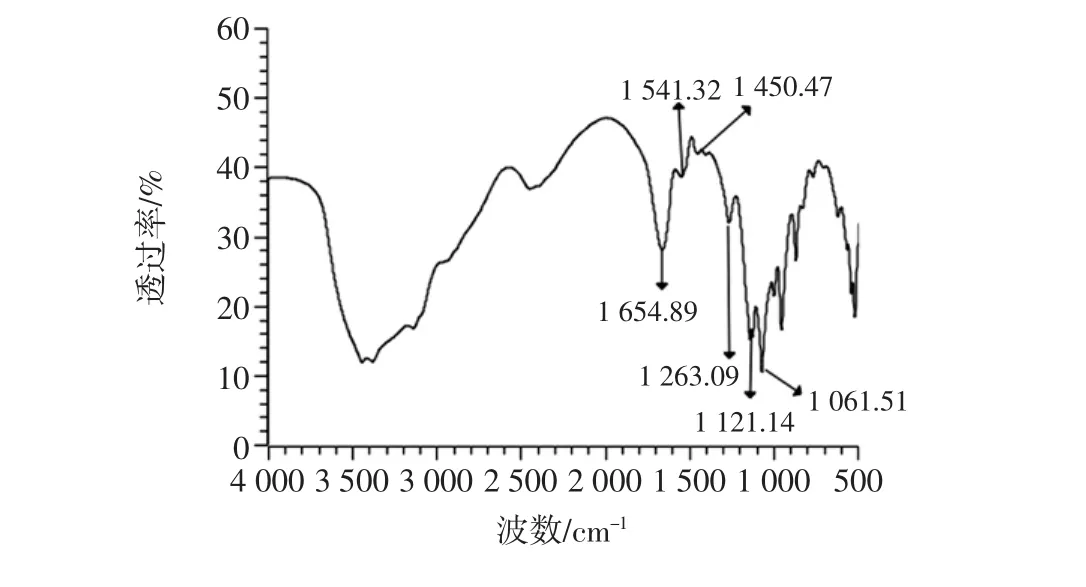
图7 酪蛋白-麦芽糊精自组装接枝物傅里叶-红外光谱图Fig.7 Fourier-infrared spectra of casein-maltodextrin selfassembled grafts
在图7酪蛋白-麦芽糊精接枝物的红外光谱中,1 500 cm-1~1 700 cm-1左右的吸收峰主要是由酰胺I和II带的C=O伸缩振动、C-N伸缩振动提供。通过自组装反应后,1 500 cm-1~1 600 cm-1左右的吸收峰与酪蛋白相比明显减弱,表明氨基数目减少。其次,1 000 cm-1~1 200 cm-1的吸收峰与麦芽糊精相比,发生偏移,表明酪蛋白和麦芽糊精反应生成了新的官能团[21]。
2.5 圆二色谱分析
对酪蛋白以及反应后的蛋白接枝物进行圆二色谱分析可以得到其在接枝过程中蛋白质发生的结构变化,结果见表1。
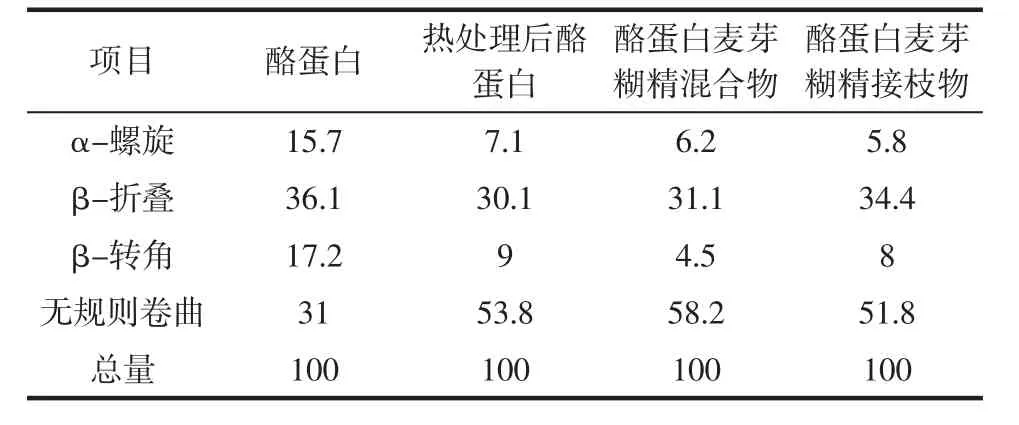
表1 酪蛋白及其接枝物的蛋白二级结构分析Table 1 Protein secondary structure analysis of casein and its graft %
由表1可知,当酪蛋白与麦芽糊精进行自组装后,其α-螺旋、β-折叠、β-转角都有所减少,无规则卷曲结构增加。这是因为蛋白质的α-螺旋、β-折叠一般埋在多肽链的内部,加热以及大分子之间的相互作用使得酪蛋白的分子结构发生了变化。反应后无规则卷曲结构的增加有利于分子间氢键的形成和疏水氨基酸残基的暴露。这与Feng等[22]使用美拉德反应制备大豆分离蛋白-麦芽糊精接枝物和大豆分离蛋白-阿拉伯胶接枝物测出的接枝物的圆二色谱结果类似。但是略有不同的是,其试验发现,大豆分离蛋白-麦芽糊精接枝物的无规则卷曲率大于其混合物的无规则卷曲率,而本试验中,酪蛋白-麦芽糊精接枝物的无规则卷曲的比例与其混合物相比,略有减少,造成这种现象的原因可能是当酪蛋白和麦芽糊精发生接枝反应后,虽然部分酪蛋白的肽链被打开,其结构得到伸展,但是由于酪蛋白的氨基与多糖的羰基相结合,使得其二级结构变得更稳定,所以本试验获得其无规则卷曲的比例略微减小的结果。
2.6 反应参数对原花青素包埋率的影响
2.6.1 芯壁比对包埋率的影响
根据试验得到的不同芯壁比对包埋率的影响见图8。
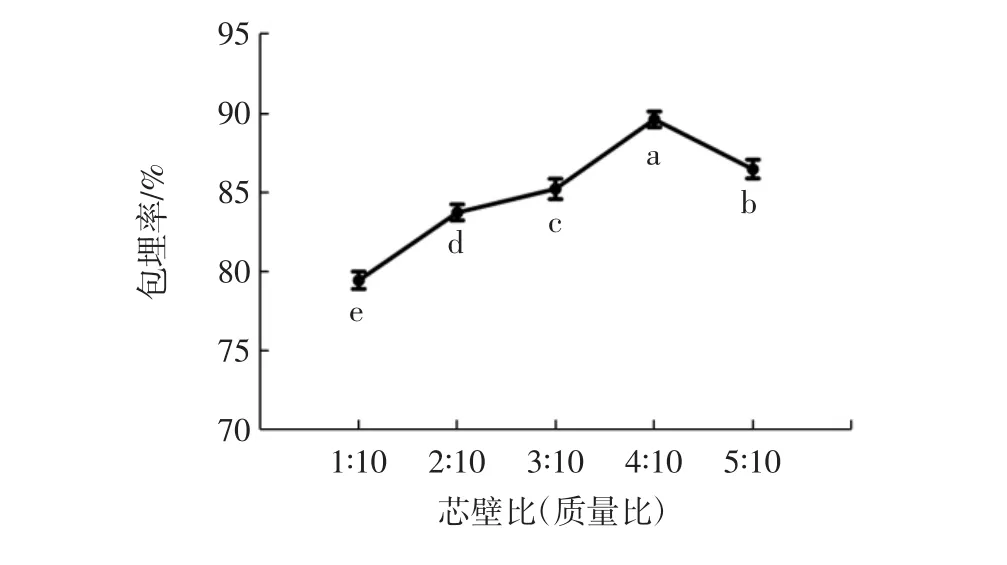
图8 芯壁比对包埋率的影响Fig.8 Effect of core-wall ratio on encapsulation efficiency
图8显示,当原花青素的浓度较低时,麦芽糊精对酪蛋白存在空间位阻效应[23],阻碍了原花青素与蛋白的接触,包埋率较低。随着芯壁比的增加,可以与酪蛋白-麦芽糊精接枝物结合的原花青素增加,其包埋率也随之增加。当原花青素的浓度较大时,多余的原花青素不能完全被糖基化酪蛋白结合,暴露在纳米颗粒表面,导致包埋率的降低。Liu等[24]使用壳聚糖/磺丁基-β-环糊精包埋茶多酚发现,当茶多酚的浓度由1 mg/mL增加到3 mg/mL时,其包埋率减小,这主要是因为随着茶多酚质量比的增加,壳聚糖/磺丁基-β-环糊精的基质达到饱和,导致多余的茶多酚附着在其表面或游离于溶液中,所以包埋率减小。
2.6.2 接枝物浓度对包埋率的影响
根据试验结果得到接枝物浓度对包埋率的影响见图9。
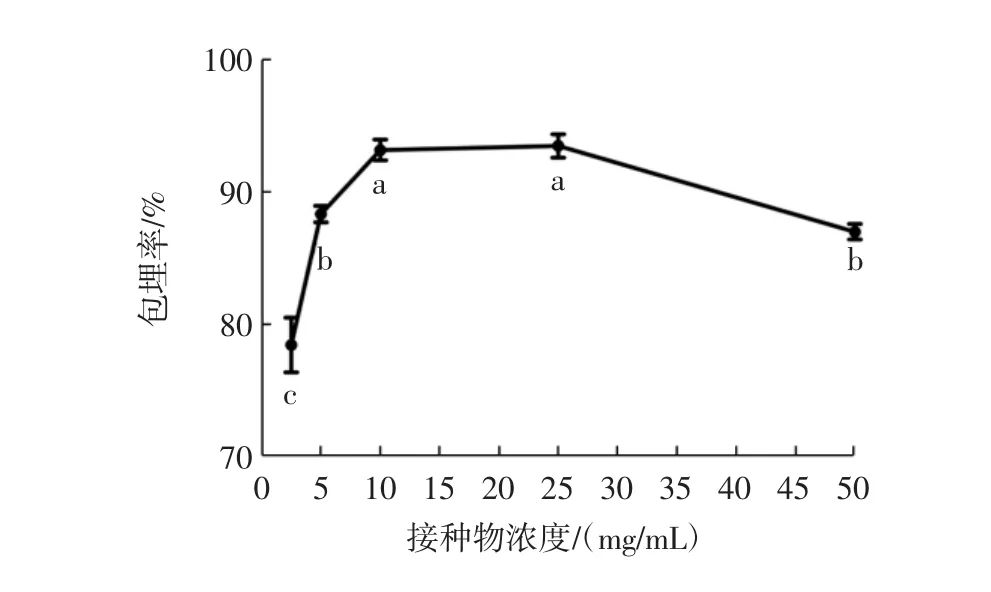
图9 接枝物浓度对包埋率的影响Fig.9 Effect of graft concentration on encapsulation efficiency
图9显示,随着接枝物浓度的增加(2.5 mg/mL~25 mg/mL),对原花青素的包埋率也随之增加。这是因为随着接枝物浓度的提高,更多的接枝物可以与原花青素之间通过疏水相互作用、氢键作用自组装形成纳米粒子。此外,由于多糖分子的存在,会形成一定的空间位阻,使得酪蛋白的分子结构更加分散,接触面积有所增加,促使其更容易与原花青素进行结合[25]。当可以与原花青素进行反应的接枝物的数量达到最大值后,接枝物浓度进一步增大(25 mg/mL~50 mg/mL),蛋白分子之间易发生相互作用,形成聚集体,从而使得酪蛋白-麦芽糊精接枝物与原花青素之间的结合受阻,包埋率降低。
2.6.3 接枝时间对包埋率的影响
图10反应了接枝时间对包埋率的影响。

图10 接枝反应时间对包埋率的影响Fig.10 Effect of grafting reaction time on encapsulation efficiency
由图10可知,随着反应的进行,麦芽糊精和酪蛋白之间逐渐形成稳定的核壳结构,能够更好地包埋原花青素,其包埋率得以增加。但是,随着反应时间的进一步延长,反应后期会生成一些不期望的物质,一方面,这些物质可能易分解、不稳定,从而导致更多的原花青素分散在接枝物的表面,其包埋率降低;另一方面,某些聚合物的生成会使得酪蛋白-麦芽糊精对原花青素的结合作用受到阻滞,导致包埋率的降低。
2.6.4 环境pH值对包埋率的影响
原花青素作为一种多酚化合物,对环境pH值较敏感,此外,溶液pH值对酪蛋白的溶解度也具有一定影响。环境pH值对包埋率的影响见图11。
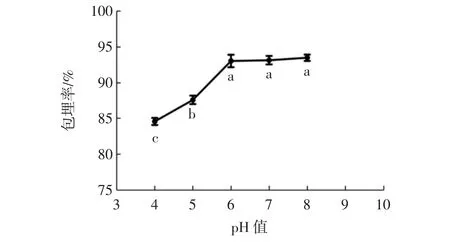
图11 环境pH值对包埋率的影响Fig.11 Effect of environmental pH on encapsulation efficiency
由图11可以看出,当酪蛋白自组装产物的溶液pH值控制在6~8之间时,其包埋率基本稳定不变。酪蛋白的等电点为pH 4.6左右,当溶液pH值在其等电点附近时,酪蛋白的溶解度较低,这时它表现为电中性,导致接枝物对原花青素的包埋率也较低。Pulicharla等[26]采用草莓多酚和壳聚糖反应结合,发现在pH4.0时,壳聚糖中的羟基呈现出对草莓多酚排斥的负电荷,因此,水溶性的草莓多酚和壳聚糖之间的相互作用减弱,包埋率降低。当进入碱性环境后,蛋白分子多以无规则线团形式存在,使得其与多酚之间能形成稳定的纳米粒子[27],包埋率也因之较为稳定。当环境pH值达到6.0后,其对包埋率影响不显著(p>0.05),所以,后续试验选择pH 7.0作为环境pH值。
2.7 正交优化
根据单因素试验的结果,选择芯壁比、接枝时间、接枝物浓度作为变量,如表2所示设计三因素三水平的正交试验对制备条件进行优化。
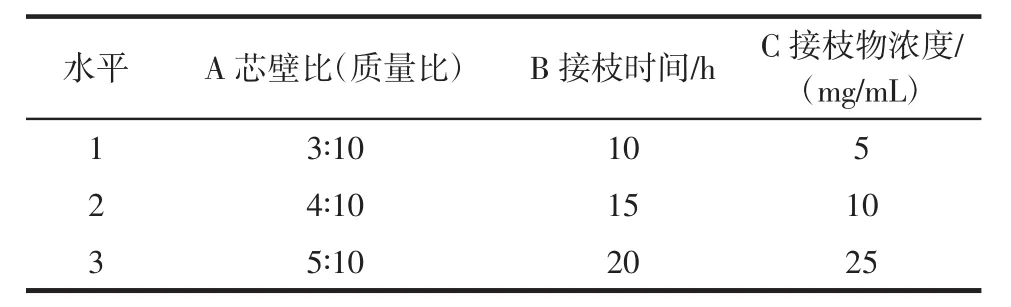
表2 因素水平表Table 2 Factors and levels graph
正交试验结果如表3所示。

表3 正交优化试验Table 3 Orthogonal optimization test
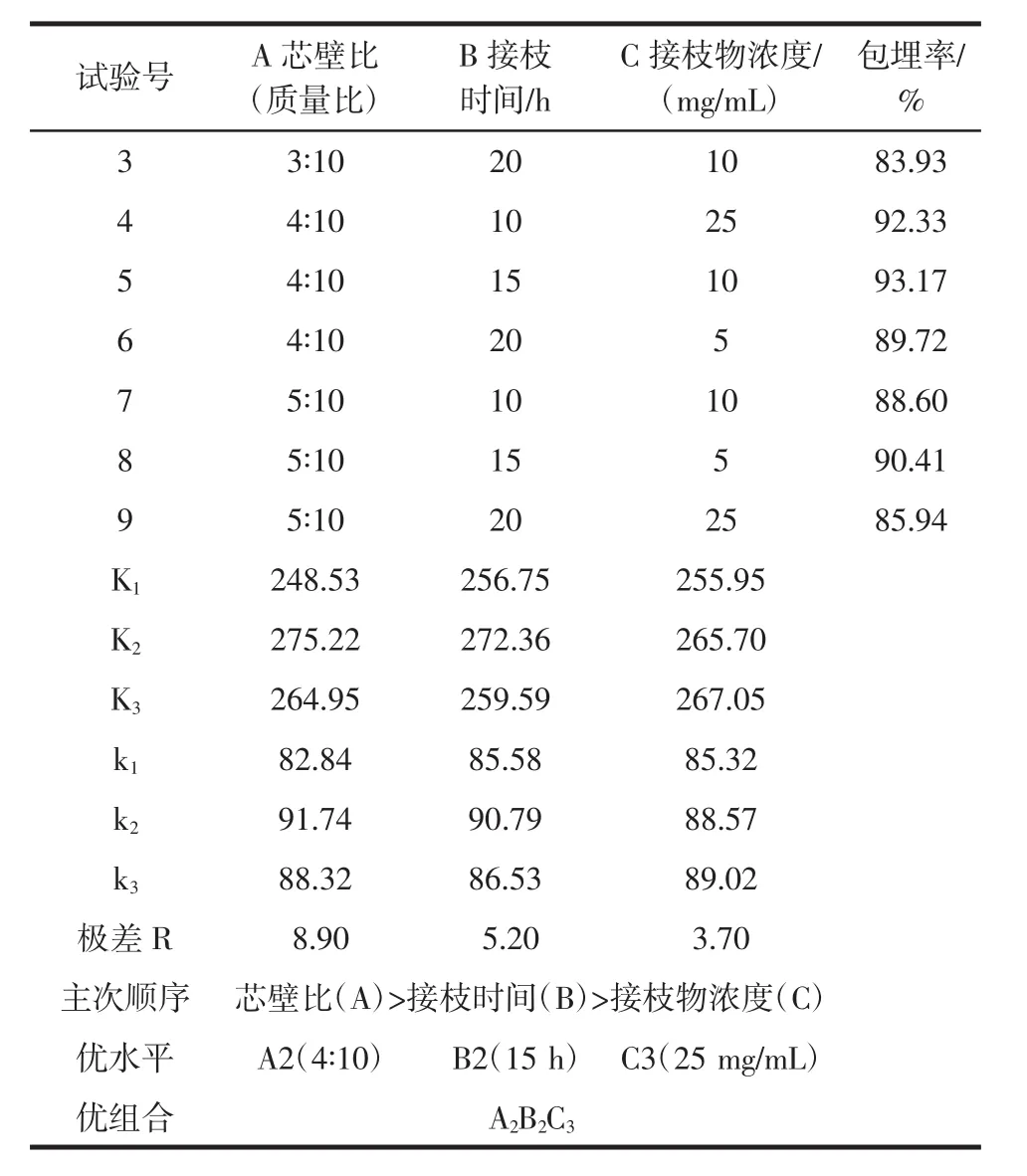
续表3 正交优化试验Continue table 3 Orthogonal optimization test
由表3可知,此三因素对包埋率的影响显著程度为:芯壁比>接枝时间>接枝物浓度。K值最佳的包埋条件为:芯壁质量比2∶5,接枝时间15 h,接枝物浓度25 mg/mL。对理论最佳制备参数A2B2C3进行3次平行验证试验得出,在此条件下制备得到的原花青素包埋率为93.48%,大于正交试验的最大包埋率93.17%,说明最佳制备参数A2B2C3确为最优。
2.8 原花青素纳米复合物的表征
本试验构建获得原花青素纳米复合物的平均粒径为(158.69±1.70)nm,PDI为 0.189±0.005,Zeta电位为(-30.58±1.27)mV,包埋率为(93.48±0.20)%。酪蛋白-麦芽糊精原花青素纳米复合物的粒径分布见图12。
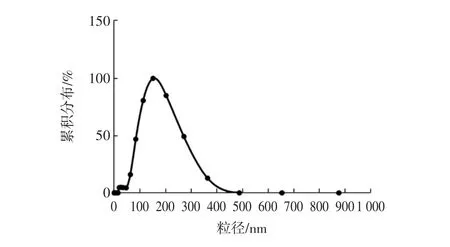
图12 酪蛋白-麦芽糊精原花青素纳米复合物的粒径分布Fig.12 Particle size distribution of casein-maltodextrin proanthocyanidin nanocomposites
图12显示了原花青素纳米复合物的粒径分布情况,可以看到其粒径主要集中在200 nm左右,分布较均匀。Liu等[24]分别将酪蛋白与原花青素溶于去离子水中,小麦醇溶蛋白和原花青素溶于乙醇溶液中,制备得到两种纳米复合物。当选定蛋白与原花青素的质量比为1∶0.5时,酪蛋白-原花青素纳米复合物的粒径为140 nm,而小麦醇溶蛋白-原花青素纳米复合物的粒径为212 nm,其包埋率分别约为55%和45%,Zeta电位分别约为-15 mV和-10 mV。Yin等[28]采用逆向蒸发法和超声处理相结合,将大豆卵磷脂-胆固醇与原花青素结合制备成纳米脂质体,其最高包埋率为(71.97±0.42)%。Tie等[29]以原花青素为芯材,以阿拉伯胶和β-环糊精为壁材,采用高压微射流技术结合喷雾干燥制备得到原花青素乳液及其微胶囊,其包埋率为(88.60±0.3)%,在最佳条件下制备得到微胶囊的Zeta电位为(12.13±0.12)mV。相比而言,本试验构建的原花青素纳米复合物的包埋率和Zeta电位的绝对值都显著较大。由结果可知,蛋白/多糖的结合与其构成物相比,能够显著提高原花青素的包埋率,这主要是因为酪蛋白与麦芽糊精接枝使得纳米复合物中形成一定的空间位阻,增加了原花青素与自组装接枝物的结合位点,此外,亲水的多糖链可以通过氢键等作用力与水分子进行结合构成外壳结构,酪蛋白的疏水基团可以通过疏水相互作用形成疏水微区,进一步包埋原花青素,从而提高其包埋率。纳米颗粒的稳定性依赖于纳米颗粒相互靠近时其间排斥力和吸引力的平衡。Zeta电位绝对值越高,即排斥力大于吸引力,体系越稳定。所以本试验构建的纳米复合物具有更好的稳定性。
2.9 原花青素纳米复合物的扫描电镜分析
对酪蛋白-麦芽糊精接枝物及原花青素纳米复合物的表观形态利用扫描电镜进行观察,可以发现结果如图13和图14所示。
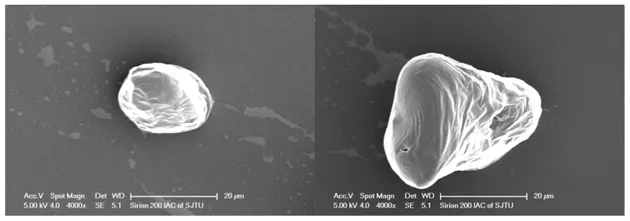
图14 酪蛋白-麦芽糊精原花青素纳米复合物的扫描电镜图Fig.14 Scanning electron microscopy of casein-maltodextrin proanthocyanidin nanocomposites
从图13和图14中可以发现酪蛋白-麦芽糊精反应接枝物形成了具有小孔、裂缝和褶皱的片状物,这可能是由于冷冻干燥使得其表面及内部水分蒸发,形成多孔的结构。而原花青素纳米复合物则呈现一种有规律的具有光滑表面的紧凑的球状结构。这是因为原花青素能填满基质的空腔,导致多孔性降低,使得其表面也更加光滑[30]。
3 结论
本文主要研究酪蛋白与麦芽糊精自组装反应中的理化性质及作用机制,并确定原花青素和酪蛋白-麦芽糊精自组装接枝物形成纳米复合物的最佳条件,以包埋率为指标,优化纳米复合物形成过程中的条件。确定构建的最佳工艺参数:酪蛋白/麦芽糊精质量比1∶2;接枝反应时间15 h;原花青素/接枝物质量比2∶5;接枝物浓度25 mg/mL;溶液pH 7.0。在最佳工艺条件下,其包埋率达到93.48%,平均粒径为158.69 nm,Zeta电位为-30.58 mV,所得纳米复合物呈现光滑紧凑的球状结构。综上,本试验通过将蛋白与多糖自组装形成的两亲性生物聚合物与原花青素结合构建了一种稳定的纳米复合物,为生物活性化合物的载运开辟了一条新途径,其在功能性食品和药品的应用中具有广阔的发展前景。
