基于气相色谱-质谱联用的血府逐瘀汤治疗大鼠颅脑损伤的血浆代谢组学研究
2020-08-22张志敏卢红梅
范 帆,张志敏,卢红梅
(中南大学 化学化工学院,湖南 长沙 410083)
颅脑损伤是因外力作用于头部而造成的脑组织损伤,具有较高的病死率和致残率[1-3]。血府逐瘀汤出自清代王清任的《医林改错》,由生地、川芎、赤芍、桃仁、红花、枳壳、甘草、当归、牛膝、桔梗、柴胡组成,该方剂具有活血祛瘀、行气止痛的功效,广泛用于治疗心脑血管病、脑外伤等[4-7]。
代谢组学是继基因组学、转录组学和蛋白质组学之后兴起的一个系统生物学新分支,研究在外界刺激、干扰或自身病理生理条件下代谢组的动态变化规律[8-9]。基于现代分析技术,借助于化学计量学等数据处理方法,可以从代谢组学得到多维的、复杂的数据中挖掘出隐藏的化学、生物信息,最终达到代谢组学分析研究的目的[10-11]。
本实验采用前期建立的气相色谱-质谱联用(GC-MS)方法[12],对假手术组和模型组大鼠血浆的代谢物进行定性定量分析,然后以t检验(t-test)、有监督的正交偏最小二乘-判别分析(OPLS-DA)筛选出的具有显著差异的代谢物为潜在标志物,并观察其在治疗组中的时序变化。
1 实验部分
1.1 仪器与试剂
QP2010型GC-MS(日本岛津公司),配Shimadzu-GL自动进样器;甲醇(色谱纯,Merck公司);2-异丙基苹果酸、甲氧胺盐酸盐、吡啶、双(三甲基硅烷基)三氟乙酰胺(BSTFA)(分析纯,Sigma-Aldrich公司)。
1.2 样本信息
实验样本为大鼠颅脑损伤模型的血浆样本,共148例。动物模型的建立和血浆样本的采集由中南大学湘雅医院中西医结合科协助完成。样本分为治疗组、模型组、假手术组。假手术组的大鼠通过手术磨除骨窗,不予打击。模型组和治疗组大鼠采用相同高度、相同质量的自由落体打击,从而构建颅脑损伤大鼠模型。治疗组在造模后给予血府逐淤汤灌胃,模型组、假手术组给予等量生理盐水灌胃,分别收集各组灌胃后第1、3、7、14 d的血浆样本。
1.3 实验方法
1.3.1 样本预处理将100 μL血浆样本于4 ℃解冻30 min,加入30 μL 2-异丙基苹果酸(1 mg/mL,IS,内标溶液)、300 μL甲醇,涡旋30 s。4 ℃下以16 000 r/min离心10 min。取离心后的上清液330 μL,常温下用氮气吹干。残渣加入50 μL甲氧胺吡啶溶液(20 mg/mL),涡旋60 s后用封口膜封口,于70 ℃水浴反应1 h,进行第1次衍生反应。加入100 μL BSTFA衍生试剂,涡旋60 s后用封口膜封口,于70 ℃水浴反应1 h,进行第2次衍生反应。冷却至室温,取上清液,供GC-MS分析。
1.3.2 GC-MS分析条件色谱柱为Agilent DB-5MS毛细管色谱柱(30 m×0.25 mm×0.25 μm);程序升温:初始温度70 ℃,保持4 min,以8 ℃/min升至300 ℃,保持3 min,色谱出峰时间为6.5 min,总运行时间35.75 min。进样口温度为280 ℃,分流比10>∶1。载气为高纯氦气,流速1 mL/min;进样量为1 μL。质谱采用EI源,电子轰击电压70 eV;离子源温度250 ℃,接口温度280 ℃,检测电压0.9 kV,以0.2 s/scan的间隔进行全扫描,扫描的质量范围(m/z)为35~800 amu。
1.3.3 数据分析采用NIST/EPA/NIH质谱数据库对样本定性。以内标法定量,代谢物的相对浓度用均值±标准偏差表示。利用t检验对模型组及假手术组的第1、3、7、14 d的代谢组进行统计检验,将具有显著性差异的代谢物作为潜在标志物。采用PCA和OPLS-DA观察模型组和假手术组的总体差异。综合变量的投影重要性指标(VIP)及t检验结果筛选生物标志物。
2 结果与讨论
2.1 代谢物的定性定量分析
对所有血浆样本进行GC-MS分析,采用NIST谱库共鉴定出43种化合物,包括丙氨酸、甘氨酸、亮氨酸等氨基酸,半乳糖、葡萄糖等糖类,棕榈酸、亚油酸等脂肪酸类,以及尿素、磷酸等小分子代谢物(表1),由所有测试样本等量混合而成的质控样本(QC)的代表性总离子流图见图1。

表1 颅脑损伤模型组、假手术组血浆样本定性定量及t检验结果Table 1 Qualitative,quantitative analysis and t-test results of plasma samples of model group and sham group
2.2 模型组与假手术组差异代谢物筛选
将模型组与假手术组的数据上传至Metabo Analyst 4.0平台(Http://metaboanalyst.ca),以p值小于0.05判断该代谢物在两个样本集间是否存在显著差异。结果显示,13种代谢产物在模型组和假手术组之间存在显著性差异(表1),其中油酸、色氨酸、亚油酸、乳酸、棕榈酸等11种代谢物p值小于0.001。这表明颅脑损伤会引起血浆代谢组显著变化。
运用PCA对第1、3、7、14 d的模型组及假手术组的代谢组进行分析(图2),图中圆圈代表假手术组样本,方块代表模型组样本,置信区间为95%。由图可见模型组和假手术组代谢的整体模式上有一定的分离趋势,但由于存在干扰组分以及PCA的投影方向为方差最大方向,PCA投影图中组间的区分度不够明显。

图1 QC样本的GC-MS总离子流图Fig.1 Typical total ion chromatogram(TIC) of QC plasma samplethe peak number 1-43 were the same as those in Table 1
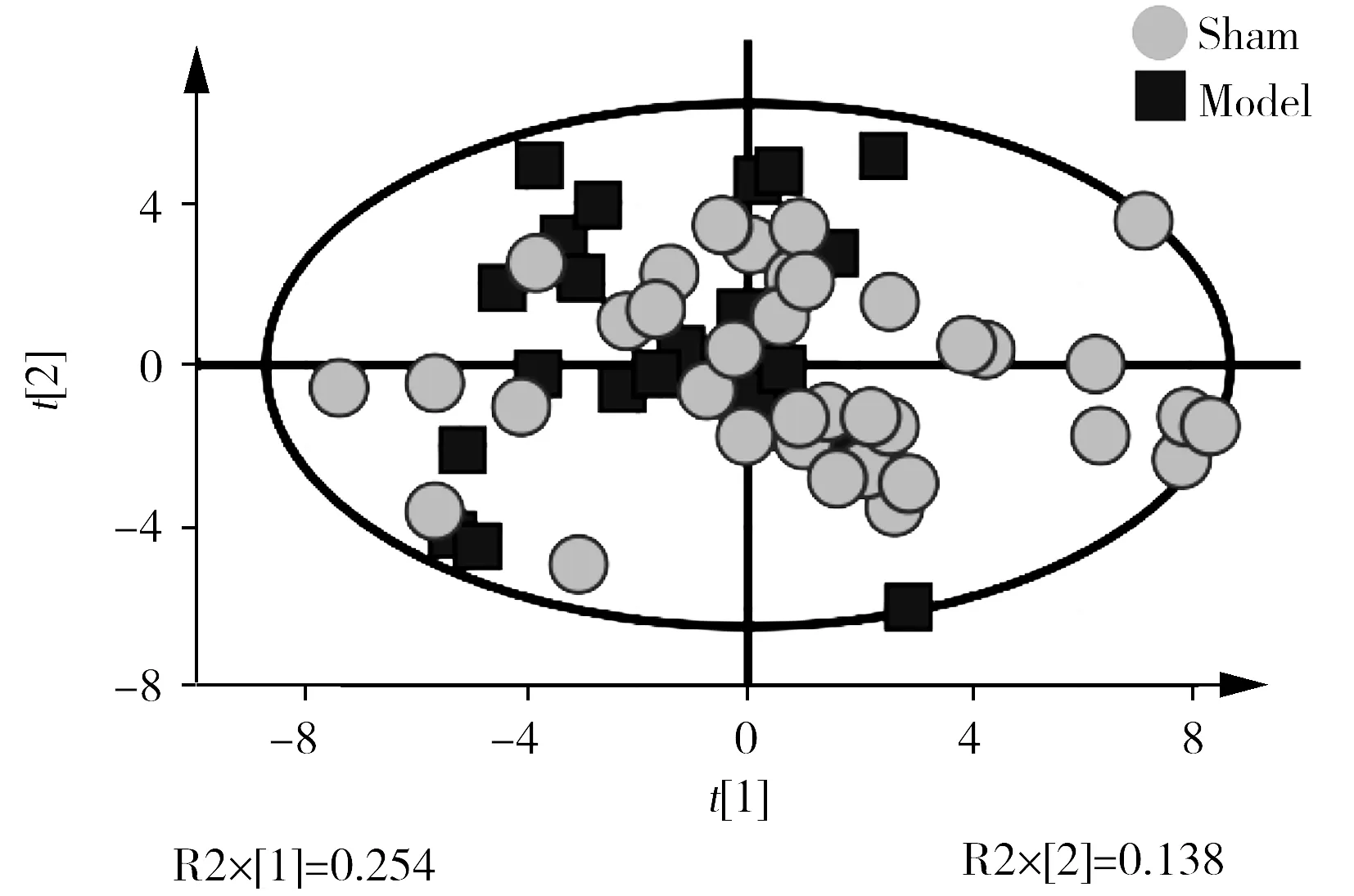
图2 PCA分类模型图Fig.2 PCA classification model diagram
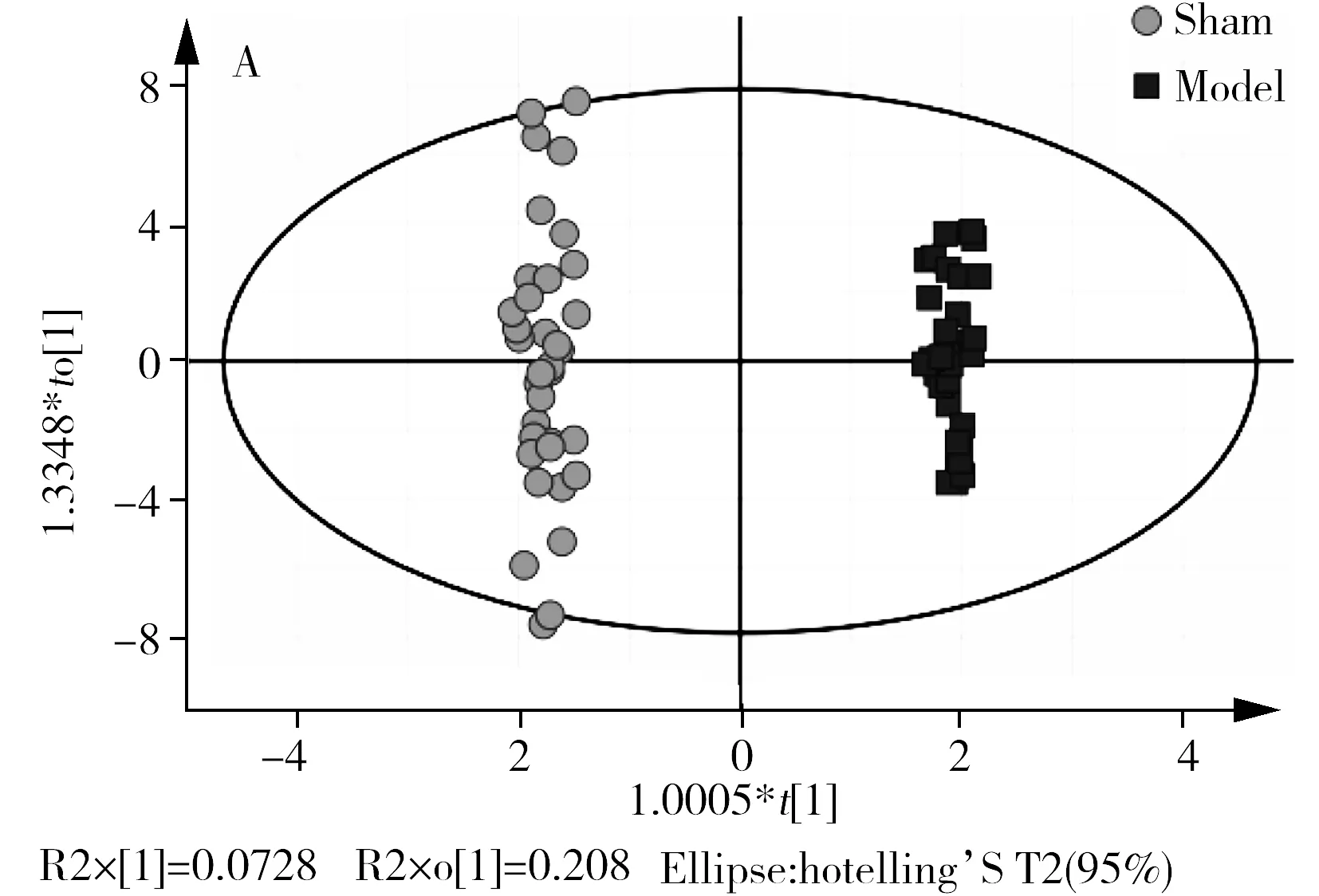
OPLS-DA判别分析融合了正交信号校正的干扰信息剔除能力以及偏最小二乘判别的相关信息提取能力,是代谢组学中最常用的建模方法。模型组及假手术组的OPLS-DA分析结果如图3A所示,可见两组有较好的分离效果。经过200次置换检验,模型未出现过拟合现象(图3B)。OPLS-DA分析结果显示模型组和假手术组在整体代谢模式上存在显著差异。同时引入该模型的VIP图探究分类的贡献变量指标。由图4可知,有16个变量的VIP>1。选取颅脑损伤模型组与假手术组t检验结果中p<0.05且OPLS-DA模型中VIP>1的代谢物为差异代谢物,最终确定乳酸、组氨酸、棕榈酸、色氨酸、亚油酸、油酸、硬脂酸为两组的差异代谢物。
2.3 第14 d的治疗组与假手术组代谢组的差异倍数分析
对第14 d治疗组与假手术组的代谢组进行差异倍数分析,将差异倍数分析(FC)的阈值设为2,将对比式设为治疗组/假手术组,由图5可知,除丙二酸外,其他代谢物的log2FC均在[-1,1]区间内且主要集中在横轴附近(图5),表明除治疗组中丙二酸含量显著低于假手术组外,其他代谢物在两组中的相对浓度无显著性倍数差异,即第14 d治疗组的代谢组整体上接近假手术组。丙二酸是三羧酸循环重要的中间产物,治疗组中丙二酸含量的降低可能与有氧代谢增强,中间产物含量降低有关。
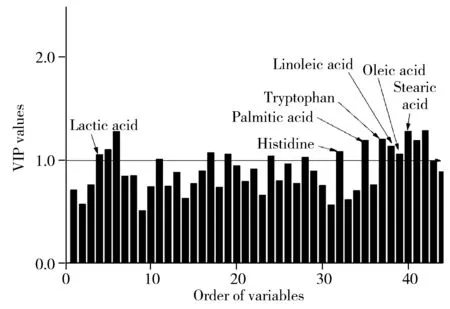
图4 模型组与假手术组OPLS-DA 模型变量投影重要度图Fig.4 VIP values plot from OPLS-DA based on plasma profiling of the model vs.sham groups
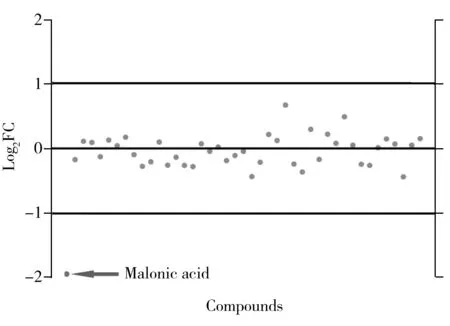
图5 第14 d的治疗组与假手术组代谢组的差异倍数分析Fig.5 Fold change analysis of the treatment group and the sham group on day 14
2.4 差异代谢物在治疗组中的时序变化
综合t检验结果及VIP值的重要性排序,选取乳酸、组氨酸、棕榈酸、色氨酸、亚油酸、油酸、硬脂酸为生物标志物,观测其在治疗组中的时序变化(图6)。结果显示,治疗组中乳酸、组氨酸、棕榈酸、亚油酸、硬脂酸的相对浓度在第1 d最高,随着治疗逐渐降低。色氨酸的相对浓度呈先减后增的趋势,治疗第3 d相对浓度最低。油酸的相对浓度呈先增后减的趋势,相对浓度在治疗第3 d最高。以上代谢物的相对浓度在治疗的第14 d均与假手术组的值接近。

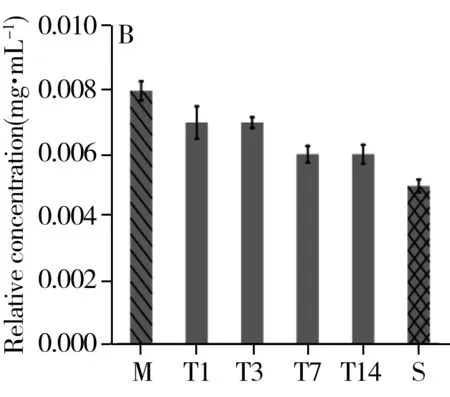
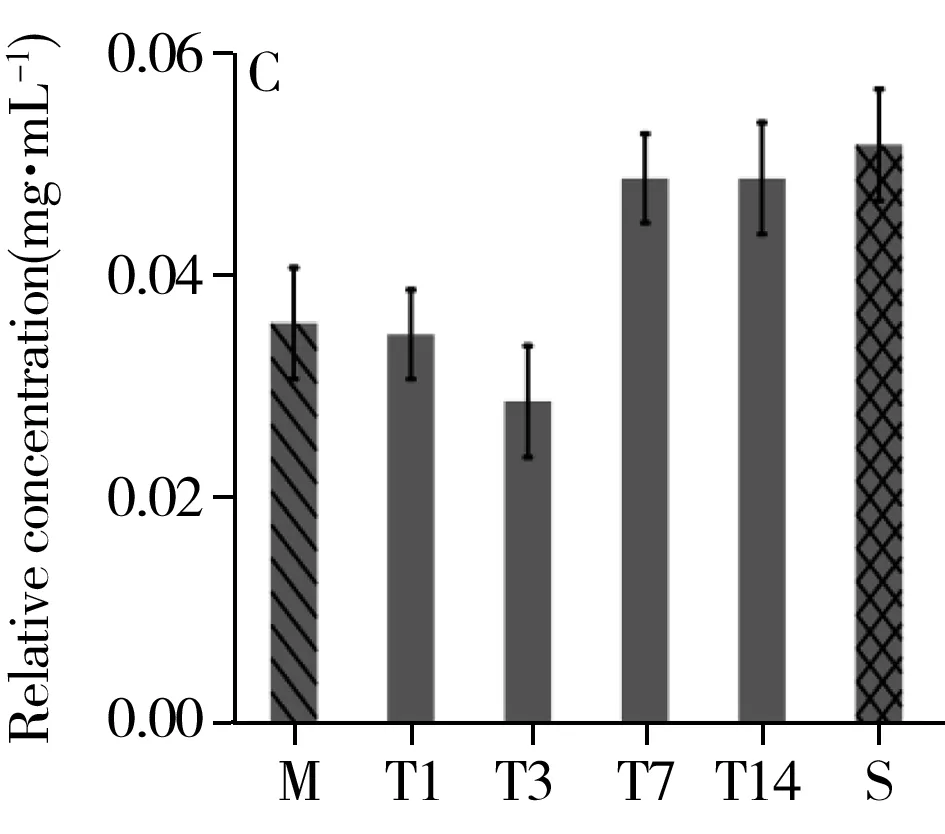

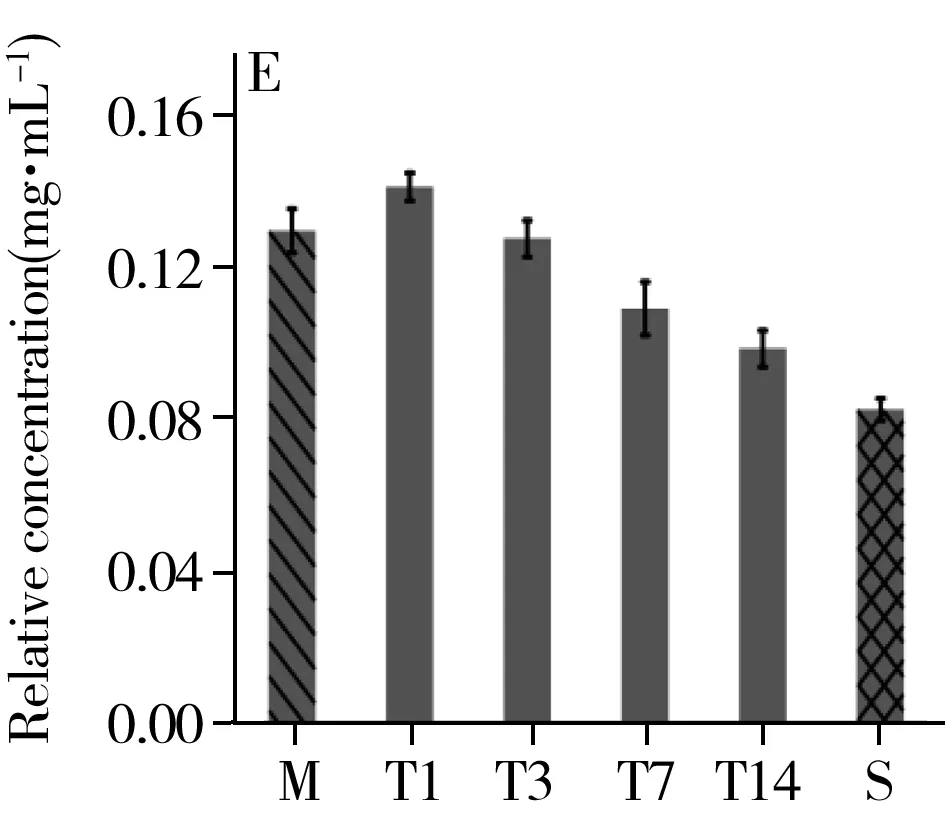
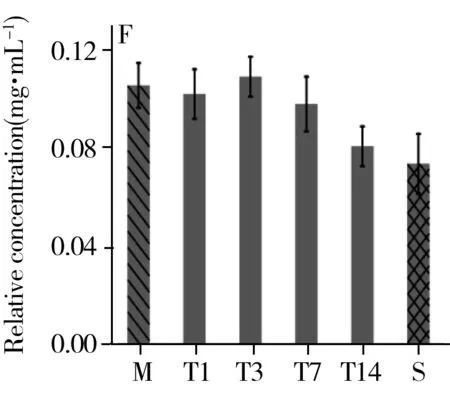
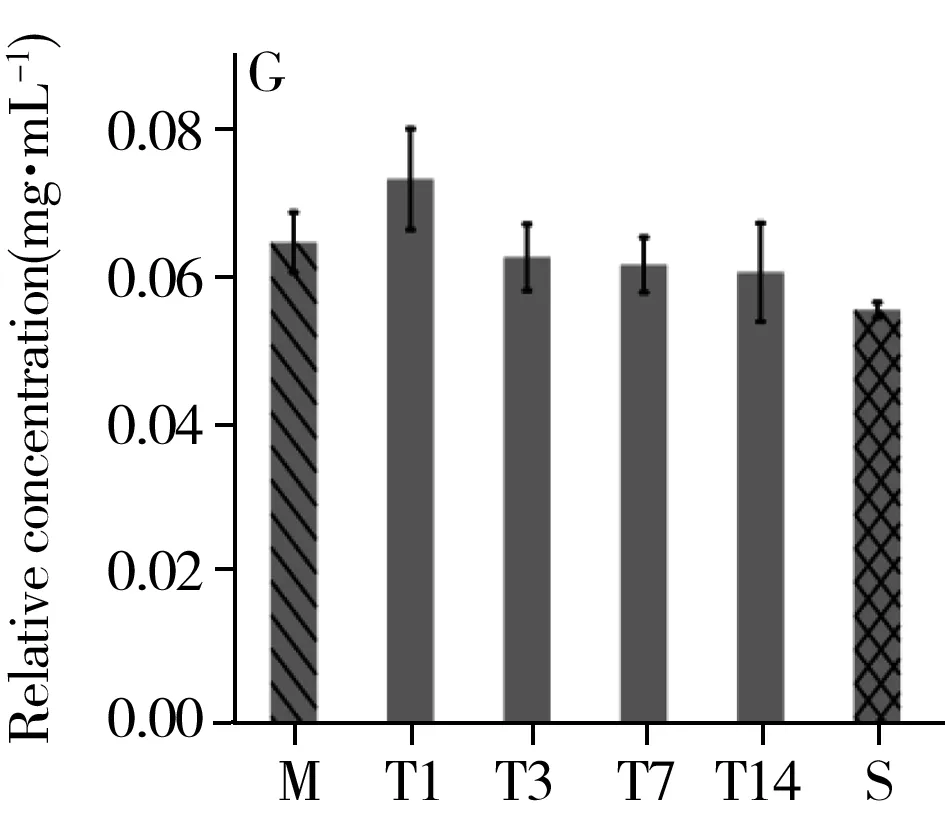
图6 乳酸(A)、组氨酸(B)、色氨酸(C)、棕榈酸(D)、亚油酸(E)、油酸(F)、硬脂酸(G)在治疗组中的时序变化Fig.6 Temporal changes of lactic acid(A),histidine(B),tryptophan(C),palmitic acid(D),linoleic acid(E),oleic acid(F),stearic acid(G) in the treatment groupM:stands for the method group;T1,T3,T7,T14 were the treatment group on day 1,3,7,14;S:represents the sham group
据文献报道,颅脑损伤可引起脑组织缺血、缺氧,继发性的炎症反应上调,致使神经元凋亡坏死[13];而代谢物的相对浓度在第1 d或第3 d出现最值,可能与颅脑损伤后大脑广泛存在凋亡现象有关,伤后第1 d即出现凋亡细胞,伤后第3 d细胞凋亡达到高峰[14]。颅脑损伤几分钟后,线粒体功能障碍,细胞呼吸作用受阻。为满足能量需求,厌氧糖酵解将会增加,并导致乳酸积累[15]。
本研究发现,治疗组大鼠用药第1 d血浆中乳酸浓度最高,经血府逐瘀汤治疗,乳酸浓度整体呈下降趋势,并在第14 d与假手术组中乳酸浓度接近,这表明血府逐瘀汤可改善脑部缺血缺氧状况,调节神经组织能量代谢。组氨酸能够诱发高胆固醇血症,且其在组氨酸脱羧酶的作用下脱羧形成组胺,而组胺可舒张血管,增加血管管壁的通透性,从而导致局部水肿,因此组氨酸和体内炎症反应相关[16]。色氨酸是一种限制性氨基酸,与免疫蛋白的合成密切相关,主要通过调节淋巴细胞和合成免疫球蛋白提高机体免疫力[17-18]。当机体发生炎症时,色氨酸分解代谢会增强。同时,色氨酸也是血清素神经递质的前体,血浆中色氨酸浓度的正常化会增加色氨酸对脑部的供应[19],从而为中枢神经系统提供能量和合成蛋白质,进而促进认知功能的恢复[20]。由图5C可知,炎症发生后第3 d色氨酸含量最低,此后随着炎症减轻,色氨酸的相对浓度逐渐升高,再次证明血府逐瘀汤对减轻颅脑损伤引发的炎症具有治疗效果。颅脑损伤后脂代谢紊乱,血浆中脂类的增多使血液黏度增加形成血瘀。棕榈酸是棕榈油中饱和脂肪酸的主要组成成分,研究显示棕榈酸与代谢综合征、心血管疾病、神经退行性疾病、炎症等具有相关性[21-22]。也有研究表明硬脂酸能够拮抗氧化应激造成的脑片损伤,起到神经保护作用[23]。本研究发现治疗组中棕榈酸、亚油酸、油酸、硬脂酸的含量在第1 d或第3 d最高,随后均降低,表明血府逐瘀汤具有活血化瘀调节脂代谢的作用。
文献采用氢谱核磁共振(1H NMR)技术研究了血府逐瘀汤对大鼠脑损伤的修复机理[24],发现治疗组血浆中乳酸、谷氨酸、胆碱的含量低于模型组,而N-乙酰天门冬氨酸、γ-羟基丁酸、肌酸的含量升高。本研究结果则显示,治疗组血浆中乳酸、组氨酸、棕榈酸、亚油酸、硬脂酸的相对浓度逐渐降低,油酸的相对浓度先升高后降低,色氨酸的相对浓度先降低后增加。这从一定程度上反映了GC-MS和1H NMR在代谢组学研究中的互补性。同时也提示,对于非靶标代谢组学研究,在实验条件允许的情况下,最好同时采用1H NMR和MS技术表征代谢组,以获得覆盖率更高的代谢物,用于标志物的筛选,方便获得更为全面可靠的结果。
3 结 论
本研究结合t检验和OPLS-DA,采用GC-MS对大鼠颅脑损伤模型组、治疗组以及假手术组的血浆代谢组进行定性定量分析,结果发现模型组和假手术组血浆代谢存在明显差异,并筛选出乳酸、组氨酸、棕榈酸、色氨酸、亚油酸、油酸、硬脂酸7种差异代谢物,以此为潜在标志物,观察7种代谢物在药物治疗组中的时序变化,发现经血府逐瘀汤治疗后差异代谢物含量逐渐趋近于假手术组。研究结果表明,血府逐瘀汤对颅脑损伤具有良好的治疗作用,上述7种代谢物可作为生物标志物来观察颅脑损伤患者的恢复情况及治疗效果,该研究可为血府逐瘀汤治疗颅脑损伤的临床研究提供一定的科学支撑。
猜你喜欢
杂志排行
分析测试学报的其它文章
- Simultaneous Determination of Twelve Normal and Modified Nucleosides in mRNA of Cancer Cells by Ultra-high Performance Liquid Chromatography-Tandem Mass Spectrometry
- PSS功能化海绵状石墨烯电化学传感灵敏检测瑞香素的研究
- 超高效液相色谱-串联质谱法同时测定化妆品中35种性激素
- 鸡血藤韧皮部环数与多指标成分的相关性分析
- 氧化锌QuEChERS/高效液相色谱-串联质谱法测定蜂蜜中7种林可酰胺类与大环内酯类兽药残留
- 多壁碳纳米管QuEChERS/气相色谱-质谱联用法快速检测黄芪中16种农药
