高转苷活性乳糖酶编码基因的克隆与酶学特征研究
2020-08-20田康明赵继华牛丹丹NokuthulaPeaceMCHUNU王彩喆王正祥
田康明,赵继华,牛丹丹*,Nokuthula Peace MCHUNU,王彩喆,王正祥,
1(天津科技大学 化工与材料学院,天津, 300457) 2(天津科技大学 生物工程学院,工业发酵微生物教育部重点实验室,天津, 300457) 3(Biotechnology Platform,Agricultural Research Council,Pretoria 0001,South Africa)
β-半乳糖苷酶(β-galactosidase,EC 3.2.1.23),是一类催化乳糖水解形成葡萄糖和半乳糖或通过其转苷作用形成半乳糖苷低聚糖的酶分子,因其作用的天然底物为乳糖,故常被称为乳糖酶(lactase)。已有研究表明,绝大多数已经鉴定的乳糖酶表现为水解活性,即水解乳糖等天然底物为单糖[1-2];通过改变反应环境条件,部分酶分子可以呈现转半乳糖基活性,在酶作用于乳糖分子形成酶-底物复合物后,释放乳糖分子中的葡萄糖并将半乳糖分子以乳糖中的半乳糖基为接受体,形成半乳糖聚合物,即低聚半乳糖(galacto-oligosaccharides,GOS)[3-5]。
现有研究结果表明,GOS可有效刺激肠道有益微生物增殖,有助于维持肠道微生态健康,故为现今益生元的重要组成。采用水解活性低而转苷活性高的乳糖酶,以乳糖为原料,通过酶法催化将乳糖中的半乳糖基通过酶的糖基转移作用生成半乳二糖、半乳三糖、半乳四糖等低聚糖,是现阶段工业化生产低聚半乳糖的主要方式[6-9]。因此,具有高半乳糖基转移活性的乳糖酶,是促进GOS生产技术创新的关键所在。
由于缺乏高转苷活性的乳糖酶酶制剂,我国GOS制造水平提高幅度有限,GOS产品缺乏市场竞争优势。我们在前期研究中,通过对微生物资源库的筛选,获得了具有较好转半乳糖基活性的乳糖酶产生菌BacilluscirculansB2301,其生成的乳糖酶具有催化乳糖底物形成较高比例的低聚半乳糖的能力[10]。为此,本研究通过基因克隆技术获得了其编码基因及其重组酶,并对酶学性质进行了解析,为后续针对此酶的高效表达、制备与应用奠定基础。
1 材料与方法
1.1 菌种与质粒
环状芽胞杆菌(Bacilluscirculans)B2301为本实验室前期分离、鉴定与保藏[10],用于本研究的基因供体;pET28a质粒为本实验室保藏,用于β-半乳糖苷酶编码基因的克隆;大肠杆菌(Escherichiacoli)BL21(DE3)为本实验室保藏,用于基因克隆宿主;表达载体pND113[11]和枯草杆菌(Bacillussubtilis)WB600为本实验室前期构建或保藏,用于基因的分泌表达。Luria-Bertani(LB)培养基(蛋白胨10 g/L、NaCl 10 g/L、酵母膏5 g/L,pH 7.0)用于上述菌株的培养,必要时在培养基中补加20 mg/L卡那霉素。
1.2 实验方法
1.2.1B.circulans基因组DNA的提取
B.circulansB2301基因组DNA的提取,按实验室常规方法进行[12]。将B.circulansB2301在LB培养基中培养,收获100 mg(湿质量)菌体;用0.5 mL裂解液(0.1 mg/mL溶菌酶、5 mg/mL SDS、0.1 mg/mL蛋白酶K)悬浮并在45℃下孵育4~8 h;用等体积苯酚-氯仿抽提3~5次,上清液用体积分数70%乙醇沉淀,离心收获基因组DNA,溶于5 mmol/L EDTA缓冲液(pH 8.0)中,备用。
1.2.2 乳糖酶编码基因的克隆
DNA酶切、连接、转化和质粒DNA的提取,采用实验室常规方法[12]。乳糖酶编码基因的克隆,采用鸟枪克隆术[13]。将上述获得的基因组DNA,经限制性内切酶Sau3 AI部分酶切后,通过蔗糖密度梯度离心法收集8~10 kb大小的DNA片段;通过体外连接克隆入pET28a载体中,转化大肠杆菌BL21(DE3),收获转化子并分装保藏;将转化子混合保藏物适当稀释后,涂布于补加0.1 mg/mL X-gal(上海生工)的LB培养基平板,37 ℃培养24 h;挑取呈现蓝色的菌落并进一步划线、分离、纯化与保藏;提取其中的质粒DNA,通过Sanger法进行核苷酸序列测定。
1.2.3 乳糖酶编码基因的截短与表达

1.2.4 乳糖酶的制备与纯化
表达乳糖酶的重组枯草杆菌在含50 mL LB培养基的250 mL三角瓶中,37℃、220 r/min摇瓶发酵72 h,离心收集上清液获得粗酶液,进一步通过蛋白质层析纯化系统AKTA Pure M(GE,瑞典)进行纯化。蛋白质浓度按照Bradford方法测定,以牛血清白蛋白为蛋白质标准参照[14]。
1.2.5 乳糖酶酶活力测定
按照GB/T 33409—2016《β-半乳糖苷酶活性检测方法分光光度法》[15]并参考文献[16-17]方法进行改进。反应在pH 5.0和40 ℃下进行,以2-硝基苯基-β-D-吡喃半乳糖苷(ortho-nitrophenyl-β-D-galactopyranoside,ONPG,Sigma)或乳糖为底物。采用ONPG为底物时,在波长420 nm下测定2-硝基苯的释放量;以乳糖为底物时,以生物传感仪测定葡萄糖的释放量。乳糖酶的酶活力定义为:在pH 5.0和40 ℃下,每1 min分解ONPG生成1 μmol 2-硝基苯或分解乳糖生成1 μmol葡萄糖所需的酶量,定义为1个酶活力单位(U)。
1.2.6 酶学性质分析
最适作用温度:将酶液用缓冲液(醋酸钠缓冲液,pH 4.0~6.0;磷酸缓冲液,pH 6.5~7.5;Tris-HCl,pH 8.0~9.0)适当稀释,在pH 7.0条件下,分别于不同温度(30~80 ℃)下反应,以酶活力最高时的温度计为其最适作用温度。
热稳定性:将酶液分别在不同温度(30~80 ℃)下保温1 h,取样置冰浴中30 min后,测定剩余酶活力,以4 ℃条件下保存的待测酶酶活力为100%,计算相对残余酶活力。
最适作用pH:最适pH确定在pH 3.0~9.0的缓冲液(醋酸钠缓冲液,pH 3.0~6.0;磷酸缓冲液,pH 6.5~7.5;Tris-HCl缓冲液,pH 8.0~9.0)中进行,以酶活力最高时的pH计为其最适作用pH。
pH稳定性:将酶液适当稀释后分别于pH 3.0~9.0的缓冲液中,在50 ℃条件下保温1 h,在上述酶活力测定条件下测定样本的剩余酶活力,以未保温处理的酶活力为100%,计算相对残余酶活力。
金属离子与化学品对酶活力的影响:在已确定的最优酶反应条件下,分别向反应体系中加入不同金属离子或化学物质,至终浓度为5 mmol/L,测定酶活力,以未加金属离子或化学物质的原酶液酶活力为100%,考察金属离子及化学物质对酶活力的影响。
1.2.7 酶促动力学分析
乳糖酶酶促合成GOS的动力学分析,采用文献[18]方法。在不同乳糖质量浓度(300或400 g/L)和不同温度(50和55 ℃)下,于20 mL反应体系中进行,乳糖酶添加量为15 U/g,反应时间1 h。采用OriginPro 8 软件包进行Lineweaver-Burk非线性回归计算出酶的Km和Vmax。反应体系中各组分分析,采用HPLC法[10,19]。
1.2.8 底物特异性
分别以乳糖、蔗糖、麦芽糖、半乳糖、葡萄糖、木糖、甘露糖及淀粉为底物,反应体系中含有200 g/L不同的底物,在pH 6.0和60 ℃条件下反应12 h,沸水浴10 min灭酶活力,用HPLC法分析产物[10,19]。
1.2.9 生物信息学分析
用DNASTAR分析DNA、氨基酸序列,氨基酸序列同源性用DNASTAR和ClustalW(https://www.genome.jp/tools-binDNASTAR/clustalw)分析。
2 结果与分析
2.1 鸟枪克隆法获得编码乳糖酶的编码基因
B.circulansB2301合成的乳糖酶,具有很高的半乳糖基转移活性[10]。为了克隆其乳糖酶编码基因,在查阅B.circulansNBRC 13626基因组序列后,设计相应引物并以B.circulansB2301基因组DNA为模板,进行乳糖酶编码基因扩增,但未成功;再通过制备发酵液对其乳糖酶进行纯化,也未获得理想的蛋白条带,通过蛋白质质谱分析发现未能获得其特征性寡肽序列。鉴于此,本研究采用鸟枪克隆法对其乳糖酶编码基因进行克隆。
提取B.circulansB2301基因组DNA,用Sau3 AI进行部分酶切并克隆入pET28a的BamH I酶切位点中,转化E.coliBL21(DE3),收集转化子稀释105倍,混合后分装保藏。将文库适当稀释后涂布含有X-gal的LB培养基平板,培养24 h后获得了能够分解X-gal使菌落呈现蓝色的阳性克隆GOS-236。提取纯化其中的质粒pET-gos236,通过双脱氧核苷链终止法对其进行核苷酸序列测定与分析,确定此克隆中含有一个完整开放阅读框架,命名为bglBc,大小为5 133 bp,编码1 710个氨基酸残基,预测分子质量为189.4 kDa。BglBc氨基酸序列与来源于B.circulansATCC 31382的β-半乳糖苷酶(BAJ61032)[20]相似程度最高,序列一致性为93.6%,与Bacillusmesonaeβ-半乳糖苷酶(A0A3Q9QYB9)在序列上也有较高的一致性(87.4%);与Paraliobacillussp.(A0A0U1KN21)、Paenibacillusantarcticus(A0A168PKG3)、Paenibacillusnanensis(A0A3A1V1H0)和Paenibacilluspini(W7YDH9)的序列一致性分别为63.7%、62.0%、60.4%和60.3%,与其他来源的β-半乳糖苷酶相似度较低(图1)。此外,此基因所编码的氨基酸序列中不含典型信号肽序列,与已报道的B.circulansATCC 31382的β-半乳糖苷酶有所不同,后者被认为具有一个由35个氨基酸残基组成的Sec信号肽[21]。

图1 BglBc与其他β-半乳糖苷酶的相关关系Fig.1 Relationship between BglBc and other β-galactosidases
与B.circulansATCC 31382的β-半乳糖苷酶的催化活性位点(Glu447、Tyr511和Glu532)相同,BglBC中的Glu420、Tyr483和Glu503残基组成其催化活性中心,其中2个谷氨酸残基(Glu420和Glu503)组成其酸/碱和亲核催化作用[21]。进一步对其二级结构进行分析,BglBc中含有9个结构域,其中近N端的4个结构域构成与β-半乳糖苷酶LacZ功能域结构一致[20-21]。
2.2 截短BglBc具有催化乳糖合成GOS的活性
前人对B.circulansATCC 31382 β-半乳糖苷酶的结构功能相关关系解析研究中发现,其近N端811个氨基酸残基组成的LacZ功能域,具有完整的β-半乳糖苷酶活性[20-22]。鉴于本研究克隆获得的BglBc具有与菌株ATCC 31382 β-半乳糖苷酶相似结构,本研究对其近N端782个氨基酸残基组成的功能域(BglD)在枯草杆菌WB600中成功分泌表达,表达酶活力达2.9 U/mL。进一步对发酵上清酶液进行分离纯化,获得在十二烷基硫酸钠-聚丙烯酰氨凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)上呈现单一条带的纯酶样品(图2)。

M-蛋白质标准样品;1-纯化后的BglD图2 纯化乳糖酶BglD的SDS-PAGEFig.2 SDS-PAGE profile of the purified BglD
进一步确定了重组BglD的GOS合成能力,该酶催化乳糖转化为GOS的最高转化率达52.5%(数据未呈现),与从B.circulansB2301制备的野生型乳糖酶催化合成GOS的性能相同[10]。可见,从B.circulansB2301成功克隆出的乳糖酶编码基因bglBc的截短序列bglD仍然保留了原酶分子催化合成GOS的活性。后续对其酶学性质进行进一步分析。
2.3 重组BglD的酶学性质分析
进一步对纯化的BglD酶学性质进行分析,结果汇总于图3和表1。

a-最适作用温度;b-热稳定性;c-最适作用pH;d-pH稳定性图3 乳糖酶的最适作用温度和pH及其稳定性 Fig.3 Optimal temperature and pH of BglD and its thermo- and pH stability

表1 金属离子及化学试剂对酶活性的影响Table 1 Effect of metal ions and chemicals on theenzymatic activity
以合成底物ONPG为底物时,乳糖酶BglD的最适作用温度为50 ℃、最适作用pH为6.0~6.5;以天然底物乳糖为底物时,其最适作用温度为60 ℃、最适作用pH为6.0~6.5(图3-a、3-c)。此酶在50 ℃以下和pH 5.5~7.0之间具有较好的稳定性(图3-b、3-d)。同时发现,作用于天然底物乳糖,BglD的最适作用温度更高,但最适作用pH没有显著差异,不同底物对其热稳定性和pH稳定性也没有显著影响(图3);BglD的最适作用温度略低于B.circulansATCC 31382的乳糖酶BglD-D[22]。
进一步以乳糖为底物,考察其在GOS的酶促合成中的酶反应动力学特征。结果表明,该酶在55 ℃下的Vmax为2.47 g/(L·h),Km为14.37 g/L。与已报道的KluyveromycesmarxianusIMB3和Rhizomucorsp.乳糖酶对乳糖的Km值分别为7.2[23]和9.0 g/L[24]相比,BglD对天然底物乳糖的亲和力相对较低。
金属离子与化合物对酶活力的影响,如表1所示。由表1可知,Zn2+、Fe2+、Cu2+、EDTA、SDS对重组酶表现出不同程度的抑制作用,未发现对重组酶有促进作用的离子。
2.4 重组乳糖酶酶活对乳糖具有专一性
分别以乳糖、蔗糖、麦芽糖、半乳糖、葡萄糖、木糖、甘露糖及淀粉为底物,反应体系中含有质量浓度为200 g/L的不同底物,在pH 6.0、60 ℃条件下反应12 h,沸水浴10 min灭酶活力,然后进行高效液相色谱仪分析,结果汇总于表2。重组乳糖酶BglD对乳糖表现出转苷活性,对ONPG只有水解活性而没有转苷活性,对其他测试底物则未表现出任何活性。
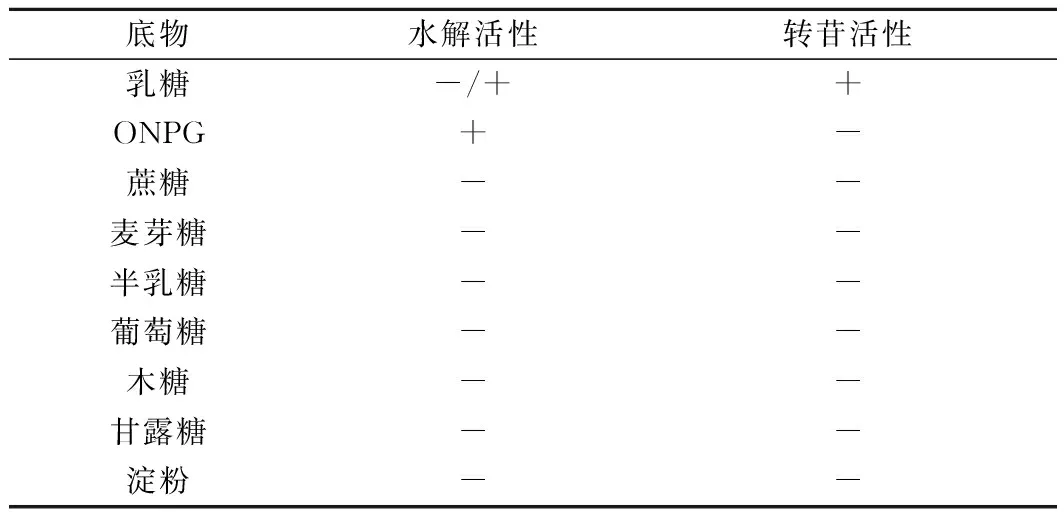
表2 BglD的底物特异性Table 2 Substrate specificity of BglD
3 结论
通过基因克隆技术,成功克隆出B.circulansB2301乳糖酶编码基因,其编码的截短序列同样具有较好的低聚半乳糖合成生化性能。
