西北酸菜中吸附黄曲霉毒素B1乳酸菌株的筛选鉴定及稳定性研究
2020-08-20唐璎孟宪刚邓展瑞马芮萍黄佳
唐璎, 孟宪刚, 邓展瑞, 马芮萍, 黄佳
1(甘肃省产品质量监督检验研究院,甘肃 兰州,730050) 2(兰州交通大学 化学与生物工程学院,甘肃 兰州,730070)
黄曲霉毒素(aflatoxin,AFT)是一类毒性很强的真菌毒素,它主要是黄曲霉(Aspergillusflavus)和寄生曲霉(Aspergillusparasiticus)次级代谢产生的二氢呋喃氧杂萘邻酮衍生物,其致癌性来源是香豆素结构,毒性来源是二氢呋喃环结构[1]。黄曲霉毒素B1(aflatoxin B1,AFB1)是已发现的AFT中毒性及致癌性最强的,1993年国际癌症研究机构(International Agency for Research on Cancer,IARC)将AFB1划分为I类致癌物。AFB1对人畜有很强的致癌、致突变、致畸性,对肝脏及免疫系统有强抑制性[2-3]。目前对AFB1有效的脱毒方式有物理、化学、生物和基因干预4种方式。物理、化学、基因干预等方法会产生有毒副产物或改变物质原有性状,破坏食品品质[4-6]。生物脱毒法可以有效地去除AFB1,其有很强的特异性。

TAHEUR等[12]从开菲尔培养物中分离出对AFB1吸附和生物转化能力强的乳酸杆菌,当pH值为4.8时,其在牛奶中能吸附82%的AFB1,在解吸实验后仍能吸附65%的AFB1。黄丽[13]从中国传统乳制品中分离出1株植物乳杆菌,吸附率为59.44%,解吸后保留20.66%的吸附率。本实验从西北酸菜中分离出AFB1脱毒菌株,丰富AFB1脱毒菌株种类,研究菌株吸附稳定性,体外模拟胃液消化,探究菌株-AFB1复合体代谢过程稳定性。
1 材料与方法
1.1 实验材料
1.1.1 菌株来源
2019年7月~8月采集甘肃兰州、天水、白银、定西等地市售西北酸菜样品,实验室前期研究西北酸菜发酵主导菌株为乳酸菌、酵母菌。CARLOS等[14]研究发现,乳酸菌对AFB1具有吸附能力,可以使AFB1脱毒;刘畅等[15]首次筛选出吸附率达81.16%的酿酒酵母Y1。试验从样品中分离纯化具有典型菌落特征的菌株,初步筛选西北酸菜中具有AFB1脱毒性能的菌株[16-17]。
1.1.2 主要试剂
(1)基础培养基
MRS培养基(CM188)、莫匹罗星锂盐(P-109)、半胱氨酸盐酸盐(P-03)、MC培养基(CM156)、磷酸盐缓冲液(CM1022)、乳酸杆菌生化鉴定套装(S021)、嗜热链球菌生化鉴定套装(S022)、营养琼脂培养基(CM107)、马铃薯葡萄糖琼脂培养基(CM123)、马铃薯-葡萄糖琼脂培养基(CM123A)、缓冲蛋白胨水(CM201),北京陆桥技术股份有限公司。
(2)基因提取、扩增试剂
DNA提取试剂盒、核酸多重PCR检测试剂盒,大连宝生物工程有限公司;核酸染料GS101-01,GELStain;AFB1标准品,TMstandard;二氯甲烷、甲醇、乙晴、苯、盐酸均为色谱纯、Sigma;NaCl(分析纯),科密欧。
(3)酶类
胃蛋白酶,Sigma,USA。
1.2 仪器设备
1300 SERLES A2-1379型生物安全柜,赛默白世尔(苏州)仪器有限公司;QTRAP 4500超高效液相色谱仪串联三重四级杆质谱联用仪,SCIEX;KH30R-II高速冷冻离心机,湖南凯达科学仪器有限公司;DJS-2016R全温度恒温摇床,上海世平实验设备有限公司;PTY-623电子天平,梅特勒-托利多仪器上海有限公司;PYC-16恒温培养箱,美国精骐有限公司;T100 PCR仪、PowerPac Basic电泳仪、GEL DOC XR+凝胶成像系统,BIO-RAD。
1.3 实验方法
1.3.1 AFB1脱毒菌株的初筛
AFB1-MRS溶液:将AFB1标准品用V(苯)∶V(乙晴)=96∶4的溶液稀释到目标浓度,加入MRS(pH 7.4)溶液中,75 ℃水浴加热20 min,蒸发溶液中苯-乙晴,制备质量浓度为10 ng/mL的AFB1-MRS溶液。
将具备典型菌落特征的菌株分离纯化,悬浮于磷酸盐缓冲液(phosphate buffer saline,PBS) (pH 7.4)中,制备成活菌浓度为109CFU/mL的菌悬液,接种于质量浓度为10 ng/mL的AFB1-MRS溶液中,孵育72 h后,离心(12 000 r/min,15 min,4 ℃),收集上清液,对上清液中残留的AFB1含量用超高效液相色谱-三重四级杆串联质谱(ultra performance liquid chromatography-tandem mass spectrometry,UPLC-MS/MS)方法进行分析,测量菌株脱去毒素的效率。选择脱毒率最高的菌株进行下一步鉴定和脱毒机制研究。按公式(1)计算AFB1脱毒率:
(1)
式中:S,AFB1脱毒率,%;C,接种菌株孵育后样品中残留AFB1的峰面积;F,对照样品AFB1的峰面积。
1.3.2 样品前处理方法及UPLC-MS/MS测定方法条件
样品前处理方法:12 000 r/min离心15 min分离发酵液,上清液经0.22 μm滤膜过滤后过免疫亲和柱,用超纯水洗滤2遍,然后用甲醇洗脱,收集洗脱液。
UPLC-MS/MS方法条件:
液相色谱:C18柱(100 mm×2.1 mm,1.7 μm);柱箱温度:40 ℃;流动相(乙酸铵/甲醇)液相色谱梯度洗脱条件见表1[18]。
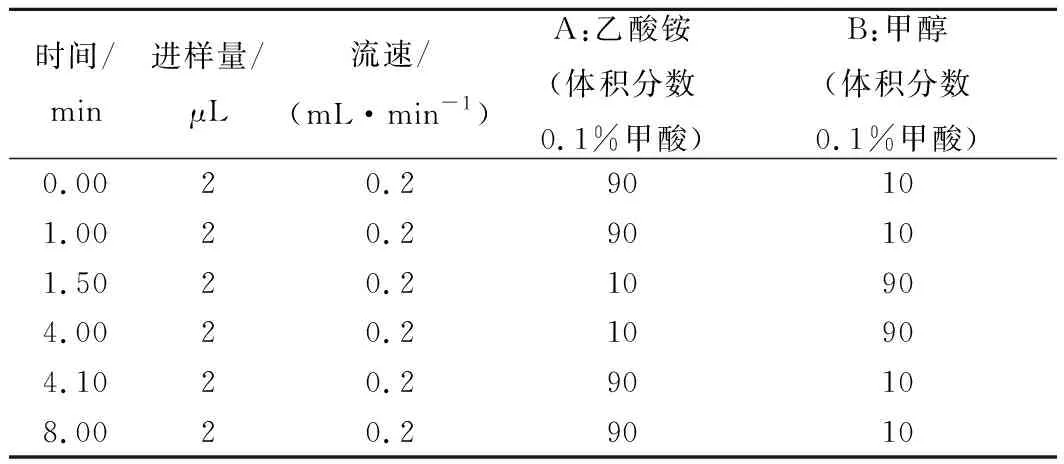
表1 液相色谱梯度洗脱条件Table 1 Gradient elution conditions for liquidchromatography
质谱条件:电离方式:电喷雾电离(electrospray ionization,ESI+);检测方式:多反应监测模式(multiple reaction monitoring,MRM);气帘气(CUR):35 psi;碰撞气(CAD):medium;离子化电压(IS):5 500 V;离子源温度:550 ℃;喷雾气(GSI):55 psi;辅助加热器(GS2):60 psi。MRM参数见表2。

表2 AFB1的质谱检测条件Table 2 Mass spectrum parameter of AFB1
1.3.3 制备热灭活菌
将活菌悬液样品在121 ℃高压湿热灭活20 min,灭菌物同时涂布MRS平板,36 ℃培养48 h作对照,验证灭菌效果。
1.3.4 菌株生长曲线
筛选菌株接种于MRS液体培养基中,36 ℃恒温振荡培养,每隔2 h测定菌株发酵液OD600值,以培养时间为横坐标,发酵液OD600值为纵坐标,绘制菌株生长曲线[19]。
1.4 高效脱毒菌株的鉴定
1.4.1 形态学鉴定
将1.3.1中筛选到的AFB1脱毒能力最强的菌株,活化2代后接种到营养琼脂培养基、MRS琼脂培养基,36 ℃培养48~72 h后,形成菌株单菌落,革兰氏染色后,油镜观察菌株形态。
1.4.2 菌株生理生化鉴定
依据《伯杰氏细菌鉴定手册》[20]、《常见细菌系统鉴定手册》[21],采用细菌生化鉴定试剂盒,对筛选出的菌株进行生理生化鉴定试验。
1.4.3 16S rRNA基因序列分析及构建系统发育树
依据细菌DNA提取试剂盒说明书提取目标菌株DNA,采用试剂盒提供通用引物27F(5′-AGACTATGATCGTCGCACTG-3′),1541R(5′-AAGGAGGTGTACCTGCC-3′)由大连宝生物工程有限公司PCR扩增试剂盒提供。PCR反应体系见表3。

表3 PCR反应体系条件Table 3 PCR reaction system condition
将PCR产物送到上海生工生物有限公司测序,测序结果提交到NCBI进行BLAST分析,将目标序列与搜索到的同源序列在GenBank下载其模式菌株,用MEGA软件中的N-J法构建系统发育树。
1.5 菌株-AFB1复合体稳定性研究
根据HERNANDEZ-MENDOZA等[22]研究,多数乳酸菌、酵母菌对AFB1脱毒机制是利用细胞壁的某些成分吸附AFB1,形成菌体-AFB1复合体,起到脱毒的效果[23]。菌株吸附通过非共价键连接AFB1毒素,吸附稳定性由菌株特异性决定,试验通过PBS洗脱,体外模拟胃部消化环境,研究已筛选到的优势菌株吸附稳定性。
1.5.1 PBS洗脱对菌株吸附稳定性影响
将筛选到的菌株经脱毒试验,离心得到沉淀,重悬于等体积的PBS溶液(pH 7.4)中,30 ℃振荡20 min,5 000 r/min离心15 min,收集上清液,重复上述步骤6次,累积收集上清液,用UPLC-MS/MS法测定其中AFB1质量浓度。利用公式(2)计算菌株脱毒稳定性:
(2)
式中:M,菌株保留吸附率,%;ρ1,累积上清液中AFB1质量浓度,ng/mL;ρ2,初始菌株复合AFB1质量浓度,ng/mL。
1.5.2 模拟体外胃液消化对菌株吸附稳定性影响
将吸附率高的菌株脱毒试验后离心得到的沉淀,重悬于胃液模拟物(体积分数90%生理盐水、体积分数5% 3 mg/mL胃蛋白酶盐酸溶液、体积分数5% 0.1 mol/L HCl溶液)[24],36 ℃,200 r/min恒温振荡培养3 h,每隔0.5 h,累计收集上清液,用UPLC-MS/MS法测定其中AFB1含量。利用1.5.1公式(2)计算菌株脱毒稳定性。
1.6 数据统计分析
2 结果与分析
2.1 菌种的筛选
从35份西北酸菜样品中分离出37株具有菌落特征的菌株,初步筛选出20株具有AFB1脱毒能力的菌株。菌株脱毒效率在18.37%~65.06%,不同菌株对AFB1脱毒能力有差异。由表4可知,菌株C2、C6、L12、P25活菌脱毒能力略高于热灭活菌株;其余菌株热灭活菌株脱毒能力高于活菌株,菌株编号为L25-2、P6、P16、C26-1活菌株与热灭活菌株在脱毒率存在统计学显著差异(P<0.05)。编号为L34-2的菌株脱毒能力最强,活菌脱毒率为66.41%,热灭活菌株脱毒率为65.06%,选择L34-2菌株进行菌种鉴定和脱毒机制的进一步研究。

表4 菌株AFB1脱毒效率 单位:%
2.2 菌株形态学及生理生化鉴定
从35份西北酸菜样品中分离到1株活菌AFB1脱毒率为66.41%的菌株L34-2,菌落呈乳白色,表面光滑湿润,半透明,中央凸起,MRS平板培养有溶钙圈,菌落大小为0.2~0.6 mm、G+,细胞短杆状或短杆状,呈链状排列,无芽孢。菌株L34-2依据《乳酸细菌分类鉴定及实验方法》[26]、《伯杰细菌鉴定手册》[20]及《常见细菌系统鉴定手册》[21]进行生理生化鉴定,将L34-2菌株初步鉴定为乳酸杆菌。菌株形态学见图1,生理生化反应见表5。

a-菌落形态;b-革兰氏染色菌株形态图1 菌株L34-2形态学特征Fig.1 Morphological properties of L34-2

表5 菌株L34-2生理生化特征Table 5 Physiological and biochemical characteristics ofstain L34-2
2.3 菌株L34-2生长曲线
菌株36 ℃培养,0~2 h时,菌株处于生长延滞期,2~6 h处于生长对数期,8~20 h,菌株生长处于平衡期,20 h后菌株OD600值缓慢下降,见图2。

图2 菌株L34-2生长曲线(36 ℃)Fig.2 Growth curve of L34-2
2.4 菌株16S rRNA基因序列分析及系统发育树构建
菌株16S rRNA基因序列经PCR扩增后,有1条长度大约1 500 bp左右的核苷酸片段被扩增出,如图3所示。

图3 L34-2菌株PCR 16S rRNA扩增产物Fig.3 PCR amplification of 16S rRNA sequencesof strain L34-2
将PCR基因扩增片段分离纯化后测序。测序基因序列运用BLAST程序比对,在GenBank中下载与L34-2同源性较高的模式菌株。通过MEGA 7软件构建系统发育树,选用2%核苷酸置换率,用N-J法构建发育树,并用bootstrap进行1 000次重复支持率。系统发育树结果如图4所示,菌株L34-2与布氏乳杆菌(Lactobacillusbuchneri)(登录号:FJ867641.1)相似度达到99%,结合L34-2菌株形态学特征、生理生化特点,鉴定L34-2菌株为布氏乳杆菌(Lactobacillusbuchneri)。将L34-2基因序列提交GenBank数据库,注册号为:HM151332。

图4 菌株L34-2系统发育树Fig.4 Phylogenetic tree of stain L34-2
2.5 菌株脱毒稳定性研究
2.5.1 PBS洗脱对菌株L34-2 AFB1脱毒稳定性研究
用PBS反复洗涤菌体-AFB1复合物,检测AFB1释放量,菌体洗脱后残留吸附AFB1含量评价菌种L34-2对AFB1吸附能力稳定性。由图5可知,第1次洗脱过程中,AFB1释放量最大,从初始吸附率66.4%降至60.1%;洗脱3次后,菌体-AFB1复合物吸附率保留54.5%,PBS洗脱6次后,吸附率保留53.7%。洗脱3和6次,菌体-AFB1复合物吸附率相似,单因素方差分析第3次及第6次洗脱后吸附率,两者没有统计学上的显著差异(P=0.06>0.05),如表6所示。洗脱3次后,复合物AFB1释放量趋于平衡,再洗脱只有微量的AFB1释放出来。布氏乳杆菌L34-2菌体吸附AFB1是一个可逆的过程,该菌株在洗脱6次后,仍保留较高的吸附率,吸附率为53.7%,菌体-AFB1复合物的稳定性取决于菌株自身的结合能力,具有菌株特异性,菌体L34-2吸附AFB1具有较好的稳定性。
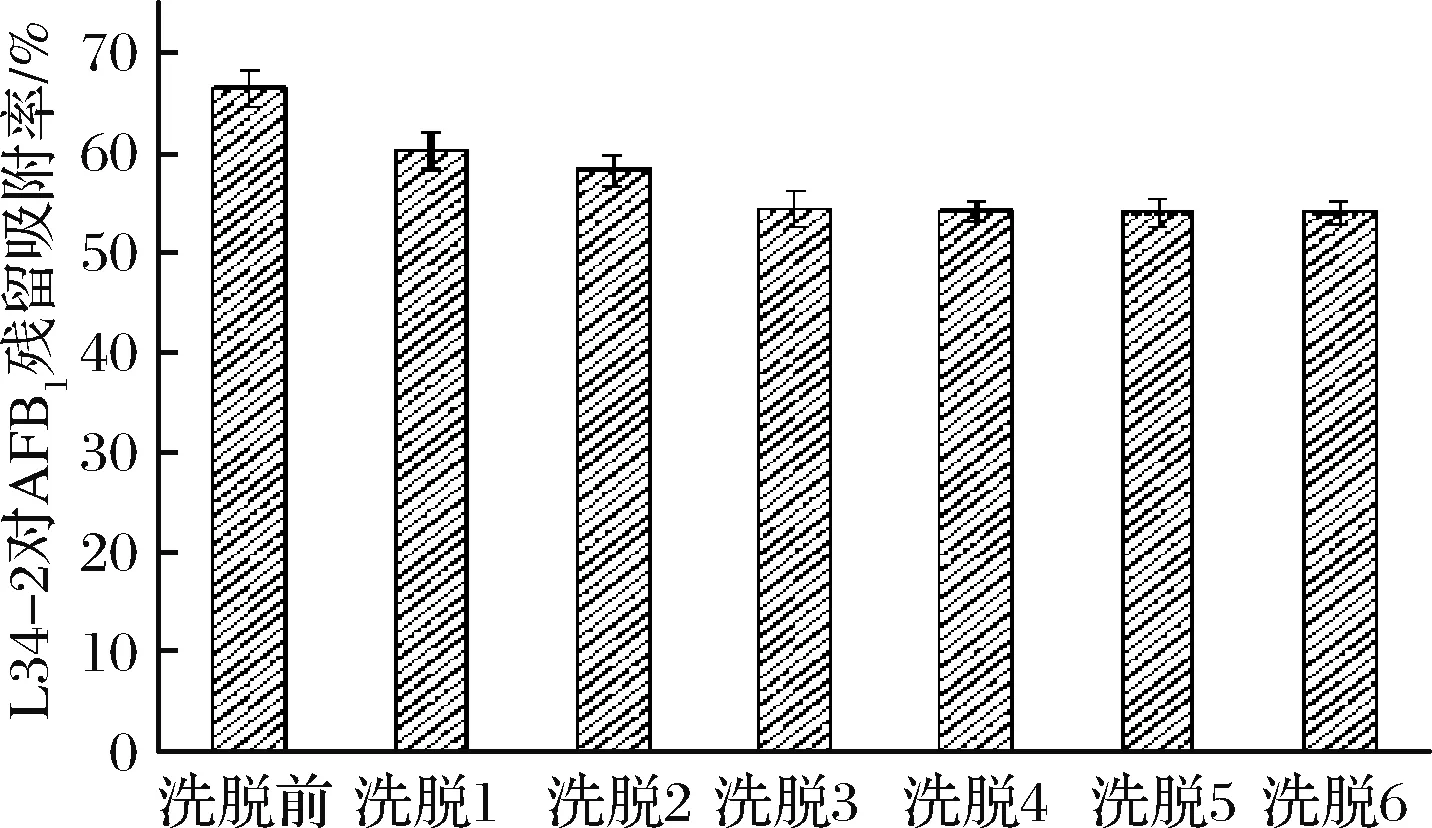
图5 洗脱对AFB1吸附稳定性影响Fig.5 Effect of elution on AFB1-strain complex

表6 洗脱次数单因素方差分析Table 6 One factor analysis of variance for elution test
2.5.2 体外模拟胃液消化对菌株吸附稳定性的影响
体外模拟胃液消化过程,研究动物消化过程对菌株-AFB1复合体稳定性的影响,评估复合体在食用后的食品安全性能。由图6可知,菌株L34-2-AFB1复合体模拟体外胃液消化0.5~1 h时,解吸出8%吸附的AFB1毒素,消化1.5 h时,菌株-AFB1复合体释放率最大,解吸出19.3%吸附的AFB1霉素。消化2~3 h,菌株-AFB1复合物释放量趋于稳定。根据单因素方差分析消化2与3 h后保留吸附率,两者没有统计学上的显著差异(P=0.07>0.05),如表7所示,说明复合体经胃液消化后,会有一定量AFB1被释放出来,但是仍有大部分菌株-AFB1复合体保持吸附,胃液消化2 h后,释放量趋于平衡,胃液消化3 h后,保留吸附率为45.9%,占初始吸附的69.1%。体外模拟胃液消化实验表明,菌株-AFB1复合体具有较好的稳定性。

图6 胃液消化对AFB1吸附稳定性影响Fig.6 Effect of gastric juice digestion on AFB1-strain complex

表7 消化时间单因素方差分析Table 7 One factor analysis of variance for variance
3 结论与讨论
本研究从35份西北酸菜样品中筛选到1株活菌AFB1吸附率达66.41%的菌株L34-2,经形态学、生理生化及基因测序,鉴定为布氏乳杆菌(Lactobacillusbuchneri)。菌株L34-2吸附稳定性研究结果表明,菌株吸附AFB1有较好的稳定性,菌株-AFB1复合体在消化过程中仍有较强的吸附性,能保障食品安全。本研究从日常食用的西北酸菜中筛选AFB1吸附率高的布式乳杆菌,与多数生物降解AFB1筛选枯草芽孢杆菌、假单胞菌属等菌株比较,菌株更适合在食品及饲料中吸附AFB1,更适应机体消化系统。与TAHEUR等[12]筛选高吸附率的乳酸杆菌比较,菌株L34-2未优化吸附率为66.41%,后续研究将通过优化菌株发酵条件,提高菌株吸附能力及稳定性。
