纳米TiO2对2种草本植物种子萌发与幼苗生长的影响
2020-08-19高梦迪盛茂银
高梦迪,盛茂银,3*
(1.贵州师范大学 喀斯特研究院,贵州 贵阳 550001;2.国家喀斯特石漠化治理工程技术研究中心,贵州 贵阳 550001;3.贵州省喀斯特石漠化防治与衍生产业工程实验室,贵州 贵阳 550001)
0 引言
纳米材料是指由极细晶粒组成、特征维度尺寸在纳米量级(0.1~100 nm)的固体材料。由于纳米材料具有小尺寸效应、表面界面效应、量子尺寸效应和量子隧道效应等特殊的物理化学特性,故在诸多领域都被关注[1]。钛(Ti)是一种对植物有显著影响的有益元素,与许多其他重金属一样,在低浓度处理下,对植物的生长发育具有促进作用,而在高剂量下处理,对植物具有毒性作用[2]。纳米TiO2作为一种常见的金属氧化物纳米材料,具有无毒、催化活性高、稳定性好以及抗氧化能力强等优点,在化妆品制造、生物制药、空气净化和废水处理等领域得到了广泛应用[3-5],但在植物领域却存有巨大差异的研究结论,如对植物产生毒性效应:造成DNA损伤[6]、抑制种子萌发与根系生长[7]、降低植物生物量[8]、干扰植物细胞分裂[9]、干扰植物蛋白合成[10]等;也有研究发现,随着纳米TiO2浓度的增加,植物种子的发芽率、发芽率指数、根长和茎长、鲜重、活力指数、叶绿素含量显著增加[11-12];纳米TiO2能有效提高藏红花的抗氧化活性,能提高藏红花的营养价值[13];在多数情况下,纳米TiO2对植物生长发育的影响多表现出高浓度抑制低浓度促进的现象[14-15]。由于目前纳米TiO2对植物的影响机制尚不清楚,有研究发现:纳米TiO2诱导植物产生过量活性氧,导致植物中的氧化胁迫,诱导其产生氧化应激反应,导致蛋白质和 DNA 损伤[16-17];纳米TiO2通过根到叶,或果实、叶子到根的途径在植物系统中完成吸收和转运,在这一过程中纳米TiO2能够促进植物对一些营养元素的吸收,进而促进植物的生长发育[18],但是如果纳米TiO2在植物组织内不断富集,超过植物本身的代谢能力,就会抑制植物的生长[19]。因此,在不同的条件下考察纳米TiO2的不同处理方法对植物的生物学效应十分必要。
草地是生态修复、石漠化治理模式中不可或缺的组分[20]。黑麦草和高羊茅因适应性广、抗逆性强,为喀斯特石漠化恢复地区优先选取草本植物[21]。本研究以黑麦草和高羊茅作为受试物种,研究不同浓度纳米TiO2对其种子萌发、根伸长、抗氧化酶活性、叶绿素含量等指标的影响,以期为纳米材料在草本植物的遗传育种中的应用提供参考。
1 材料与方法
1.1 实验材料
纳米TiO2粉末由赢创特种化学(上海)有限公司提供,其型号为AEROXIDE P25,锐钛矿80%,金红石20%,平均粒径21 nm,SPE的表面面积50 m2·g-1,纯度大于99.5%。黑麦草与高羊茅种子购于江苏三春晖种业。
主要仪器:恒温水浴锅;数控超声波清洗器;光照培养箱(MGC-300B) ;恒温振荡器;紫外可见分光光度计;高速冷冻离心机;根系扫描仪。
1.2 实验方法
1.2.1 纳米悬浮液的制备与种子预处理
分别称量纳米TiO2干粉0.01 g、0.02 g、0.04 g和0.08 g,悬浮于100 mL超纯水中。将悬浮液在超声波清洗仪中以320 W的强度超声处理30 min后,即得到浓度分别为100 mg·L-1、200 mg·L-1、400 mg·L-1和800 mg·L-1的纳米TiO2悬浮液,以超纯水作空白对照试验。收集颗粒饱满,品质良好的种子,用10%次氯酸钠溶液消毒20 min,再用纯水冲洗5次,将漂浮的劣质种子去除,保存于无菌密封袋中,贴上标签备用。
1.2.2 种子的萌发与培养
将处理好的黑麦草种子和高羊茅种子分别浸泡于100 mg·L-1、200 mg·L-1、400 mg·L-1和800 mg·L-1浓度的纳米TiO2悬浮液中,以超纯水(0 mg·L-1TiO2)处理为对照,放入恒温振荡器中以170 r·min-1转速震荡混合,24 h后取出用超纯水清洗4次。用5 mL超纯水将滤纸浸湿,每两片滤纸放在1个直径9 mm的培养皿中,每个培养皿放10粒种子。将培养皿用透气不透水的薄膜(PM-996 Parafilm M)包裹密封,并置于光照培养箱中催芽,温度设为20 ℃,无光照,每个处理3次重复,连续2 d没有新的种子发芽为实验结束。种子萌发实验结束后将幼苗移至霍格兰营养液中继续培养,生长环境设置为:白天温度25 ℃,光照6 000 lx,时间14 h;夜晚温度20 ℃,无光照,时间10 h。
1.2.3 指标测定与计算方法
1.2.3.1 种子萌发指标与根系形态指标的测定
实验开始后每24 h观察1次并记录种子萌发数,以胚根突破种皮2 mm作为种子发芽的标志,连续2 d没有新的种子发芽为实验结束,按照国家标准计算种子的发芽率、发芽势和发芽指数。将幼苗转移至霍格兰培养液中继续培养15 d后,测定各浓度纳米TiO2溶液处理的所有黑麦草和高羊茅幼苗的根系形态以及地上、地下部鲜重。
计算公式如下:
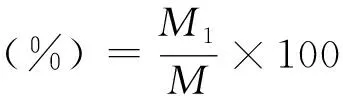
(1)

(2)
种子发芽指数(GI)=∑(Gt/Dt)
(3)
式中,M为供试种子粒数;M1为全部正常发芽粒数;M2为达到发芽高峰期的种子数;Gt为时间t内的发芽数;Dt为相应的发芽天数。
幼苗生长15 d后,将植株幼苗取出,用超纯水小心冲洗3次后用滤纸吸干其表面水分,称其鲜重,保留小数点后2位。由于单株植物幼苗鲜重过小,为直观展现鲜重的变化趋势,黑麦草在各个处理浓度下取30株进行称量,高羊茅取20株,每种浓度重复取样3次。
根长,根表面积,总投影面积,根体积和根尖数等指标采用STD 4800 SCANNER根系扫描仪对不同浓度纳米TiO2溶液处理下植物幼苗的根系进行扫描,采用WinRHIZO TRON MF图像分析软件对根系指标数据进行统计分析。
1.2.3.2 幼苗生理指标测定
酶液的制备:取0.1 g幼苗叶片擦洗干净,加入1 mL的磷酸缓冲液(0.05 moL·L-1,pH 7.0)研磨为匀浆,将匀浆倒入离心管,用PBS冲洗,定容至5 mL,在4 ℃,12 000 r·min-1条件下冷冻离心10 min,上清液即为待测酶液,置于4 ℃冰箱待用。过氧化物酶(POD) 的测定采用愈创木酚法[22]。丙二醛(MDA)的测定采用硫代巴比妥酸法[22]。叶绿素的测定采用丙酮乙醇混合液法[23]。
1.3 数据分析
采用统计分析软件SPSS 19.0 对实验所有数据进行统计分析;采用单因素方差分析(One-way ANOVA)和最小显著差法(LSD)进行差异显著性检验。
2 结果与分析
2.1 纳米TiO2对黑麦草和高羊茅种子萌发的影响
由表1可知:不同浓度的纳米TiO2对黑麦草和高羊茅种子的发芽率、发芽势和发芽指数都有不同程度的促进作用;黑麦草和高羊茅的发芽率虽然都高于对照组,但均没有显著性差异;在纳米TiO2浓度为200 mg·L-1时黑麦草种子的发芽势和发芽指数均显著高于对照组,分别提高了27.2%和44.3%,存在显著性差异;在纳米TiO2浓度为100 mg·L-1时高羊茅种子的发芽势和发芽指数均显著高于对照组,分别提高了63.6%和42.9%,存在显著性差异。
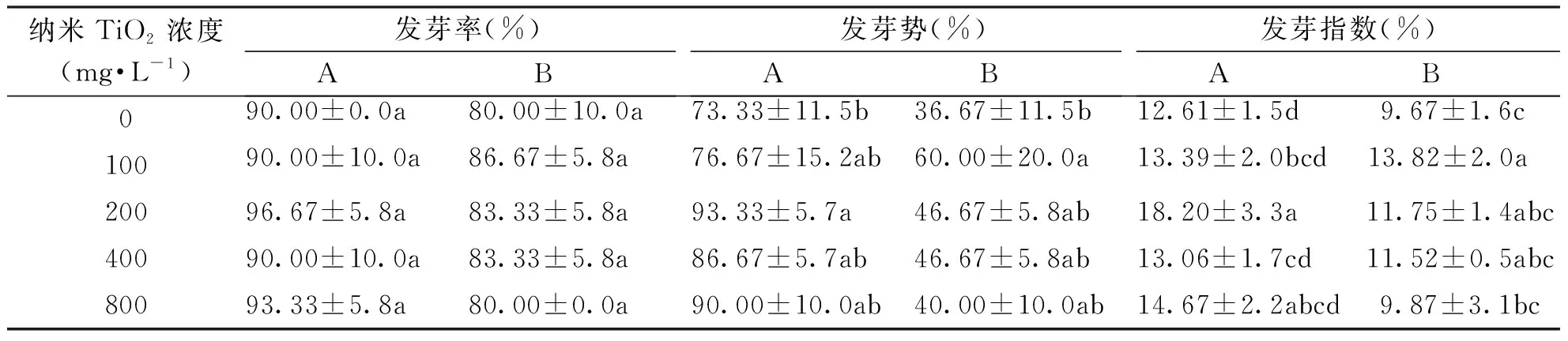
表1 纳米TiO2处理下黑麦草和高羊茅种子的发芽率、发芽势和发芽指数Tab.1 The germination rate, germination index and germination energy of L. perenne and F. arundinacea seeds treated by Nano-TiO2
2.2 纳米TiO2对种子根系形态与幼苗生长的影响
将培养于霍格兰营养液15 d的黑麦草和高羊茅幼苗取出,测定其根系形态,结果见表2。由表2可知:当纳米TiO2浓度为100 mg·L-1时对黑麦草和高羊茅幼苗的根系生长有一定促进作用;在100 mg·L-1浓度下黑麦草的根长、根表面积、根体积和根尖数分别高于对照组33.8%、47.8%、33.12%和23.8%,存在显著性差异,其余浓度处理组均不同程度的抑制了黑麦草根系的生长;在100 mg·L-1浓度下对高羊茅的根尖数具有显著促进作用,高于对照组36.9%,对根长、根表面积、根体积的促进作用明显,但不存在显著性差异;随着纳米TiO2浓度的增加,高羊茅幼苗的根系生长受到了明显的抑制作用。
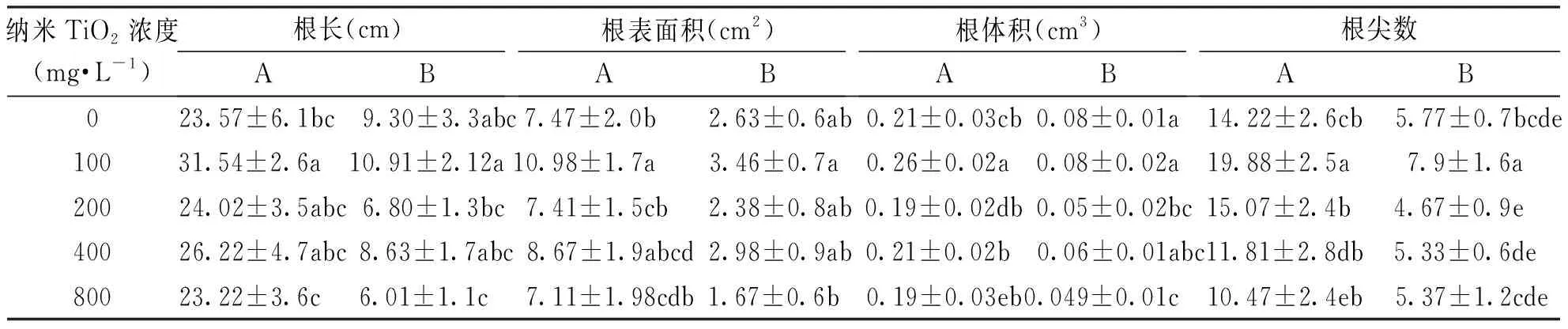
表2 不同浓度的纳米TiO2对黑麦草和高羊茅种子根系形态的影响Tab.2 Effects of different concentrations of Nano-TiO2 on root morphology of L. perenne and F. arundinacea
2.3 纳米TiO2对种子幼苗生理生化特征的影响
由表3可知:在各浓度纳米TiO2溶液处理下均不同程度的降低了黑麦草幼苗的叶绿素含量和鲜重,在浓度为800 mg·L-1时达到最低值,分别低于对照组23.0%和45.6%,具有显著性差异;在各浓度纳米TiO2溶液处理下,黑麦草POD 活性均高于对照组,且在浓度为800 mg·L-1时达到最大值,比对照极显著增加217.95%,而MDA含量呈现先下降后升高的趋势,具有显著的浓度效应,分别在浓度为100 mg·L-1和800 mg·L-1时达到最低值和最高值;各浓度纳米TiO2溶液处理的高羊茅幼苗的叶绿素含量都显著低于对照组,其含量在浓度为400 mg·L-1时达到最低值,低于对照组31.3%,具有显著性差异;各浓度纳米TiO2处理下高羊茅叶片的POD活性和MDA含量均呈现出先下降后上升的趋势,其中在处理浓度为100 mg·L-1时同时达到最低值,分别比对照降低了76.9%和74.6%;在处理浓度为400 mg·L-1时POD活性达到最高值,比对照极显著增加了124.19%,在处理浓度为800 mg·L-1时MDA含量达到最高值,比对照极显著增加了1 476.87%。
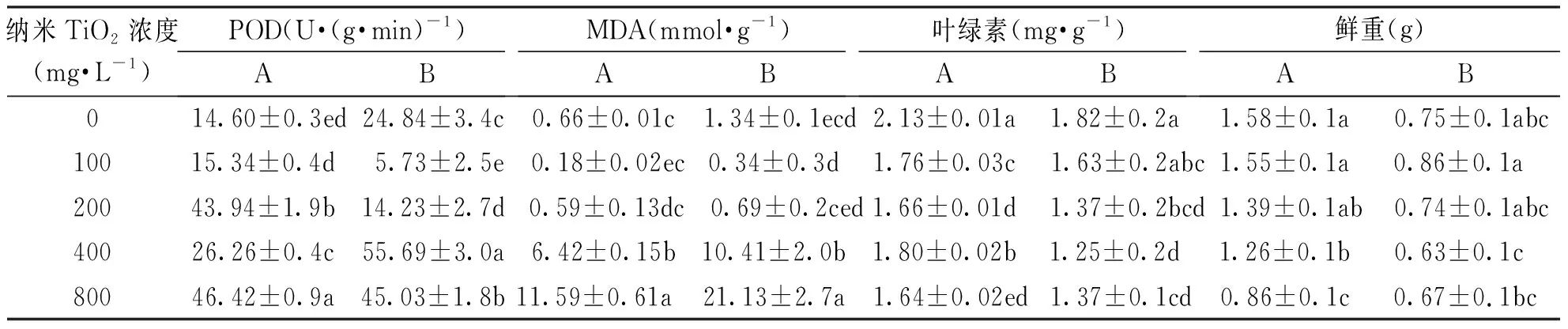
表3 纳米TiO2处理下黑麦草叶片的POD、MDA、叶绿素含量和鲜重Tab.3 POD, MDA, chlorophyll content and fresh weight of L. perenne and F. arundinace a leaves treated with Nano-TiO2
3 讨论
本试验选取了黑麦草和高羊茅为实验对象,研究了纳米TiO2对黑麦草和高羊茅的种子萌发和幼苗生长的影响,试验发现纳米TiO2对黑麦草和高羊茅种子的萌发具有显著的促进作用,但是最适浓度有所不同。黑麦草在纳米TiO2浓度为200 mg·L-1时对其种子萌发的促进效果最佳,高羊茅则在纳米TiO2浓度为100 mg·L-1时其种子萌发效果最好。这种促进作用可能是由于纳米TiO2生物亲和性较高,在低浓度处理下纳米TiO2可以穿透植物种皮,对种子萌发和植物生长有显著影响[24]。由于成熟种子相对干燥,需要吸收大量的水分才能恢复细胞代谢和生长,有研究证明纳米材料由于小尺寸效应而影响了植物内部渗透水的能力,创造了通道,从而提高了植物的吸水能力[25],进而促进种子萌发。
本研究发现纳米TiO2对黑麦草和高羊茅的根系生长以及鲜重均表现出低浓度促进,高浓度抑制的现象。这可能是纳米TiO2的高催化性和表面界面效应,使其在低浓度下能够催化植物根系中的酶活性,有效促进其水分和养分的吸收,使得植物根长、根表面积、总投影面积、根体积和根尖数有所增加,进而增加了植物的幼苗鲜重。但当纳米TiO2浓度过高时则会产生相反的效应。有研究发现,过高浓度的纳米材料会干扰植物根冠生长激素分布,破坏根伸长区微管正常排列,并扰乱根分生区细胞分裂[26],从而显著抑制植物根系的生长。
本试验发现,各浓度纳米TiO2处理都能够显著提高黑麦草幼苗叶片的POD活性。其原因可能是在纳米TiO2胁迫下会诱导产生大量的ROS,随着处理浓度的增加ROS产生量越大,为清除过量ROS,POD活性也随着增加,从而提高黑麦草幼苗的抗氧化能力。各浓度纳米TiO2处理下高羊茅叶片的POD活性呈现出先下降后上升的趋势,这表明低浓度的纳米TiO2对高羊茅抗氧化酶活性具有刺激作用,这与Rico等[27]的研究结果相似。本试验中黑麦草和高羊茅叶片MDA含量均呈现出先降低后升高的现象,说明在低浓度纳米TiO2处理下抗氧化酶活性确实降低了植物叶片细胞膜的损伤。各浓度纳米TiO2处理下黑麦草叶绿素含量均显著低于对照组,高羊茅仅在处理浓度为100 mg·L-1时叶绿素含量与对照组无显著性差异,该结果与施夏明等[28]研究结果一致,其原因可能是高浓度纳米TiO2可能通过诱导产生过量ROS,进而氧化叶绿素,降低植物光合作用。也有研究证明金属氧化物纳米颗粒会被植物吸收并吸附并聚集在叶绿体表面[29],叶细胞中有大量的纳米TiO2团聚体使细胞壁折叠、内陷,椭圆叶绿体变圆,类囊体膨胀解体,残存的基粒和基质类囊体更加肿胀、疏松,导致叶绿素含量降低[30],影响植物的光合作用,从而抑制植物幼苗生长。本研究发现在纳米TiO2处理浓度为100 mg·L-1时黑麦草和高羊茅的叶绿素含量均在一定程度上低于对照,但二者的鲜重并未与对照产生显著性差异,甚至高羊茅的鲜重高于对照14.67%。这可能是该处理浓度下幼苗的根系生长显著优于对照,有助于吸收营养液中的营养物质和无机盐,从而促进植物的生长。Alimohammadi等[31]在番茄对碳纳米管的混合反应中显示,当生物量增加时,叶绿素含量下降。
研究初步表明,低浓度的纳米TiO2(100 mg·L-1)对黑麦草和高羊茅种子萌发、根系生长具有显著促进作用,这可能是低浓度的纳米TiO2对草本植物具有较强的亲和性,能够催化植物根系的酶活性。但随着处理浓度的增加,纳米TiO2在植物组织内富集,叶绿素含量降低,细胞膜严重损伤,黑麦草和高羊茅幼苗的生长及发育受到显著抑制作用。
