例谈化工流程题中pH 条件控制的考查
2020-08-17广东唐明飞
◇ 广东 唐明飞
化工流程题是高考理综化学必考题型,该类试题综合性强,涉及物质的制备、分离提纯等内容,其中,溶液的酸碱性、温度等条件控制是考查的热点.纵观历年高考题或各地模拟题,对溶液酸碱性即调节pH的考查设问角度多、能力要求较高,归纳如下.
1 调节pH 的目的
1.1 抑制盐类水解
例1(2019 年全国卷Ⅰ,节选)硫酸铁铵[NH4Fe(SO4)2·xH2O]是一种重要的铁盐.为充分利用资源,变废为宝,在实验室中探究采用废铁屑来制备硫酸铁铵,具体流程如图1所示.
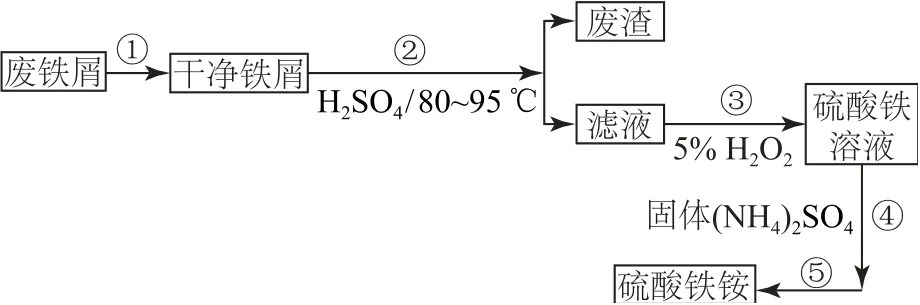
图1
步骤③中分批加入H2O2,同时为了,溶液要保持pH 小于0.5.
在配制或制备铁盐、铝盐、铜盐等易水解的盐类物质时,通常需要保持较低pH 以抑制金属离子的水解.实验证明,对于亚铁离子来说,保持较低的pH 还可以防止其被氧化.
1.2 促进盐类水解
例2(2015年全国卷Ⅰ,节选)硼及其化合物在工业上有许多用途.以铁硼矿(主要成分为Mg2B2O5·H2O 和Fe3O4,还有少量Fe2O3、FeO、CaO、Al2O3和SiO2等)为原料制备硼酸(H3BO3)的工艺流程如图2.

图2
“净化除杂”需先加H2O2溶液,作用是.然后再调节溶液的pH 约为5,目的是.
酸浸后的溶液中存在Fe2+、Fe3+和Al3+,要除去Fe3+和Al3+,最常用的方法是调节溶液的pH 使其变成氢氧化物沉淀析出.通过有关Ksp计算表明,室温下Fe3+在pH=3 左右可沉淀完全,Al3+在pH=5左右可沉淀完全;对于如何除去Fe2+,则需要将其氧化成Fe3+后再调节pH 使之水解沉淀.
1.3 促进或抑制弱电解质电离
例3(2019年全国卷Ⅰ,节选)硼酸(H3BO3)是一种重要的化工原料,广泛应用于玻璃、医药、肥料等工业.一种以硼镁矿(含Mg2B2O5·H2O、SiO2及少量Fe2O3、Al2O3)为原料生产硼酸及轻质氧化镁的工艺流程如图3所示.
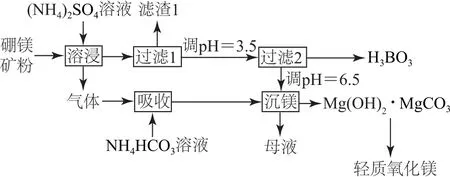
图3
根据H3BO3的水解反应:Ka=5.81×10-10,可判断H3BO3是酸;在“过滤2”前,将溶液pH 调节至3.5,目的是.
分析流程可知,过滤2 环节将H3BO3从溶液中沉淀分离,结合解离反应,不难推出调节pH 的目的是抑制H3BO3的解离,促进H3BO3析出.
1.4 实现物质的转化
例4(2017年全国卷Ⅲ,节选)重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为FeO·Cr2O3,还含有硅、铝等杂质.制备流程如图4所示.
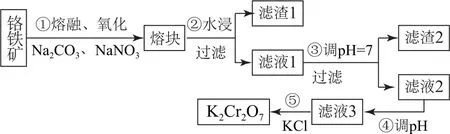
图4
矿石中硅、铝等元素主要以氧化物的形式存在,熔融时发生反应:CO2↑.故在滤液1中,存在的阴离子有及,溶液碱性较强,将溶液的pH 调节至7,并过滤后得滤渣2为Al(OH)3.滤液2调节pH 的目的是提高溶液的酸性,pH 变小,因为溶液中存在增大溶液中H+浓度,可促进平衡正向移动,提高溶液中的浓度.
2 调节pH 的范围
2.1 根据有关数据进行判断
例5(2019年全国卷Ⅲ,节选)高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如图5所示.回答下列问题:

图5
相关金属离子[c0(Mn+)=0.1mol·L-1]形成氢氧化物沉淀的pH 范围如表1所示.

表1
“调pH”除铁和铝,溶液的pH 范围应调节为~6之间.
根据表格信息,Fe3+先于Al3+沉淀析出,pH调到4.7 才能使Al3+沉淀完全,但要确保Zn2+、Ni2+不沉淀,故pH 应控制在4.7~6之间.
2.2 根据有关Ksp进行计算
例6(2015年全国卷Ⅱ,节选)酸性锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其周围是碳粉、MnO2、ZnCl2和NH4Cl等组成的糊状填充物、该电池在放电过程产生MnOOH.回收处理该废电池可得到多种化工原料.有关数据如表2所示[溶解度/(g/100g水)].

表2
用废电池的锌皮制备ZnSO4·7H2O 的过程中,需除去锌皮中的少量杂质铁,其方法是:加稀硫酸和H2O2溶解,铁变为,加碱调节至pH 为时,铁刚好完全沉淀(离子浓度小于1×10-5mol·L-1时,即可认为该离子沉淀完全);继续加碱调节至pH 为时,锌开始沉淀(假定Zn2+浓度为0.1 mol·L-1).若上述过程不加H2O2后果是,原因是.
双氧水具有强氧化性,能把Fe2+氧化为Fe3+,因此加入稀硫酸和双氧水,溶解后铁变为硫酸铁.根据氢氧化铁的溶度积常数可知,当铁离子完全沉淀时,溶液中铁离子浓度为10-5mol·L-1,则溶液中mol·L-1,所以c(H+)=2×10-3mol·L-1,pH=2.7,因此加碱调节pH 为2.7时Fe3+刚好完全沉淀.Zn2+浓度为0.1mol·L-1,根据氢氧化锌的溶度积常数可知开始沉淀时的10-8mol·L-1,c(H+)=10-6mol·L-1,pH=6,即继续加碱调节pH 为6时锌开始沉淀.如果不加双氧水,则铁与稀硫酸反应生成硫酸亚铁,由于氢氧化亚铁和氢氧化锌的溶度积常数接近,因此在沉淀Zn2+的同时Fe2+也沉淀,导致生成的氢氧化锌不纯,无法使Zn2+和Fe2+分离开.
3 调节pH 的试剂
3.1 用氧化物、碱、碳酸盐等试剂将pH 调高
例7用辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2等杂质)制备难溶于水的碱式碳酸铜的流程如图6所示.

图6
“除铁”的方法是通过调节溶液的pH,使Fe3+转化为Fe(OH)3.则加入的试剂A 可以是(填化学式).
不难分析,浸取过滤后溶液中有Fe3+、Cu2+,可将溶液的pH 调高使Fe3+转化成Fe(OH)3,故需要加入能中和硫酸的物质,同时为了防止引入杂质,可加入 CuO、Cu(OH)2或Cu2(OH)2CO3、CuCO3等.
3.2 用某种酸将pH 调低(结合流程信息)
例8钼和钒在炼钢、有机化工、高科技等领域有广泛应用.一种从炼油工业的废催化剂(主要成分为V2O5、MoO3、Al2O3、硫化物和碳氢化合物)中回收钼、钒的工艺流程如图7所示.

图7
废催化剂中硫化物和碳氢化合物在“空烧除油”中除去,气体Ⅰ是SO2.破碎煅烧时发生反应有结合后续物质分析可知,水浸后溶液中的主要阴离子是,需加入酸使铝元素沉淀,即发生反应H++H2O=Al(OH)3↓,又因为沉钒后溶液中物质为氯化钠,故该酸为HCl.
