颅内毛细胞星形细胞瘤的MR及病理对照分析
2020-08-17中国人民解放军联勤保障部队第926医院放射科云南开远661699
1.中国人民解放军联勤保障部队第926医院放射科 (云南 开远 661699)
2.中山大学第二附属医院放射科 (广东 广州 510120)
赵梓霖1 黄 聪1 罗军德1 黎 成2 王文斌1 张恒胜1
毛细胞型星形细胞瘤(Pilocytic astrocytoma,PA)是Penfield于1937年根据细胞两端细胞突起为细长的毛发样胶质纤维丝而命名的一种良性中枢神经系统肿瘤,生长缓慢,预后良好,占颅内胶质瘤的4.0%~5.0%[1]。2016年WHO中枢神经系统肿瘤分类中归类其他星形细胞瘤,WHOⅠ级,具有良性的生物学行为,手术完全切除后5年生存率可高达95%以上,10年生存率也可达到80%以上,20年生存率则在85%~95%[2-3],所以术前诊断对于外科手术的实施有重要的指导意义,本文回顾性地分析经病理证实的17例PA的MR表现及病理特点,加深对其MR表现的认识,提高术前诊断正确率。
1 资料与方法
1.1 临床资料 搜集本院及中山大学第二附属医院经手术病理证实为PA的17例患者的临床、影像及病理资料,17例PA中,男9例,女8例,年龄4~30岁,平均(17.4±8.2)岁。17例均因头晕、头痛就诊,4例合并呕吐、5例合并癫痫、1例伴有行走不稳就诊。
1.2 检查方法 17例均行MR检查。MR机采用SIEMNES 3.0T MR机,标准头颅线圈,SE、FSE序列,常规行横轴T1WI、T2WI、FLAIR、扩散加权成像(diffusion weighted imaging,DWI)及增强T1WI轴位、冠状位及矢状位。T1WI:TR/TE:400/8~20ms;T2WI:TR/TE:5000/80~130ms;FOV:230mm,层厚5mm,间隔2.0mm。增强扫描,采用对比剂磁显葡胺(Gd-DTPA),剂量0.1mmol/kg,静脉注射。
1.3 图像分析 由2名高年资放射科医师对所有病例的MR资料进行回顾性分析,观察病灶部位、形态、信号、边界、强化程度及周围水肿情况。根据病灶形态及内部信号分为单囊结节型、多囊结节型及囊实性型。水肿情况:按水肿带宽度≤2.0cm者为轻度水肿,2.0~4.0cm为中度水肿,≥4.0cm为重度水肿的标准。
1.4 病理检查 由1名病理科医师回顾性分析17例的病理切片,标本行常规HE染色和免疫组化染色,包括波形蛋白(Vimentin)、S-100蛋白、胶质纤维酸性蛋白(GFAP)等各项免疫组化。病灶部位、形态、边界及血供等情况参照手术记录。
2 结 果
2.1 病灶部位、形态、信号及边界 17例均为单发病灶,11例(64.7%)位于幕下,6例(35.3%)位于幕上,具体发病部位见表;病灶多呈圆形、卵圆形或分叶状,大小约0.6cm×2.5cm~5.6cm×6.5cm。根据病灶内部信号及实性部分所占比例,分为单囊结节型、多囊结节型及囊实性型(实性部分占病灶体积1/3及以上的均分为囊实性型):①单囊结节型(10/15,58.9%),1例囊壁菲薄,增强未见强化,9例增强轻度强化;囊液T1WI和T2WI信号与脑脊液相似,(图1-2,图5-6),T2-FLAIR呈高信号(图3、图11),DWI呈低信号,增强未见强化(图4,图7-8);结节均位于囊内,多以宽基底为主,T1WI呈低信号,T2WI呈高信号(低于囊液信号),偏大结节内可见多发小囊变信号(图1-2,图5-6),T2-FLAIR呈高信号(高于脑实质及囊液信号)(图3、图11),DWI呈低信号,增强结节明显强化(图4,图7-8);3例合并出血;1例周围轻度水肿,余均未见水肿征象。②多囊结节型(4/17,23.5%),病灶呈多房囊性改变,囊壁及分隔增厚,增强囊壁及分隔强化;囊性成分及结节信号与单囊结节型类似;2例合并出血,2周围轻度水肿。(图9-12)。③囊实性型(3/17,17.6%),囊性成分T1WI和T2WI信号与脑脊液类似,T2-FLAIR呈高信号,DWI呈低信号,增强囊壁未见强化,实性成分T1WI以稍低信号为主,T2WI以高信号为主,T2FLAIR以高信号为主,结节内见多发小囊变区;均未合并出血;1例周围轻度水肿(图13-15)。
2.2 手术与病理对照 肿瘤边界均清晰,均有完整的包膜,肿瘤组织质软,为灰黄或灰白色,4例出现轻度的瘤周水肿,5例合并出血,17例均有不同程度的囊变,囊壁内侧面光滑,囊内可见淡黄色澄清液体。光镜下见肿瘤细胞均较小,圆形或梭形,细胞一端或两端有毛发丝样角质纤维,细胞核呈圆形或椭圆形。肿瘤排列呈束状或漩涡状,部分区域细胞较密集,细胞丰富,排列紧密,为梭形细胞,并见数量不等的半透明红染物,即Rosenthal纤维;部分区域细胞较疏松,由多极细胞伴微囊变及散在嗜酸性小体组成。肿瘤组织间质血管丰富,血管扩张,增生明显,部分血管壁透明变性(图16)。17例免疫组化GFAP(胶质纤维酸性蛋白)、Vimentin均呈阳性,S-100蛋白阳性者12例,Ki67增殖指数1%~3%。见表1。
3 讨 论
3.1 临床及病理概述 PA是根据肿瘤细胞的胞突见细长的毛发样胶质纤维丝而命名的良性肿瘤,病理学上分为毛细胞型星形细胞瘤(Pilocytic astrocytoma,PA)和黏液型毛细胞星形细胞瘤(Pilomyxoid astrocytoma,PMA)。PA是边界清晰,生长缓慢的良性肿瘤,镜下可见特征性Rosentha纤维及嗜酸性小体[4]。免疫组化中GFAP(胶质纤维酸性蛋白)在PA中呈高表达的状态,表示该肿瘤分化程度较高,恶性程度比较低[5],Ki67则呈低表达状态,表示该肿瘤的低增值状态。
PA男女发病大致相等,发病年龄跨度很大,主要好发于青年和儿童,75%~88.5%发生在20岁以前,成年人则好发于幕上,发生在幕上的中位年龄为15岁[5-8]。PA的发病部位以小脑和中线结构多见,小脑约占60%、视神经交叉约占25%~30%、其次是第三脑室旁组织及脑干[5-8]。本组11例(64.7%)发生于幕下,6例(35.3%)发生于幕上,其中2例20岁以上的发生于幕下,1例20岁以下的发生于幕上。男性9例,女性8例,未见明显性别差异。

表1 17例毛细胞型星形细胞瘤分型及发病部位表
3.2 MR分型、表现及其病理表现 根据病灶囊的多少及实性瘤体所占据比例的多少将肿瘤分为3型,即单囊结节型、多囊结节型及囊实性型,其中最常见典型表现为单囊结节型,本组病例囊结节型占58.9%,多囊结节型占23.5%,囊实性型占17.6%。总结本组病例的MR表现并结合近几年的有关文献,总结颅内PA的MR表现有以下几个特点[3、6、7、9-12]:①发病部位:PA幕下好发生于小脑半球,幕上常发生在鞍区视交叉、下丘脑和脑室壁的附近,与脑室有密切关系,发生在大脑半球者以颞叶及额叶多见[5]。②囊性部分:囊变是PA一个常见的征象,T1WI呈低信号,T2WI信号高信号,T2FLAIR多以高信号为主,DWI呈低信号,本组病例均有不同程度的囊变,文献报道多发微囊不是肿瘤坏死囊变造成,可能为肿瘤细胞分泌形成的小囊泡逐渐汇集而成[13],这种微囊的囊液通常能够在T2FLAIR呈低信号,而囊液不能抑制下来的囊通常较大。本组病例16例囊液T2FLAIR均呈高信号。③囊壁:不管是单囊还是多囊的囊壁均光滑,增强无强化或轻中度强化,囊壁强化说明囊壁和肿瘤的实性成分、壁结节一样是由活性的肿瘤细胞构成,而不强化的囊壁则是由受压的脑组织和反应性增生的胶质构成[13]。但是囊壁强化的原因尚无定论,部分学者随访发现囊壁是否切除与生存率没有明显的关系,故不认同囊壁是由肿瘤成分构成的观点[14]。本组病例只有4例囊壁无强化,其余囊壁均有轻或中度强化。④结节或实性瘤体:结节或实性瘤体均位于囊内,T1WI呈低信号,T2WI呈高信号,T2FLAIR呈等或高信号,DWI呈等或低信号,较大结节或实性瘤体内均见多发小囊变区,T1WI呈低信号,T2WI呈高信号,T2FLAIR呈低信号,呈“囊中有瘤,瘤中有囊”的征象,增强结节或实性瘤体明显强化。PA的强化主要是与肿瘤血管的自身特点有关,文献报道[15]造影剂是通过胞饮作用通过肿瘤的血管内皮细胞,因此证明了PA的强化是由于其毛细血管通透性增高而引起的强化,并不是因为血脑屏障破坏而引起的。⑤瘤周水肿与出血:一般瘤周水肿程度与肿瘤的恶性程度相关,而PA的瘤周多无或轻度水肿,这也说明了PA良性肿瘤的特点。也有文献[16]认为瘤周水肿与肿瘤内部出血相关,本组病例中5例合并出血,而其中只有1例合并了轻度水肿,因此这个理论仍需进一步的研究验证。⑥磁共振波普成像(MRS)、磁共振灌注成像(PWI)[17]:PA的MRS显示肿瘤实质的Cho峰升高,NAA降低,Cho/NAA升高,达1.8~3.4(正常小脑0.53~0.75),Cho/Cr升高,有时可见乳酸峰(Lac),Lac/Cr也升高。Lac升高并非由于肿瘤坏死,因PA很少产生坏死,H.Wang认为可能是由于细胞线粒体改变或葡萄糖利用率变异所致。PWI研究显示,PA的rCBV值(相对局部脑血容量)平均为(1.8±1.8)。此外白岩等[18]应用DWI都b值水通蛋白分子成像技术可以反映胶质瘤的分级,段筱璠等[19]采用高b值(1800~4000s/mm2),应用AQP后处理软件,测量肿瘤实质区的AQPADC值,可以判断肿瘤的分级,而苏昌亮等[20]则应用MR氧摄取分数成像测量摄取分数(OEF)值为鉴别高低级别胶质瘤提供了定量的诊断参数,能从分子层面描述肿瘤组织氧摄取的改变,并能一定程度上反应肿瘤的增值活性。这些新技术的不断应用,对临床的治疗及手术方式也提供了很多帮助。
3.3 鉴别诊断 幕下主要与血管母细胞瘤、髓母细胞瘤、转移瘤等鉴别。①血管母细胞瘤:好发于中青年人,主要的MRI表现也是大囊小结节,但是血管母细胞瘤的附壁结节通常较小并且附壁结节内血供丰富,血管母细胞瘤的rCBV值为(7.7±1.0),与PA的明显不同,有重要的鉴别诊断价值[17]。②髓母细胞瘤:好发于儿童,多位于小脑蚓部,信号多均匀,DWI呈高信号,其内可合并小囊变,但囊变远远不如PA的明显。③转移瘤:多有原发肿瘤病史,发病年龄较大,囊壁厚薄不均、环状强化,周围见大片的水肿带。
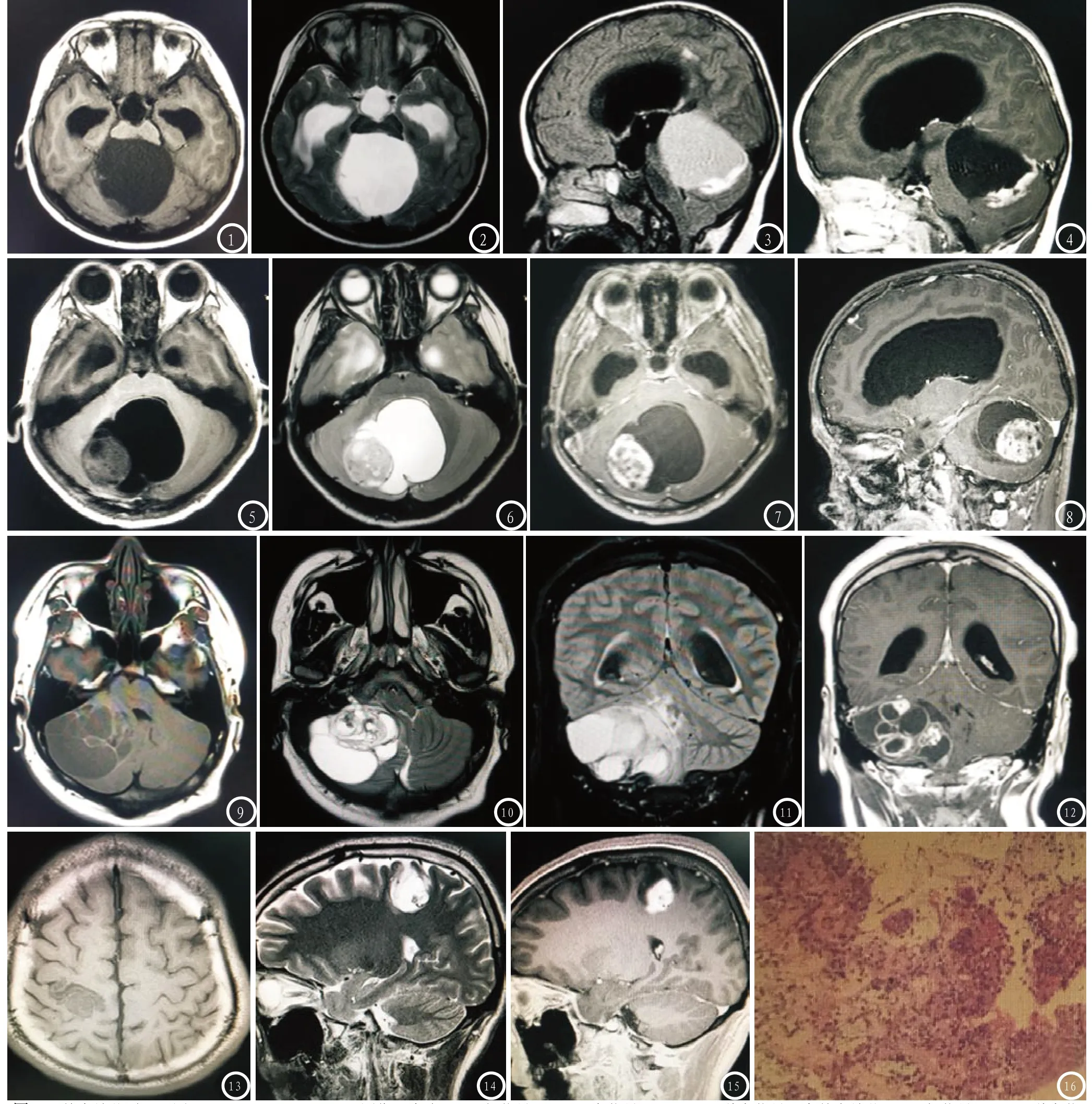
图1-4 单囊结节型PA。图1-3 T1WI、T2WI及T2FLAIR图像示囊液T1WI呈低信号,T2WI呈高信号,T2FLAIR呈稍高信号,宽基底结节T1WI呈低信号,T2WI呈稍高信号,T2FLAIR呈高信号(高于囊液信号);图4 T1WI增强图像:结节明显强化,囊壁未见强化;图5-8 单囊结节型PA。图5-6 T1WI、T2WI图像示囊液T1WI呈低信号,T2WI呈高信号,实性部分T1WI以低信号为主,T2WI以稍高信号为主,结节内见多发囊变区,呈“囊中有瘤,瘤中有囊”的表现;图7-8 T1WI增强图像示结节明显不均匀强化,囊壁轻度强化,囊液及小囊变区未见强化;图9-12 多囊结节型PA。图9-11 T1WI、T2WI及T2FLAIR图像示病灶呈多房囊性改变,囊壁及间隔稍厚,囊液T1WI呈低信号,T2WI呈高信号影,T2FLAIR呈高信号,分隔T1WI呈高信号影,T2WI呈低信号,部分分隔边缘见更低信号(病理证实合并了出血);图12 T1WI增强图像示病灶内见多个结节状明显强化灶,分隔明显强化;图13-16 囊实性型PA。图13-14 T1WI、T2WI图显示囊实性肿块,T1WI以低信号为主,T2WI以高信号为主,周围轻度水肿。图15 T1WI增强图像示实性部分明显强化,囊性成分未见强化。图16 病理图示瘤细胞呈束状或漩涡状,间质微囊状,散在一些嗜酸性小体,血管丰富,瘤细胞呈双极长梭形。
幕上则主要与少突胶质瘤、节细胞胶质瘤、胚胎发育不良性神经上皮瘤等鉴别。①少突胶质细胞瘤:好发于30~50岁,以额叶常见,多见皮质或皮质下的弯曲的条带状的钙化肿块,可囊变呈囊结节型,结节及囊壁可无强化或不均匀强化,瘤周水肿多较轻[21-22]。②节细胞胶质瘤:多发于儿童和30岁以下成人,以颞叶最多见,实质性病变多无强化或轻度强化,以囊性变伴强化壁结节或局部脑回增厚为典型表现,无或轻度瘤周水肿,实质内可见斑点状钙化,结合临床表现,特别是长期顽固性癫痫者[22],均应考虑此病。③胚胎发育不良性神经上皮瘤:发病年龄小,常发生在颞叶皮质内,呈多发小囊变,呈羽毛状,T2WI上呈高信号以及缺乏瘤周水肿及占位表现,增强后多无强化或轻度强化,多伴有皮层发育不良。