BNIP3介导的线粒体自噬对低氧环境下卵巢癌HO-8910PM细胞侵袭转移的影响
2020-08-17陈国庆叶萍徐玲谢晓英
陈国庆,叶萍,徐玲,谢晓英△
线粒体是细胞产生腺苷三磷酸(ATP)以维持生命活动的重要细胞器,在低氧条件下,线粒体内产生大量活性氧(ROS),诱发强烈的氧化应激反应而导致缺氧性细胞损伤[1]。卵巢癌细胞由于生长迅速、代谢活跃、耗氧量大而常处于低氧环境中。然而卵巢癌细胞线粒体结构完整、数量丰富,极少出现缺氧性细胞损伤,其抗缺氧损伤机制暂未完全阐明。线粒体自噬是在低氧等不良环境下细胞自我吞噬、清除受损线粒体以维持内环境稳态的重要调节机制。笔者前期研究已证实卵巢癌细胞自噬与增殖的关系[2],然而有关线粒体自噬与卵巢癌转移的关系报道罕见。B 淋巴细胞瘤-2 基因/腺病毒E1B 相互作用蛋白3(BNIP3)是定位于线粒体外膜的蛋白,在特定条件下与自噬微管相关蛋白轻链3-Ⅱ(LC3-Ⅱ)介导自噬从而清除受损线粒体[3]。卵巢癌细胞是否通过BNIP3调控线粒体自噬来维持在低氧条件下继续向远处转移目前尚未明确。本研究将模拟卵巢癌体内低氧环境,应用人高转移性卵巢癌细胞株HO-8910PM 制作体外低氧细胞模型,分析低氧条件下BNIP3 的表达变化,以及该条件下抑制BNIP3 表达对细胞线粒体自噬的影响,并分析细胞侵袭转移功能的变化,为进一步明确卵巢癌可能的转移机制提供新的理论依据。
1 材料与方法
1.1 细胞系、主要试剂及设备 人高转移性卵巢癌细胞系HO-8910PM 由重庆医科大学病理生理教研室赠与。DMEM细胞培养基、胎牛血清、胰蛋白酶等购自南京沃利尔斯生物技术有限公司;BNIP3 siRNA 由上海吉玛制药技术有限公司设计合成;Transwell小室购自Corning公司;BNIP3及LC3-Ⅱ单克隆抗体(一抗)购自深圳市牛启生物技术有限公司;实时荧光定量PCR(qPCR)及Western blot实验等相关试剂盒购自赛恩斯(深圳)生命科学有限公司。H-7500 型透射电镜购自日本HITACHI公司;PCR仪、化学显像仪等购自美国Bio-Rad。
1.2 低氧模型设计与实验分组 取生长对数期HO-8910PM细胞应用于相关实验。实验共分为3组:常氧组、低氧组、低氧+BNIP3 siRNA组,其中常氧组气体条件为20%O2、5%CO2、75%N2;而低氧组、低氧+BNIP3 siRNA 组的气体条件为2%O2、5%CO2、93%N2。上述各组细胞先按常规环境孵育12 h,待细胞进入生长对数期且密度在60%~80%时,参照不同气体条件分组处理48 h,每组均为5个样本。
1.3 BNIP3 siRNA 转染 应用胰蛋白酶将生长对数期HO-8910PM 细胞消化并制作细胞悬液,将细胞悬接种在6 孔板上,并使每孔细胞为1.0×105个。常规培养12 h 待细胞贴壁后,在低氧+BNIP3 siRNA 组加入终浓度为5 nmol/L 的BNIP3 siRNA 并放置于低氧条件进行转染,处理48 h 进行后续实验。
1.4 吖啶橙染色分析线粒体自噬情况 各组细胞在培养结束前10 min 加入终浓度为1 mg/L 的吖啶橙染液进行活体染色,后去除含吖啶橙的培养液,并应用无菌PBS 液反复清洗细胞,最后应用荧光显微镜观察细胞染色情况。线粒体自噬小体为酸性小体,将被吖啶橙染为红色,而未发生线粒体自噬的细胞浆,将呈现绿色荧光。在400 倍镜下计数500 个细胞,计算阳性细胞所占比率作为细胞自噬率。
1.5 透射电镜观察细胞线粒体自噬小体 各组细胞经处理后在2.5%的戊二醛溶液中低温固定12 h,应用1%锇酸再次固定,经乙醇与丙酮梯度脱水、环氧树脂618浸透、包埋等步骤后,制成70 nm超薄切片,使用枸橼酸铅和醋酸铀进行电子染色。将切片置于透射电镜下,观察各组细胞形态结构的变化,重点观察线粒体自噬小体的产生情况,以及其他超微结构的改变,并将发现3个以上线粒体自噬小体的细胞视为阳性细胞,随机观察100个细胞,计数细胞自噬体发生率。
1.6 划痕实验检测细胞迁移率 应用生长对数期HO-8910PM细胞制作细胞悬液,调整细胞浓度为5×105个/mL,将细胞接种于6孔板内,常规培养24 h后在培养板底部划痕,并应用无菌PBS将划痕脱落的悬空细胞除去后进行分组处理。分别置于常氧和低氧条件下孵育48 h后,于显微镜下观察划痕部位的细胞分布情况,并计数细胞迁移率:低氧组(或BNIP3 siRNA+低氧组)迁移细胞数/常氧组迁移细胞数×100%。
1.7 Transwell 小室检测细胞侵袭率 取出Transwell 小室,置于4 ℃预冷,按1∶8比例用PBS缓冲液配制Matrigel胶工作液,取此工作液100 μL从小室内壁缓慢注入完成铺胶,37 ℃条件下放置30 min备用。取24孔板并向其注入包含10%胎牛血清的细胞培养液600 μL/孔,将小室放置于24孔板中,向小室加入细胞浓度为2×106个/mL 的细胞悬液各100 μL。按常氧及低氧条件培养48 h,后经去除上室未穿膜细胞、固定、伊红染色。在200 倍光镜下,随机读取10 个视野,计数膜背侧的穿膜数,并计算侵袭率:低氧组(或BNIP3 siRNA+低氧组)穿膜细胞数/常氧组穿膜细胞数×100%。
1.8 qPCR检测BNIP3及LC3-Ⅱ的基因表达 应用Trizol试剂提取已经处理48 h 的细胞总RNA,对总RNA 进行定量分析并逆转录成cDNA,以β-actin作为内参基因,分别检测BNIP3及LC3-ⅡmRNA 的表达量。按下述体系进行qPCR:SYBR Premix EX TaqTMⅡ 12.5 μL,上、下游引物各0.5 μL,模板cDNA 2 μL,后应用无菌双蒸水补足至25 μL。PCR 反应条件为95 ℃预变性10 min;94 ℃变性15 s,60 ℃退火30 s,共计循环40 次,引物序列见表1,BNIP3及LC3-Ⅱ相对表达量以 2-ΔΔCt法计算。
1.9 Western blot 检测BNIP3 及LC3-Ⅱ的蛋白表达 消化、收集3 组经处理的HO-8910PM 细胞,按照Western blot 试剂盒进行操作,首先加入细胞裂解液处理细胞,提取总蛋白后采用BCA 法进行蛋白定量,后经下述步骤进行Western blot:SDS-PAGE、转膜、封闭抗体,清洗后加入一抗(抗BNIP3 和LC3-Ⅱ),放置4 ℃冰箱过夜,清洗后加入二抗,37 ℃反应1 h,再经化学显色,最后将反应膜放入成像仪中分析,用Quantity one软件分析BNIP3和LC3-Ⅱ蛋白的相对表达量。

Tab.1 Primer sequence of qPCR表1 实时荧光定量PCR引物序列
1.10 统计学方法 应用SPSS 17.0 软件进行统计学分析。计量资料以均数±标准差()表示,组间比较采用单因素方差分析,组间多重比较采用LSD-t检验,检验水准α=0.05。
2 结果
2.1 低氧及转染BNIP3 siRNA 对HO-8910PM 细胞线粒体自噬的影响 吖啶橙染色结果显示,在低氧条件下,卵巢癌HO-8910PM细胞线粒体自噬率显著增加,在低氧基础上联合转染BNIP3 siRNA 可明显抑制线粒体自噬(均P<0.01),见表2、图1。透射电镜结果显示,在低氧环境下,HO-8910PM 细胞胞浆内双膜结构的线粒体自噬小体显著增多,低氧联合转染BNIP3 siRNA 细胞可见大量线粒体肿胀、崩裂现象,而线粒体自噬小体明显减少(均P<0.01)。见表2、图2。

Fig.1 Mitophagy of HO-8910PM cells stained with acridine orange in three groups(×400)图1 HO-8910PM细胞经处理后吖啶橙染色线粒体自噬发生情况(×400)
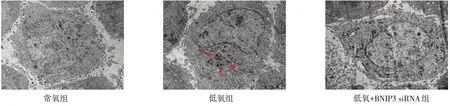
Fig.2 Mitophagy in HO-8910PM cells under TEM in three groups(×10 000)图2 HO-8910PM细胞经处理后透射电镜下线粒体自噬发生情况(×10 000)

Fig.3 Migration ability of HO-8910PM cells under different treatment factors in three groups(×200)图3 HO-8910PM细胞不同处理因素下迁移能力情况(×200)
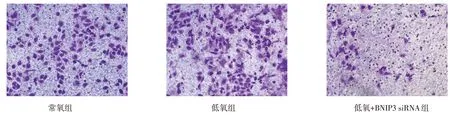
Fig.4 Changes of invasion ability of HO-8910PM cells under different conditions in three groups(×200)图4 不同条件下HO-8910PM细胞侵袭能力变化(×200)
Tab.2 Effects of hypoxia and BNIP3 siRNA on mitophagy rate of HO-8910PM cells表2 低氧及转染BNIP3 siRNA对HO-8910PM细胞线粒体自噬率的影响 (n=5,%,)
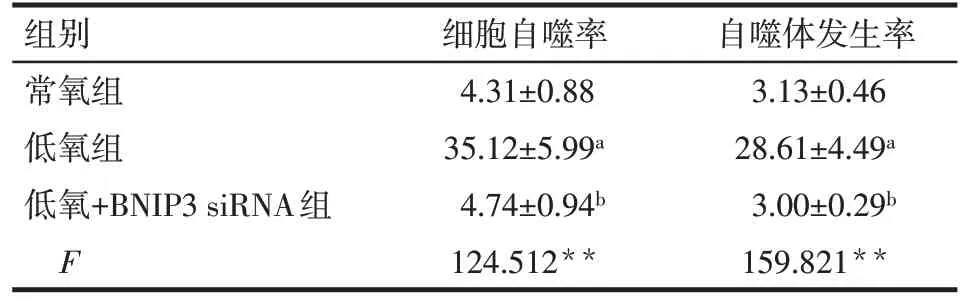
Tab.2 Effects of hypoxia and BNIP3 siRNA on mitophagy rate of HO-8910PM cells表2 低氧及转染BNIP3 siRNA对HO-8910PM细胞线粒体自噬率的影响 (n=5,%,)
**P<0.01;a与常氧组比较,b与低氧组比较,P<0.05
组别常氧组低氧组低氧+BNIP3 siRNA组F细胞自噬率4.31±0.88 35.12±5.99a 4.74±0.94b 124.512**自噬体发生率3.13±0.46 28.61±4.49a 3.00±0.29b 159.821**
2.2 低氧及转染BNIP3 siRNA 对HO-8910PM 细胞迁移能力的影响 低氧条件下细胞迁移率与常氧条件下差异无统计学意义(96.39%±1.25%vs.100%),而低氧+BNIP3 siRNA 组(27.69%±5.33%)细胞迁移率较低氧组降低(n=5,F=831.061,P<0.01),见图3。
2.3 低氧及转染BNIP3 siRNA 对HO-8910PM 细胞侵袭能力的影响 低氧条件下,Transwell 小室穿膜细胞数与常氧条件下差异无统计学意义(99.73%±9.69%vs.100%),而低氧+BNIP3 siRNA 组(19.90%±3.25%)较低氧组细胞侵袭率显著降低(n=5,F=306.158,P<0.01),见图4。
2.4 低氧及转染BNIP3 siRNA 对BNIP3、LC3-Ⅱ基因表达的影响 低氧组卵巢癌HO-8910PM 细胞BNIP3、LC3-Ⅱ的基因表达量较常氧组显著升高(P<0.05),而在低氧条件下转染BNIP3 siRNA 后细胞BNIP3、LC3-Ⅱ的基因表达量显著下降(P<0.05),见表3。
Tab.3 Effects of BNIP3 siRNA transfection on the expressions of related genes and proteins in HO-8910PM cells under hypoxia and hypoxia conditions表3 低氧及低氧条件下转染BNIP3 siRNA对HO-8910PM细胞相关基因及蛋白表达的影响(n=5,)

Tab.3 Effects of BNIP3 siRNA transfection on the expressions of related genes and proteins in HO-8910PM cells under hypoxia and hypoxia conditions表3 低氧及低氧条件下转染BNIP3 siRNA对HO-8910PM细胞相关基因及蛋白表达的影响(n=5,)
**P<0.01;a与常氧组比较,b与低氧组比较,P<0.05
组别常氧组低氧组低氧+BNIP3 siRNA组F mRNA相对表达量BNIP3 1.00±0.00 2.28±0.11a 0.84±0.16ab LC3-Ⅱ1.00±0.00 3.67±0.73a 0.71±0.14b蛋白相对表达量BNIP3 0.33±0.06 0.93±0.06a 0.31±0.06b LC3-Ⅱ0.37±0.05 0.91±0.06a 0.27±0.07ab 263.973**72.141**169.800**146.944**
2.5 低氧及转染BNIP3 siRNA 对BNIP3、LC3-Ⅱ蛋白表达的影响 低氧组卵巢癌HO-8910PM 细胞BNIP3、LC3-Ⅱ的蛋白表达量较常氧组显著升高(P<0.05),而在低氧条件下转染BNIP3 siRNA 后细胞BNIP3、LC3-Ⅱ的蛋白表达量显著下降(P<0.05),见表3、图5。

Fig.5 Expressions of BNIP3 and LC3-Ⅱin HO-8910PM cells under different conditions图5 不同条件下HO-8910PM细胞BNIP3及LC3-Ⅱ表达变化
3 讨论
3.1 转移是导致卵巢癌患者5年生存率低的重要原因 由于卵巢位于盆腔深处,在本病确诊时大多已处于中晚期,因而常伴癌细胞广泛转移,导致卵巢癌的死亡率居高难下,因此抑制转移是治疗卵巢癌亟待解决的重要问题[4]。探明卵巢癌转移的通路和分子机制是制定抑制转移治疗方案的根本途径。目前有关卵巢癌细胞转移的机制仍集中于细胞在离巢后释放大量促进血管生长的因子,为新发癌灶提供血液营养,并最终形成转移灶[5-7]。然而,卵巢癌在脱离了原发灶向远处游出时失去母瘤血供,导致细胞处于缺血、缺营养的微环境,在新生血管形成前卵巢癌细胞通过何种机制避免凋亡而继续生存的机制仍不清楚。
3.2 线粒体自噬是低氧条件下卵巢癌细胞自我保护的重要机制 线粒体是细胞氧化供能的重要场所,在缺氧条件下,线粒体氧化反应障碍可生成大量ROS而受损,同时发生线粒体膜电位变化,导致膜内外线粒体电解质浓度差异常,抑制了相关酶活性,进一步加重线粒体功能障碍,如受损线粒体不及时清除,会将大量ROS等释放至细胞质中,最终导致细胞死亡[8]。线粒体自噬是细胞在缺氧等不利环境下自我吞噬清除线粒体、维持细胞继续生存的生物学现象[9-10]。笔者推测卵巢癌细胞在脱离母瘤后处于低氧环境,细胞启动线粒体自噬,及时清除了受损线粒体,避免了出现缺氧性细胞损伤,在癌细胞生成新转移灶、得到新的血供之前发挥了关键作用。
BNIP3 是一种线粒体外膜蛋白,可与LC3 等自噬蛋白结合,介导形成自噬小体并消化线粒体[11]。本研究证实,卵巢癌HO-8910PM 细胞在低氧条件下,线粒体外膜蛋白BNIP3表达量显著增加,与常氧条件下的细胞相比其mRNA 的表达量明显增加,而经过翻译最终成熟BNIP3蛋白相应增加。形态学分析可见,低氧条件下细胞线粒体自噬活性显著增加。在吖啶橙染色后观察到细胞质出现大量的红色嗜酸性染色区域,而透射电镜更为直观地证实了这一结果。在透射电镜下,低氧条件的HO-8910PM细胞自噬活性明显增强,胞浆处易见被双膜结构包裹的线粒体自噬小体,其中线粒体可见形态异常、肿胀等变化,而自噬体外的线粒体大多完好无损。本研究证实,在低氧条件下HO-8910PM 细胞LC3-Ⅱ表达量显著增高,上述结果均提示,低氧条件下细胞启动线粒体自噬,清除受损的线粒体,这与其他种类细胞在低氧时表达增加的报道一致[12-13]。本研究结果证实,抑制BNIP3 的表达可显著抑制低氧环境时的线粒体自噬发生率。透射电镜观察到抑制BNIP3的表达后线粒体自噬小体显著减少,同时细胞出现典型的缺氧性细胞损伤的超微结构变化,即线粒体肿胀、崩裂、溶解等,正常形态的线粒体少见,并可伴细胞凋亡小体出现。qPCR 及Western blot 实验也证实,抑制BNIP3 的表达后LC3-Ⅱ表达量也随之明显下降。
3.3 BNIP3 表达增加促进线粒体自噬 本研究显示,HO-8910PM 细胞在低氧条件下,通过增加BNIP3 表达启动线粒体自噬并保护细胞,以维持细胞具有正常的迁移及侵袭能力,因此笔者推测BNIP3是卵巢癌转移的重要靶点。癌细胞通过基质黏附、运动缓慢向远处游走、转移[14],在此过程中必须提供大量ATP为黏附、运动供能,并保障细胞内正常氧化反应的进行,一旦线粒体功能受损,则出现供能不足,其转移功能受抑。抑制BNIP3 可显著抑制细胞转移,但并不能完全阻止其转移,这提示卵巢癌细胞还有其他途径和机制进行离巢后生存和转移。已有研究证实,高转移性卵巢癌可表达整合素α5(integrin α5,TGA5),易通过与瘤体组织中肿瘤相关成纤维细胞(cancer-associated fibroblasts,CAFs)结合,形成细胞球并组成卵巢癌转移单元(metastatic units,MUs),成纤维细胞能够促进腹水中卵巢癌细胞的存活,并协助发生腹膜浸润[15]。
总之,本研究初步证实卵巢癌HO-8910PM细胞在低氧条件下通过增加线粒体膜蛋白BNIP3的表达启动线粒体自噬清除受损线粒体,实现细胞自我保护机制。在低氧条件下,抑制BNIP3表达时,线粒体自噬显著受抑,细胞自我保护功能被破坏,出现典型的缺氧性细胞损伤变化,细胞迁移和侵袭功能均受到明显抑制,因此推测BNIP3 是卵巢癌转移的重要靶点。由于线粒体自噬及卵巢癌转移的调控机制均为众多分子参与的多通路网络调控,BNIP3 在卵巢癌转移中的详尽机制仍待进一步探索。
