绞股蓝总皂苷对高胆固醇血症模型小鼠主要尿蛋白家族基因表达的影响研究
2020-08-16杨艳萍杜艺玫秦琳汪巍鲁艳柳陆安静曾瑶谭道鹏何芋岐
杨艳萍 杜艺玫 秦琳 汪巍 鲁艳柳 陆安静 曾瑶 谭道鹏 何芋岐
摘 要 目的:探讨绞股蓝总皂苷(GPs)对高胆固醇血症模型小鼠肝组织中主要尿蛋白(Mups)基因表达的影响。方法:将C57BL/6J小鼠按体质量(BW)分为对照(ND)组、模型(HFD)组和GPs治疗(GP)组,每组11只。除ND组外,其余各组小鼠均给予高脂饲料以复制高胆固醇血症模型。于饲养的第17周起时,ND组和HFD组小鼠均灌胃等体积0.1%羧甲基纤维素钠溶液,GP组小鼠灌胃GPs混悬液(250 mg/kg),每日1次,连续22周。在检测各组小鼠BW、血糖(BG)、血脂[总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)]水平的基础上,提取其肝组织总RNA,构建逆转录文库并进行RNA-seq測序;采用主成分分析(PCA)、火山图、散点图等方法筛选差异基因;采用实时荧光定量聚合酶链反应法(RT-qPCR)对差异基因进行验证;通过双变量分析评价差异基因表达量与上述药效学指标的相关性。结果:与ND组比较,HFD组小鼠BW和血清BG、TC、LDL-C水平均显著升高(P<0.05);与HFD组比较,GP组小鼠除BW外上述指标均显著降低(P<0.05)。PCA结果显示,ND组和HFD组数据分布于不同象限,GP组数据分布介于上述两组之间。经高脂饮食诱导后,小鼠肝组织中Mup4、Mup5、Mup11、Mup15、Mup21基因mRNA均显著上调(P<0.05);经GPs干预后,Mup3、Mup4、Mup5、Mup8、Mup12、Mup21基因mRNA均显著下调(P<0.05)。在ND组与HFD组、HFD组与GP组中表达发生显著改变且趋势相反的基因为Mup4、Mup5、Mup21。RT-qPCR验证结果显示,与ND组比较,HFD组小鼠Mup4、Mup5、Mup21基因mRNA的相对表达量均显著升高(P<0.05)。相关性分析结果显示,小鼠Mup5基因mRNA表达量与血清TC、BG水平(r分别为0.727 1、0.670 6)以及Mup4、Mup21基因mRNA表达量与血清BG水平(r分别为0.737 8、0.721 5)均成正相关(P<0.05)。结论:GPs对高胆固醇血症模型小鼠肝组织中Mups基因的表达具有一定的调控作用,可通过回调Mup4、Mup5、Mup21基因mRNA的过表达来降低模型小鼠的糖脂水平。
关键词 绞股蓝总皂苷;高胆固醇血症;主要尿蛋白;糖脂代谢;转录组学;小鼠
ABSTRACT OBJECTIVE: To investigate the effects of gypenosides (GPs) on gene expression of major urinary proteins (Mups) in liver tissue of hypercholesterolemia model mice. METHODS: C57BL/6J mice were divided into control (ND) group, model (HFD) group and GPs therapy (GP) group according to body weight (BW), with 11 mice in each group. Except for ND group, other groups were given high-lipid diet to induce hypercholesterolemia model. From the 17th week of feeding, ND group and HFD group were given constant volume of 0.1%CMC-Na solution intragastrically; GP group were given GPs suspension (250 mg/kg) intragastrically, once a day, for consecutive 22 weeks. BW, the levels of blood glucose (BG) and blood lipid (TC, LDL-C) were detected in each group. Total RNA of liver tissue was extracted, and reverse transcription library was constructed and RNA-seq sequencing was performed. The differentially expressed genes were screened by PCA, volcano map and scatter plot. RT-qPCR was used for verification for differentially expressed genes. The correlation between the expression of differentially expressed genes and the above pharmacodynamic indexes was analyzed by bivariate analysis. RESULTS: Compared with ND group, BW, the levels of BG, TC and LDL-C in HFD group were increased significantly (P<0.05). Compared with HFD group, above indexes of GP group were decreased significantly except for BW (P<0.05). PCA showed that the data of ND group and HFD group distributed in different quadrants, and the data distribution of GP group was between above two groups. mRNA of Mup4, Mup5, Mup11, Mup15 and Mup21 in liver tissue of mice were increased significantly after treated with high-fat diet (P<0.05). mRNA of Mup3, Mup4, Mup5, Mup8, Mup12 and Mup21 were decreased significantly after treated with GPs (P<0.05). In ND group vs. HFD group and HFD group vs. GP group, mRNA of Mup4, Mup5 and Mup21 genes changed significantly and the trend was opposite. Results of RT-qPCR verification showed that compared with ND group, relative mRNA expression of Mup4, Mup5 and Mup21 gene were increased significantly in HFD group (P<0.05). Correlation analysis revealed that mRNA expression of Mup5 was positively correlated with the levels of TC and BG (r=0.727 1, 0.670 6, P<0.05), mRNA expression of Mup4 and Mup21 were positively correlated with the level of BG (r=0.737 8, 0.721 5, P<0.05). CONCLUSIONS: GPs can regulate the expression of Mups genes in liver tissue of hypercholesterolemia model mice, and reduce glucose and lipid level through regulating the mRNA over-expression of Mup4, Mup5 and Mup21.
KEYWORDS Gypenosides; Hypercholesterolemia; Major urinary proteins; Glucose and lipid metabolism; Transcriptome; Mice
高胆固醇血症是冠状动脉粥样硬化、心肌梗死、脑卒中等多种高致死性心脑血管疾病的直接诱因,其特征主要是血液中脂质水平升高、机体脂质代谢紊乱[1]。脂质通过与脂质运載蛋白结合并被运输至各个器官[2],可见该运载蛋白可能与高胆固醇血症的形成密切相关。主要尿蛋白(Major urinary proteins,Mups)是一类分子量为18~19 kDa的脂质运载蛋白家族[3]。作为载体,Mups可结合并运输亲脂性小分子物质(如脂肪酸、视黄醇、类固醇和信息素等)[4-5],并可独立于化学信号转导,直接参与机体糖脂代谢的调节[6]。目前,有关Mups调节糖脂代谢的相关研究相对较少,尚有待深入挖掘;同时,其编码基因Mups为具有高度多态性的多基因家族,由21个Mups基因和21个伪基因组成[7-8]。合成Mups的主要部位为肝脏,当肝脏受到损伤时,Mups基因的表达将发生改变,从而导致脂质代谢异常[9]。有研究表明,高脂饮食可引起部分Mups基因mRNA表达增加;给予药物治疗后,Mups的表达受到抑制且高脂饮食引起的相关症状得以缓解[10]。由此可见,高脂饮食引起的高胆固醇血症可能与Mups基因表达密切相关,并且药物可能通过调控Mups基因的表达来发挥对脂质代谢的调节作用。
绞股蓝为葫芦科植物绞股蓝[Gynostemma pentaphyllum(Thunb.) Makino]的干燥地上部分,在傣、苗、壮族等多种民族药中均有应用。如《中药本草·傣药卷》记载,其能“清火解毒、生肌收敛、降脂减肥,主要用于皮肤瘙痒、高血脂、肥胖病”[11];《中华本草·苗药卷》记载,其能“清热解毒、益气养阴、生津、安神,用于体虚乏力、疲劳失津、慢性支气管炎”[12]。皂苷类成分是绞股蓝的主要有效成分之一,有文献报道,绞股蓝总皂苷(Gypenosides,GPs)可显著降低实验动物血浆中总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)、三酰甘油(TG)水平,并可显著升高高密度脂蛋白胆固醇(HDL-C)水平,从而有效改善脂质代谢紊乱[13-15]。有研究表明,给予高脂模型大鼠GPs(250 mg/kg)治疗12 d后,其血清TC、TG水平均明显降低[16]。本课题组前期研究也已证实了GPs(250 mg/kg)可通过调控胆汁酸代谢通路将高脂饮食诱导的高胆固醇血症模型小鼠血清中TC、LDL-C水平回调至正常状态,有效改善其脂质代谢紊乱,使小鼠相关症状得以缓解[17-18]。然而,上述脂质水平调节作用是否与Mups基因相关尚未见相关报道。为此,本研究拟采用转录组学技术(RNA-Seq测序技术)探讨GPs对高胆固醇血脂模型小鼠肝组织中的21个Mups基因表达的影响,并采用实时荧光定量聚合酶链反应法(RT-qPCR)进行验证,为探讨绞股蓝总皂苷降糖降脂的作用机制提供参考。
1 材料
1.1 仪器
Multiskan GO型全波长酶标仪、Nanodrop型超微量分光光度计(美国Thermo Fisher Scientific公司);2100型生物分析仪、1260型高效液相色谱(HPLC)仪(美国Agilent公司);Y10型超细匀浆机(上海翼控机电有限公司);ME204E型电子天平[梅特勒-托利多仪器(上海)有限公司;TGL16M型台式高速冷冻离心机(长沙迈佳森仪器设备有限公司);BGISEQ-500RS基因测序仪(华大基因公司);Accu-Chek?活力型血糖(BG)仪及配套试纸(德国Roche公司);C1000 Touch型多功能梯度PCR仪(德国Eppendorf公司);CFX96 Touch型实时荧光定量PCR仪(美国Bio-Rad公司)。
1.2 药品与试剂
GPs(陕西中鑫生物技术有限公司,批号:150522,含量:98.16%);羧甲基纤维钠(CMC-Na,成都市科龙化工试剂厂);TC、LDL-C检测试剂盒(南京建成生物工程研究所,批号分别为20160311、20160309);TRIzol试剂(美国Invitrogen公司);焦碳酸二乙酯(DEPC)水(北京索莱宝科技有限公司);PrimeScpiptTM RT Reagent Kit逆转录试剂盒(日本Takara公司);SYBR? Green Super Mix试剂(美国Bio-Rad公司);异丙醇、氯仿和无水乙醇等均为分析级,水为超纯水。
1.3 动物与饲料
SPF级雄性C57BL/6J小鼠,体质量为(23±2) g,购自北京华阜康生物科技有限公司,动物生产许可证号:SCXK(京)2014-0004。普通饲料(含23.2%蛋白质、12.1%脂肪、64.7%碳水化合物)由江苏协同医药生物工程有限责任公司提供,高脂饲料(含20.0%蛋白质、60.0%脂肪、20.0%碳水化合物)由美国Research Diets公司提供。
2 方法
2.1 GPs检测
称取GPs约100 mg,精密加入80%甲醇10 mL,称定质量,超声(功率:40 W,频率:45 kHz)处理40 min后,冷却至室温,再次称定质量,用80%甲醇补足减失的质量,经0.22 ?m滤膜滤过后,取续滤液,即得供试品溶液,按本课题组前期所建HPLC法[17]进行定性分析。
2.2 分组、造模与给药
所有小鼠均适应性喂养1周后,按体质量(BW)分为对照(ND)组、高胆固醇血脂症模型(HFD)组、GPs治疗(GP)组,每组11只。按本课题组前期研究方法[18]操作:ND组小鼠给予普通饲料,HFD组和GP组小鼠均给予高脂饲料,共饲养38周。于饲养的第17周起,GP组小鼠灌胃GPs混悬液[250 mg/kg,溶剂为0.1%CMC-Na溶液],ND组和HFD组小鼠均灌胃等体积0.1%CMC-Na溶液,灌胃体积均为0.1 mL/10 g,每日1次,连续22周。
2.3 小鼠BW以及BG、血脂水平检测
于末次给药后,称量并记录小鼠BW。于小鼠尾静脉取血适量,使用BG仪及配套试纸测定其BG水平。于小鼠眼眶取血适量至1.5 mL离心管中,在4 ℃下以 4 500×g离心10 min,分离血清,分别采用单试剂比色法和直接测定法以酶标仪检测小鼠血清TC和LDL-C水平,严格按照相应试剂盒说明书操作。
2.4 小鼠肝组织RNA提取
根据“2.3”项下检测结果,每组各随机筛选5只小鼠,取其肝组织进行RNA提取。取肝组织样品,加入TRIzol试剂适量,冰上涡旋匀浆;取匀浆液用氯仿200 μL萃取,在4 ℃下以12 000×g离心15 min;取上清液,用异丙醇500 μL萃取以富集RNA,在4 ℃下以12 000×g离心15 min;取沉淀(即总RNA),用75%乙醇清洗,在4 ℃下以12 000×g离心15 min;沉淀以适量DEPC水溶解,使用超微量分光光度计检测总RNA样品的浓度和纯度[以光密度比值(OD260 nm/OD280 nm)表示]。
2.5 cDNA建库与RNA-Seq测序
选择“2.4”项下质量合格[即经生物分析检测,RNA完整性(RIN)≥7.0、28S/18S≥1.5][19]的总RNA为模板,逆转为cDNA以构建文库,运用BGISEQ-500RS RNA-Seq测序平台(https://www.mgitech.cn/product/detail/BGISEQ-500.html)进行测序。参照GRCm38/mm10小鼠基因组进行比对和注释,用FPKM(Fragments per kilobase milliom,即在每百万个Reads值中,来自某基因每千个碱基长度的Reads值)作为Reads值的标准化数值输出矩阵,采用R语言中“MixOmics”工具包对该矩阵进行主成分分析(PCA)。从矩阵中提取21个Mups的FPKM值,运用GraphPad Prism 8.0.2软件绘制火山图、散点图以筛选出表达量(以经FRKM进行标准化的Reads值表示)显著变化的差异基因(P<0.05)。
2.6 差异基因的RT-qPCR验证
随机选取ND、HFD组小鼠各4只,取其肝组织适量,按“2.4”方法提取RNA后,再按照PrimeScpiptTM RT Reagent Kit逆转录试剂盒说明书操作,将RNA逆转录成cDNA。逆转录条件:25 ℃预热10 min,37 ℃逆转录2 h,85 ℃逆转录酶失活5 min。以上述cDNA为模板,进行扩增,反应体系(共10 ?L):cDNA模板2 ?L,上、下游引物(引物序列见表1)各0.06 ?L,2×SYBR? Green Super Mix 5 ?L,DEPC水2.88 ?L;反应条件:95 ℃预变性3 min;94 ℃变性10 s,60 ℃延伸45 s,共39个循环。以GAPDH基因为内参,采用2-ΔΔCt法以Bio-Rad CFX Manager v3.1软件计算各目标mRNA的相对表达量。
2.7 统计学方法
采用SPSS 18.0软件对数据进行统计分析。计量资料均以x±s表示,多组间比较采用单因素方差分析(One-way ANOVA),两组间比较采用t检验;对差异基因和相关药效学指标进行双变量相关性分析。P<0.05为差异有统计学意义。
3 结果
3.1 GPs定性分析结果
以信噪比>10为基准,本研究共确定色谱峰35个(见图1A),与本课题组前期研究[17]所得色谱图(见图1B)基本一致,两者成分大多均为皂苷类化合物。
3.2 GPs对高胆固醇血症模型小鼠BW和糖脂代谢的影响
与ND组比较,HFD组小鼠BW以及血清BG、TC、LDL-C水平均显著升高(P<0.05);与HFD组比较,GP组小鼠血清BG、TC、LDL-C水平均显著降低(P<0.05)[17-18],详见表2。
3.3 小鼠肝组织中Mups基因的表达差异
3.3.1 PCA结果 取3个主成分(PC1~PC3)绘制三维得分图,见图2。由图2可见,ND组和HFD组的数据基本分布于不同象限,在PC2、PC3方向上有所区分;GP组在上述区分作用上具有一定的回调趋势,其数据分布介于ND组和HFD组之间。
3.3.2 Mups基因表达显著变化的分析结果 在高脂饮食压力下,小鼠肝组织中Mup4、Mup5、Mup11、Mup15、Mup21基因mRNA均顯著上调(P<0.05,见图3A),且上述显著上调的基因占基因总数的24%(5/21)(见图3B)。经GPs干预后,Mup3、Mup4、Mup5、Mup8、Mup12、Mup21基因mRNA均显著下调(P<0.05,见图3C),且上述显著下调基因占基因总数的29%(6/21)(见图3D)。
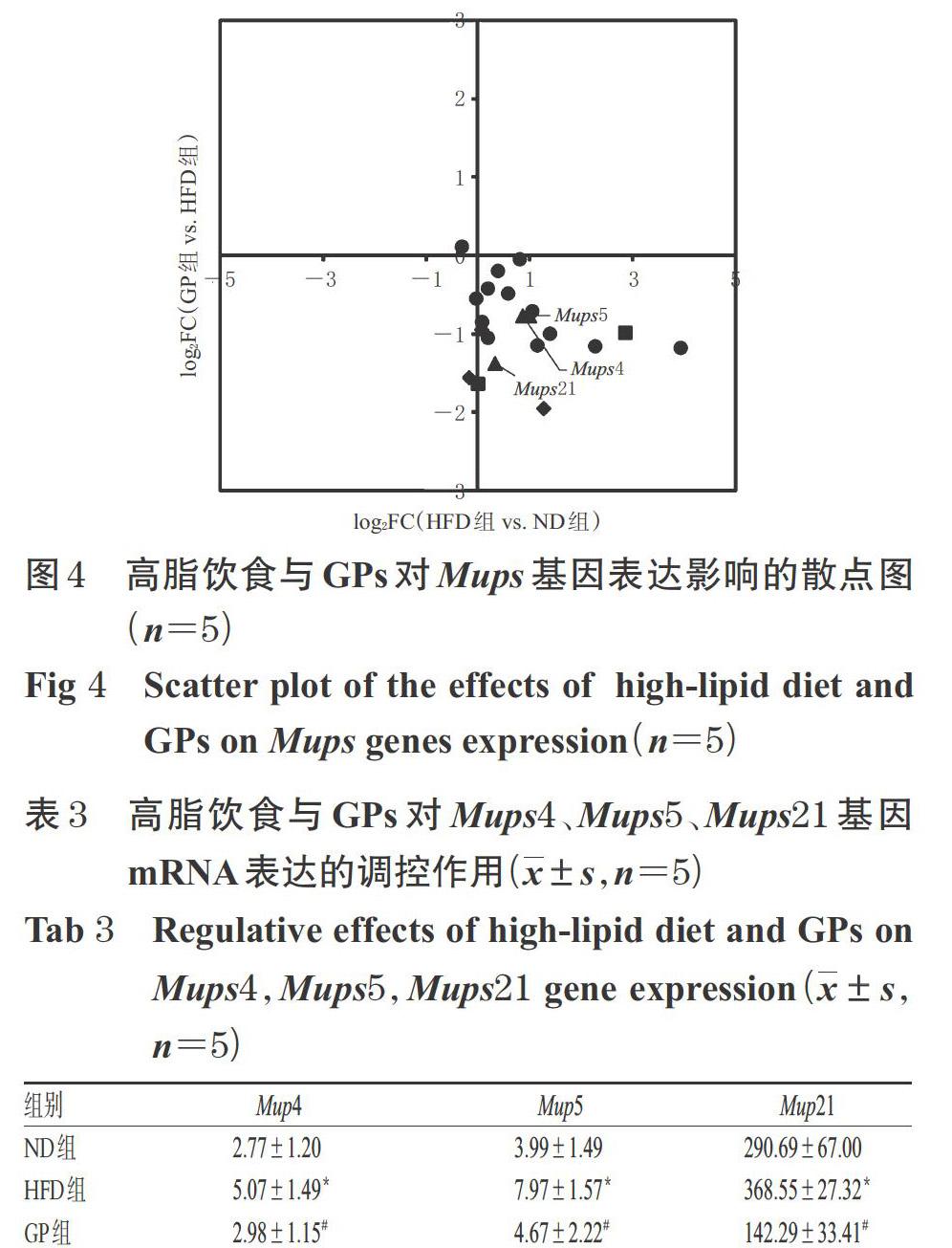
3.3.3 高脂饮食与GPs对Mups基因表达影响的差异分析结果 以HFD组与ND组表达量差异倍数的对数值(log2FC)为横坐标、GP组与HFD组的log2FC为纵坐标绘制散点图,对21个Mups基因进行分析,详见图4[图中,表示在ND组与HFD组、HFD组与GP组中表达变化趋势相反且差异显著的mRNA(P<0.05),表示仅在ND组与HFD组表达显著变化的mRNA(P<0.05),表示仅在HFD组与GP组表达显著变化的mRNA(P<0.05),表示变化无统计学意义的mRNA(P>0.05)]。由图4可见,Mups基因主要分布于第4象限内,提示高脂饮食可上调Mups基因mRNA的表达;经GPs干预后,Mups基因mRNA的表达被显著回调。同时,该散点图显示,在ND组与HFD组、HFD组与GP组中表达发生显著改变且趋势相反的基因为Mup4、Mup5、Mup21,即高脂饮食可显著上调Mup4、Mup5、Mup21基因mRNA的表达,而GPs可显著回调上述基因mRNA的表达。此外,以mRNA表达量(即经FPKM进行标准化的Reads值)为指标的分析也得出了相同的结果:与对照组比较,HFD组小鼠肝组织中Mup4、Mup5、Mup21基因mRNA的表达被显著上调(P<0.05);给予GPs干预后,Mup4、Mup5、Mup21基因mRNA的表达均被显著下调(P<0.05),详见表3。
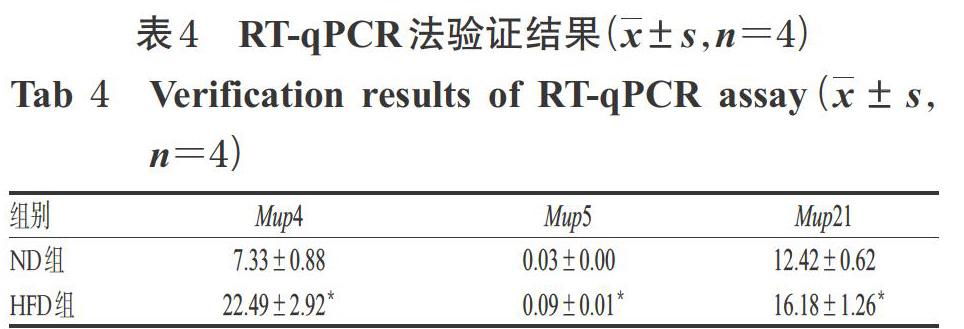
3.4 RT-qPCR验证结果
采用RT-qPCR法对RNA-seq数据进行验证,结果见表4。由表4可见,与ND组比较,HFD组小鼠肝组织中Mup4、Mup5、Mup21基因mRNA的相对表达量均显著升高(P<0.05),与前文结果基本一致。
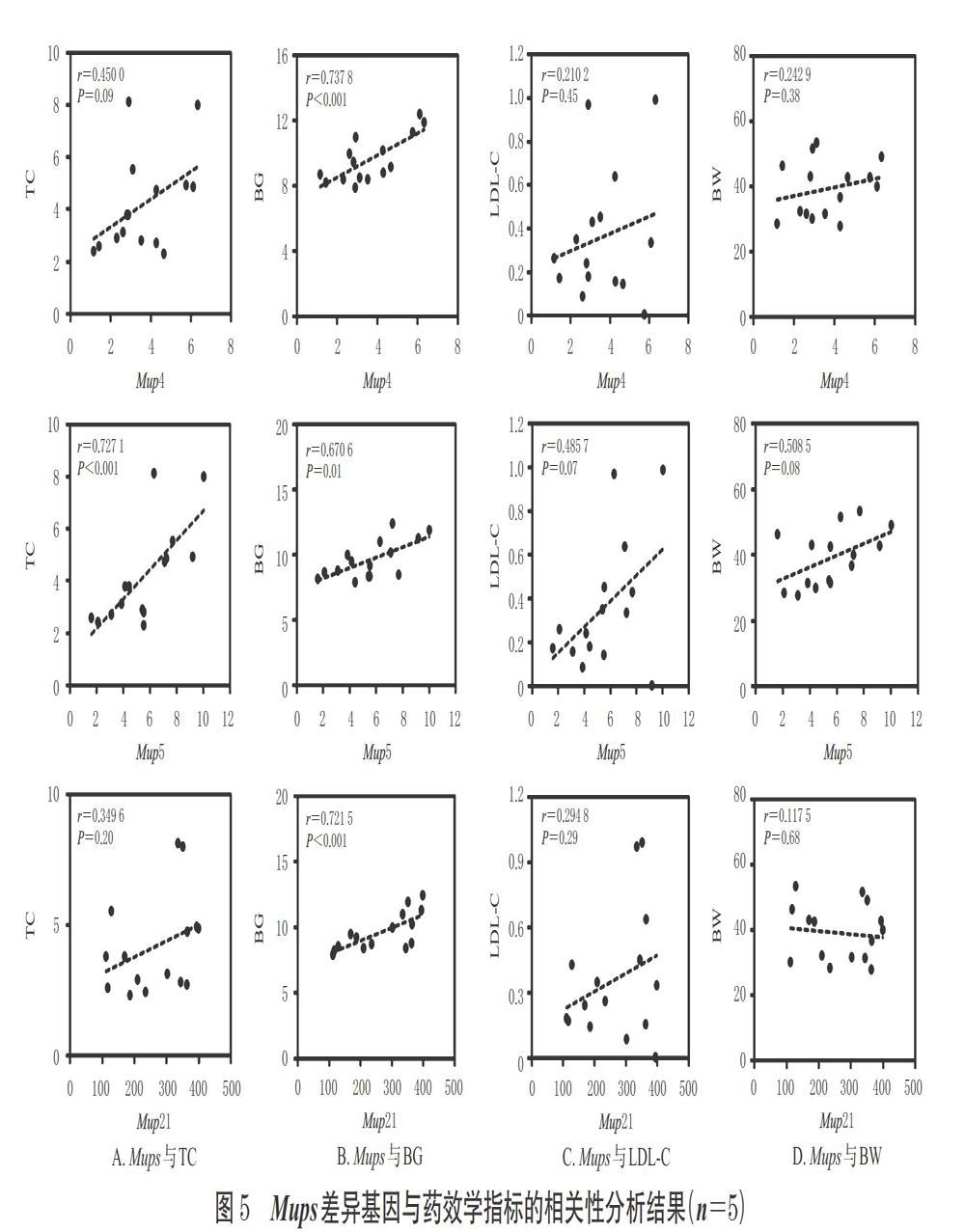
3.5 差异基因与药效学指标相关性分析结果
相关性分析结果显示,小鼠Mup5基因mRNA表达量与血清TC、BG水平(r分别为0.727 1、0.670 6)以及Mup4、Mup21基因mRNA表达量与血清BG水平(r分别为0.737 8、0.721 5)均成正相关(P<0.05),详见图5。
4 讨论
脂质代谢紊乱是高胆固醇血症的主要病理因素,也是引起机体糖脂代谢紊乱的关键因素之一。本课题组前期研究发现,GPs可显著降低高胆固醇血症模型小鼠血清TC、LDL-C、BG水平,具有降低血脂和血糖的作用[17-18]。Mups是脂质运载蛋白家族成员,在啮齿动物肝脏中表达并通过尿液排泄到体外,可通过结合的方式运输脂肪酸、视黄醇、类固醇等脂质,从而参与调节机体糖脂代谢[4-5,20]。研究表明,脂质运载蛋白家族成员Lcn2在妊娠期糖尿病患者体内的表达增加,可导致其血脂代谢紊乱[21]。因此,笔者推测调控脂质运载家族Mups基因的表达可能与血脂水平调节有关。已有研究表明,GPs可调节脂质代谢,具有良好的降血糖、降血脂、保肝和抗炎等药理作用[22-24]。本研究在前期药效学研究的基础上,借助RNA-Seq测序技术初步探讨了GPs对小鼠肝组织中Mups基因表达的影响,旨在挖掘GPs通过调控Mups基因表达从而降低血脂的可能机制。
本研究从整体层面分析发现,GPs对高胆固醇血症模型小鼠肝组织中Mups基因mRNA的表达具有显著的回调作用,表明GPs改善高胆固醇血症的作用可能与Mups基因有关。有研究报道指出,胰岛素与Mups基因有密切的联系,在1型糖尿病模型大鼠肝组织中,Mups基因的表达水平显著降低;给予胰岛素后,肝组织中Mups基因的表达水平显著升高,且有随胰岛素水平升高而上升的趋势[25-26]。由此可见,长期高脂饮食导致的高血糖和胰岛素抵抗可使机体代偿性分泌过量的胰岛素,从而引起Mups基因表达水平升高[27]。本研究结果发现,高脂饮食诱导可导致小鼠BW和血清BG、TC、LDL-C水平以及肝组织中Mup4、Mup5、Mup21基因mRNA的表达显著升高,且RT-qPCR验证试验结果与之一致。这提示Mup4、Mup5、Mup21基因表达异常升高可能与小鼠体内脂质代谢紊乱有关,Mups基因的过表达可能参与了高胆固醇血症的发生,与相关研究[10]结果基本一致。给予GPs干预后,小鼠血清BG、TC、LDL-C水平以及肝组织中Mup4、Mup5、Mup21基因mRNA的表达均显著降低;相关性分析结果显示,小鼠Mup5基因mRNA表达量与血清TC、BG水平以及Mup4、Mup21基因mRNA表达量与血清BG水平均成正相关。这提示小鼠体内糖脂代谢紊乱的改善可能与GPs下调上述基因mRNA的表达有关。
肝脏Mups可能作为与能量代谢有关的分子开关,参与小鼠机体营养状况的调节;在经长时间饮食控制后,其Mup4、Mup5、Mup21基因表达降低[28]。本课题组前期研究表明,GPs可以显著调控胆汁酸相关基因(Cyp7a1、Cyp8b1)的表达,促进肝脏胆固醇转化成胆汁酸[18]。胆汁酸能够通过激活鞘氨醇-1-磷酸(S1P)受体来上调鞘氨醇激酶2,从而升高S1P的表达水平[29],而S1P与Mups基因的表达水平成负相关[30]。由此笔者推测,GPs可能通过促进胆汁酸合成、上调S1P表达、下调Mups基因表达进而调节机体血脂水平,但具体机制有待后续研究进一步探讨。
综上所述,GPs对高胆固醇血症小鼠肝组织中Mups基因过表达有显著回调作用,可能是其降低糖脂水平的作用机制之一。此外,本研究未涉及GPs对Mups蛋白表达的影响,将对此进一步进行后续研究。
参考文献
[ 1 ] SHARIFI M,FUTEMA M,NAIR D,et al. Polygenic hypercholesterolemia and cardiovascular disease risk[J]. Curr Cardiol Rep,2019. DOI:10.1007/s11886-019-1130-z.
[ 2 ] CHEON HM,SHIN SW,BIAN G,et al. Regulation of lipid metabolism genes,lipid carrier protein lipophorin,and its receptor during immune challenge in the mosquito aedes aegypti[J]. J Biol Chem,2006,281(13):8426-8435.
[ 3 ] ROBERT JB,STUART DA,AMY JC,et al. Mass spectrometry for structural analysis and quantification of the major urinary proteins of the house mouse[J]. Int J Mass Spectrom,2015. DOI:10.1016/j.ijms.2015.07.026.
[ 4 ] 熊欽,包玉倩.脂质运载蛋白家族与非酒精性脂肪性肝病研究进展[J].中华糖尿病杂志,2016,8(7):436-438.
[ 5 ] MASI A,TREZZA V,LEBOFFE L,et al. Human plasma lipocalins and serum albumin:plasma alternative carriers? [J]. J Control Release,2016. DOI:10.1016/j.jconrel.2016. 02.049.
[ 6 ] ZHOU Y,RUI L. Major urinary protein regulation of che- mical communication and nutrient metabolism[J]. Vitam Horm,2010. DOI:10.1016/S0083-6729(10)83006-7.
[ 7 ] MUDGE JM,ARMSTRONG SD,MCLAREN K,et al. Dynamic instability of the major urinary protein gene family revealed by genomic and phenotypic comparisons between C57 and 129 strain mice[J]. Genome Biol,2008. DOI:10.1186/gb-2008-9-5-r91.
[ 8 ] CERN? M,KUNTOV? B,TALACKO P,et al. Differential regulation of vaginal lipocalins (OBP,MUP) during the estrous cycle of the house mouse[J]. Sci Rep,2017. DOI:10.1038/s41598-017-12021-2.
[ 9 ] Cheetham SA,Smith AL,Armstrong SD,et al. Limited variation in the major urinary proteins of laboratory mice[J]. Physiol Behav,2009,96(2):253-261.
[10] WANG B,ZHANG S,WANG X,et al. Transcriptome analysis of the effects of chitosan on the hyperlipidemia and oxidative stress in high-fat diet fed mice[J]. Int J Biol Macromol,2017. DOI:10.1016/j.ijbiomac.2017.03.187.
[11] 國家中医药管理局《中华本草》编委会.中华本草:傣药卷[M].上海:上海科技出版社,2005:1-321.
[12] 国家中医药管理局《中华本草》编委会.中华本草:苗药卷[M].贵阳:贵州科技出版社,2005:1-643.
[13] KULKARNI H,MAMTANI M,BLANGERO J,et al. Lipidomics in the study of hypertension in metabolic syndrome[J]. Curr Hypertens Rep,2017. DOI:10.1007/s11906- 017-0705-6.
[14] YANG YH,YANG J,JIANG QH. Hypolipidemic effect of gypenosides in experimentally induced hypercholestero- lemic rats [J]. Lipids in Health Dis,2013. DOI:10.1186/1476-511X-12-154.
[15] HE Q,LI JK,LI F,et al. Mechanism of action of gypenosides on type 2 diabetes and non-alcoholic fatty liver disease in rats[J]. World J Gastroenterol,2015,21(7):2058- 2066.
[16] MEGALLI S,AKTAN F,DAVIES NM,et al. Phytopreventative anti-hyperlipidemic effects of gynostemma pentaphyllum in rats[J]. J Pharm Pharm Sci,2005,8(3):507-515.
[17] LU YL,DU YM,QIN L,et al. Gypenosides altered hepa- tic bile acids homeostasis in mice treated with high fat diet[J]. Evid Based Complement Alternat Med,2018. DOI:10.1155/2018/8098059.
[18] 汪巍.胆汁酸通路介导的绞股蓝总皂苷调节糖脂代谢的作用机制研究[D].遵义:遵义医学院,2017.
[19] LING Y,ZHENG Q,ZHU L,et al. Trend analysis of the role of circular RNA in goat skeletal muscle development[J]. BMC Genomics,2020. DOI:10.1186/s12864-020- 6649-2.
[20] HAGEMEYER P,BEGALL S,JANOTOVA K,et al. Searching for major urinary proteins (MUPs) as chemosignals in urine of subterranean rodents[J]. J Chem Ecol,2011,37(7):687-694.
[21] 郭丽,张陈彦,郭影.妊娠期糖尿病患者并发子痫前期血清LCN-2、AOPP水平变化及意义[J].山东医药,2019,59(16):12-15.
[22] LI H,XI Y,XIN X,et al. Gypenosides regulate farnesoid X receptor-mediated bile acid and lipid metabolism in a mouse model of non-alcoholic steatohepatitis[J]. Nutr Metab:Lond,2020. DOI:10.1186/s12986-020-00454-y.
[23] HONG M,CAI Z,SONG L,et al. Gynostemma pentaphyllum attenuates the progression of nonalcoholic fatty liver disease in mice:a biomedical investigation integrated with in silico assay[J]. Evid Based Complement Alternat Med,2018. DOI:10.1155/2018/8384631.
[24] SHEN CY,JIANG JG,SHI MM,et al. Comparison of the effects and inhibitory pathways of the constituents from gynostemma pentaphyllum against LPS-induced inflammatory response[J]. J Agric Food Chem,2018,66(43):11337-11346.
[25] SCHLATZER DM,DAZARD JE,DHARSEE M,et al. Urinary protein profiles in a rat model for diabetic complications[J]. Mol Cell Proteomics,2009,8(9):2145-2158.
[26] 孔曉牧,杨吉春,管又飞.主要尿蛋白(MUPs)参与化学信息交流和糖脂代谢[J].中国生物化学与分子生物学报,2011,27(3):197-204.
[27] 梁日英,符畅,梁华,等.利拉鲁肽抑制ERS改善高脂饮食诱导的DN肾损害[J].新医学,2019,11(50):826-831.
[28] GILLER K,HUEBBE P,DOERING F,et al. Major urinary protein 5,a scent communication protein,is regula- ted by dietary restriction and subsequent re-feeding in mice[J]. Proc Biol Sci,2013. DOI:10.1098/rspb.2013.0101.
[29] NAGAHASHI M,YUZA K,HIROSE Y,et al. The roles of bile acids and sphingosine-1-phosphate signaling in the hepato-biliary diseases [J]. J Lipid Res,2016,57(9):1636-1643.
[30] GREEN CL,MITCHELL SE,DEROUS D,et al. The effects of graded levels of calorie restriction:Ⅸ:global metabolomic screen reveals modulation of carnitines,sphingolipids and bile acids in the liver of C57BL/6 mice[J]. Aging Cell,2017,16(3):529-540.
(收稿日期:2020-03-08 修回日期:2020-06-19)
(编辑:张元媛)
