基于肠道菌群研究葛根芩连汤降脂并预防血糖升高的作用机制
2020-08-16姜璎娜曾治君傅灵艳盛译萱曾国威姚亮亮王玮玮周子妍徐国良刘红宁
姜璎娜 曾治君 傅灵艳 盛译萱 曾国威 姚亮亮 王玮玮 周子妍 徐国良 刘红宁
摘 要 目的:研究葛根芩連汤对高脂血症(HLP)模型大鼠血脂、血糖的影响,并从肠道菌群角度探索其作用机制。方法:将48只大鼠随机分为空白对照组(n=8)和造模组(n=40)。造模组大鼠连续5周饲以高脂饲料以复制HLP模型,空白对照组大鼠饲以普通饲料。将造模成功的30只大鼠随机分为模型组、辛伐他汀组(阳性对照,10 mg/kg)和葛根芩连汤高、中、低剂量组(14.85、4.95、1.65 g/kg,以生药量计),每组6只。空白对照组和模型组大鼠灌胃等体积生理盐水,各给药组大鼠灌胃相应药物,每天给药 1次,连续给药11周;给药同时,各组大鼠继续饲以相应饲料。末次给药后,测定大鼠体质量、体长并计算Lees指数;检测大鼠血清中三酰甘油(TG)、总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)和空腹血糖(FBG)水平。提取大鼠盲肠内容物DNA进行16S rRNA V3~V4区域测序,并应用Two-part模型进行肠道菌群与血脂、血糖的关联分析。结果:给药11周后,与空白对照组比较,模型组大鼠体质量、体长、Lees指数以及血清中TC、TG、HDL-C、FBG水平均显著增加或升高(P<0.05或P<0.01),HDL-C水平显著降低(P<0.05);与模型组比较,葛根芩连汤高剂量组大鼠体质量、Lees指数和TG、FBG水平,葛根芩连汤中剂量组大鼠血清中TC、TG水平和葛根芩连汤低剂量组大鼠血清中TG水平均显著降低(P<0.05或P<0.01)。与肠道菌群的关联分析发现,TC和TG共享3个操作性分类单元(OTU),分别为OTU559、OTU701和OTU135(其中OTU135也与FBG共享),且均与TC、TG或FBG水平呈显著正相关(P<0.01),这3个OTU分别注释到毛螺菌科Tyzzerella属、疣微菌科Anaerotruncus属和链球菌科Peptoclostridium属。高、中剂量葛根芩连汤对Tyzzerella、Anaerotruncus属微生物丰度有显著下调作用(P<0.05或P<0.01),但对Peptoclostridium属微生物丰度有显著上调作用(P<0.01)。结论:高剂量(14.85 g/kg)葛根芩连汤可有效降低HLP模型大鼠的体质量和血脂水平,并可预防模型大鼠血糖的异常升高;其作用机制可能与降低肠道菌(Tyzzerella、Anaerotruncus属)的含量有关。
关键词 高脂血症;葛根芩连汤;肠道菌群;降糖;降脂;大鼠;机制
ABSTRACT OBJECTIVE: To study the effects of Gegen qinlian decoction (GGQLD) on blood lipid and blood glucose of hyperlipidemia (HLP) model rats, and to explore its mechanism from the perspective of intestinal flora. METHODS: Totally 48 rats were randomly divided into blank control group (n=8) and modeling group (n=40). For consecutive 5 weeks, model group was given high-lipid diet to induce HLP model; blank control group was given routine diet. After modeling, 30 modeling rats were randomly divided into model group, simvastatin group (positive control, 10 mg/kg), GGQLD high-dose, medium-dose and low-dose groups (14.85, 4.95, 1.65 g/kg, by crude drug), with 6 rats in each group. Blank control group and model group were given constant volume of normal saline intragastrically; administration groups were given relevant medicine intragastrically, once a day, for consecutive 11 weeks. At the same time, each group was continuously given corresponding diet. After the last medication, body mass and body length of rats were determined, and Lees index was calculated. Serum levels of TG, TC, HDL-C, LDL-C and fasting blood glucose (FBG) were determined in rats. DNA of rat caecum content was extracted for 16S rRNA V3-V4 region sequencing. The Two-part model was used to analyze the correlation between intestinal flora with lipids and blood glucose. RESULTS: After 11 weeks of administration, compared with blank control group, the body mass, body length, Lees index, serum levels of TC, TG, HDL-C and FBG of model group were increased significantly (P<0.05 or P<0.01), while the level of HDL-C was decreased significantly (P<0.05). Compared with model group, body mass and Lees index and serum levels of TG,FBG of rats in GGQLD high-dose group, and serum levels of TC, TG in GGQLD medium-dose group, as well as serum level of TG of rats in GGQLD low-dose group was decreased significantly (P<0.05 or P<0.01). Correlation analysis with intestinal flora showed that TC and TG shared 3 operational taxonomic units (OTU), including OTU559, OTU701 and OTU135 (OTU135 was also shared with FBG), which were all positively correlated with the level of TC, TG and FBG (P<0.01). The three OTU were annotated as Tyzzerella of Spirillaceae, Anaerotruncus of Verrucaceae and Peptoclostridium of Streptococcidae, respectively. High-dose and low-dose GGQLD had a down-regulating effect on Tyzzerella and Anaerotruncus (P<0.05 or P<0.01), while had up-regulating effect on Peptoclostridium (P<0.01). CONCLUSIONS: High-dose GGQLD (14.85 g/kg) can effectively reduce the body mass and blood lipid of HLP model rats, and can prevent the abnormal increase of blood glucose of model rats. The mechanism may be associated with that the reduction of intestinal flora(Tyzzerella, Anaerotruncus) content.
KEYWORDS Hyperlipidemia; Gegen qinlian decoction; Intestinal flora; Glucose-lowering; Lipid-lowering; Rats; Mechanism
高脂血症(HLP)是常见的脂质代谢性疾病,是由于血液总胆固醇(TC)、三酰甘油(TG)、低密度脂蛋白胆固醇(LDL-C)水平的升高和高密度脂蛋白胆固醇(HDL-C)水平的降低所致[1]。HLP往往是糖代谢紊乱的始动因素,因此,药物干预HLP可以预防血糖升高,进而预防相关糖脂代谢类疾病[2]。有研究发现,高糖“代谢记忆”与糖尿病并发症密切相关,即患者若长期处于高血糖状态,即使后来血糖水平降低,仍易发生糖尿病相关并发症[3-4] ,故在糖尿病前期尽早治疗,严格控制患者血糖水平,可能会降低糖尿病及其并发症的患病风险。葛根芩连汤出自《伤寒论》,由葛根、黄芩、黄连和炙甘草4味药材组成,经方多用于湿热下利,现临床上主要用于肠道湿热型糖尿病、结肠炎、动脉粥样硬化的治疗[5]。临床试验和药理实验都表明,葛根芩连汤能有效控制血糖水平[6],并有较好的降血脂作用[7-8]。但临床上并未见以葛根芩连汤作为降脂并且预防血糖升高的给药用途。
肠道菌群是机体复杂的微生物生态系统,与宿主关系极为密切,是宿主能量代谢的重要调节因素,肠道菌群失调容易导致机体发生肥胖、血脂异常等代谢性疾病[9]。研究表明,血糖、血脂也受肠道菌群调控的影响,其作用机制可能与肠道菌群参与胆酸合成和代谢、调节胆汁酸代谢、发酵碳水化合物最终生成短链脂肪酸有关[10-11]。基于此,本研究拟通过一种改良的相关性分析方法——Two-part模型法——进行肠道菌群操作性分类单元(Operational taxonomic units,OTU)水平与血糖、血脂的关联性分析,确定对血糖、血脂有影响的重要肠道菌群的OTU,以期从OTU水平探究葛根芩连汤对HLP的治疗作用以及对血糖异常升高的预防作用,为其临床应用提供实验依据。
1 材料
1.1 仪器
BT225型电子分析天平(德国Sartorius公司);Mo- dular P800型全自动生化分析仪(瑞士Roche公司);Nanodrop-2000型核酸蛋白测定仪(美国Thermo Fisher Scientific公司);ChemiDocXRS+型化学发光凝胶成像系统(美国Bio-Rad公司);HiSeq 2500型测序平台(美国Illumina公司)。
1.2 药品与试剂
葛根饮片(批号:180124,产地:河南)、黄芩饮片(批号:171215,产地:辽宁)、黄连饮片(批号:180131,产地:四川)、灸甘草饮片(批号:171214,产地:内蒙古)均购自江西江中中药饮片有限公司,经江西中医药大学药学院刘勇教授鉴定依次为豆科植物野葛[Pueraria lobata (Willd.) Ohwi]的干燥根、唇形科植物黄芩(Scutellaria baicalensis Georgi)的干燥根、毛茛科植物黄连(Coptis chinensis Franch.)的干燥根茎、豆科植物甘草(Glycyrrhiza uralensis Fisch.)的干燥根和根茎;辛伐他汀片(杭州默沙东制药有限公司,批号:N025120,规格:20 mg);总TC检测试剂盒(批号:700487-01)、总TG检测试剂盒(批号:627311-01)、HDL-C检测试剂盒(批号:HL8108m)均购自瑞士Roche公司;葡萄糖检测试剂盒(宁波普瑞柏公司,批号:GL8322);粪便DNA提取试剂盒(德国Qiagen公司,批号:160033067);其余试剂均为分析纯,水为超纯水。
1.3 动物
SPF级SD大鼠48只,雄性,3~4周龄,体质量(90±10) g,购于江西中医药大学实验动物科技中心,实验动物生产许可證号:SCXK(赣)2018-0003。动物饲养于该中心屏障系统实验室[实验动物使用许可证号:SYXK-(赣)2017-0004]。本实验已得到江西中医药大学动物伦理委员会批准,相关操作符合科学技术部颁发的《实验动物管理条例》(2017版)要求。
2 方法
2.1 葛根芩连汤煎液的制备
葛根芩连汤是由葛根、黄芩、黄连、炙甘草按8 ∶ 3 ∶ 3 ∶ 2的质量比组成的中药复方。按照上述比例称取相应药材适量,混匀,加8倍量水(mL/g),浸泡约30 min(以浸透为准),然后加热至沸腾,保持微沸40 min,低温减压浓缩,得每1 mL中含原生药材1 g的煎液(经高效液相色谱法检测,该煎液中有效成分含量葛根素为23.70 mg/mL、甘草苷为4.54 mg/mL、黄连碱为10.23 mg/mL、黄芩苷为118.20 mg/mL、黄连素为36.50 mg/mL、巴马亭为6.88 mg/mL、汉黄芩苷为21.30 mg/mL、黄芩黄素为2.46 mg/mL、汉黄芩素为2.18 mg/mL、甘草酸铵为7.01 mg/mL)。将煎液封装于消毒塑料瓶后,保存于-20 ℃冰箱中备用。给药前1天在4 ℃冰箱中解冻。
2.2 造模、分组与给药
将48只雄性SD大鼠适应性喂养1周后,按体质量随机分为空白对照组(n=8)和造模组(n=40)。空白对照组大鼠给予普通饲料(含10%脂肪、66%碳水化合物和24%蛋白质),造模组大鼠给予高脂饲料(含60%脂肪、20%碳水化合物和20%蛋白质),两组大鼠均自由饮食,持续5周。在本研究中,若造模大鼠体质量超过正常体质量的15%、Lees指数有显著差异、血脂水平紊乱但血糖水平正常,则视为HLP模型造模成功[12]。以此为标准,共有30只大鼠造模成功。将这30只大鼠按体质量随机分为模型组、辛伐他汀组(阳性对照,10 mg/kg,相当于临床人用量的15倍)和葛根芩连汤高、中、低剂量组(14.85、4.95、1.65 g/kg,以生药量计)[13],每组6只。各给药组大鼠灌胃相应药物,空白对照组和模型组大鼠灌胃等体积生理盐水,每天给药1次。在给药同时,模型组和各药物组大鼠继续给予高脂饲料,空白对照组大鼠继续给予正常饲料。每2周监测1次模型组大鼠血糖水平,当其血清中空腹血糖(FBG)水平显著升高时则停止给药,此时共计给药11周。给药期间,空白对照组大鼠由于灌胃操作意外死亡2只。
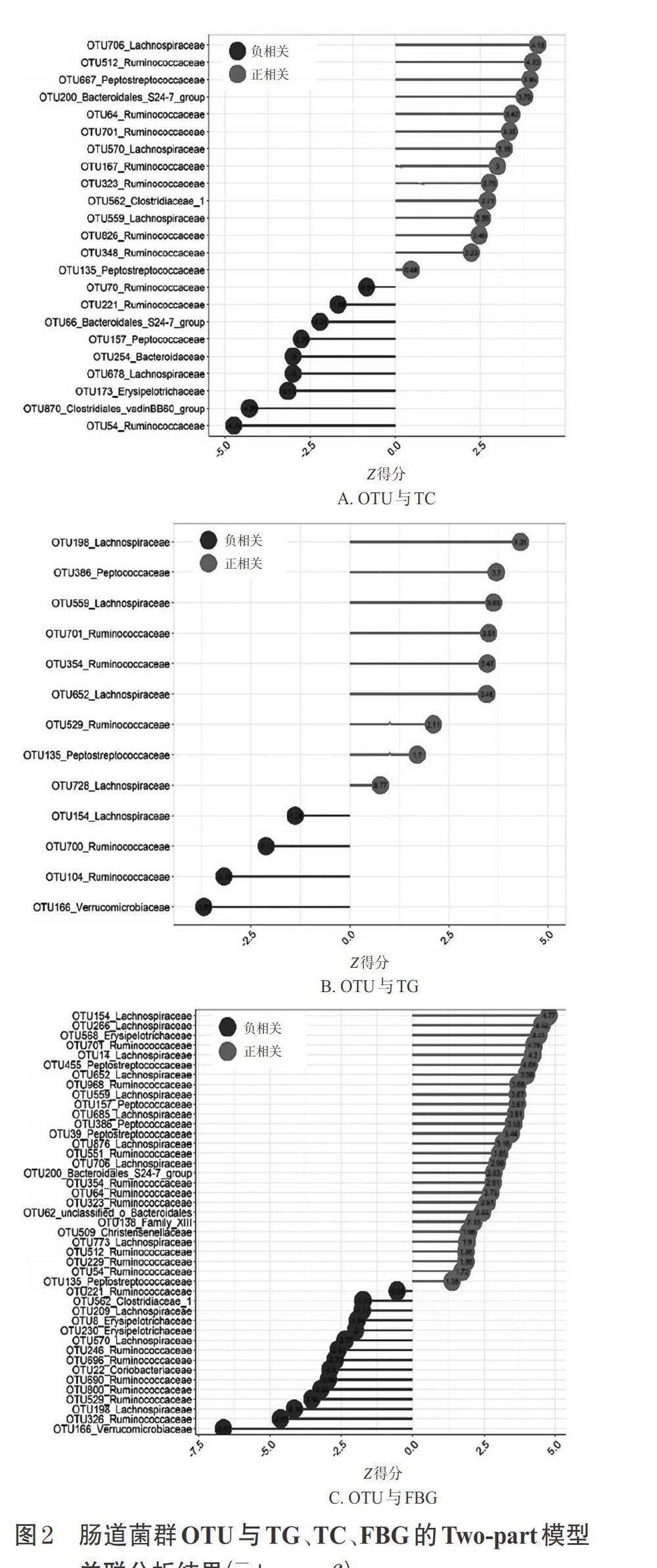
3.4.3 肠道菌群OUT与FBG的关联分析结果 共鉴定出43个与FBG显著相关的OTU(28个与FBG呈正相关,15个与FBG呈负相关)。其中,有38个来自厚壁菌门(Firmicutes):13个注释到瘤胃菌科(Ruminococcaceae),12个注释到毛螺菌科(Lachnospiraceae),2个注释到肽球菌科(Peptococcaceae),3个注释到消化链球菌科(Peptostreptococcaceae),2个注释到丹毒科(Erysipelotrichaceae),2个注释到克里斯滕氏菌科(Christensenellaceae),2个注释到梭菌目Family_Ⅹ Ⅲ科,余下2个分别注释到梭菌目Clostridiaceae_1科和unclassified_o_Clostridiales科;有3个来自拟杆菌门(Bacteroidetes):1个注释到拟杆菌科(Bacteroidaceae),2个注释到拟杆菌目Bacteroidales_S24-7_group科;有1个来自放线菌门(Actinobacteria):注释到肠杆菌科(Coriobacteriaceae);有1个来自疣微菌门(Verrucomicrobia):注释到疣微菌科(Verrucomicrobiaceae)。结果见图2C。
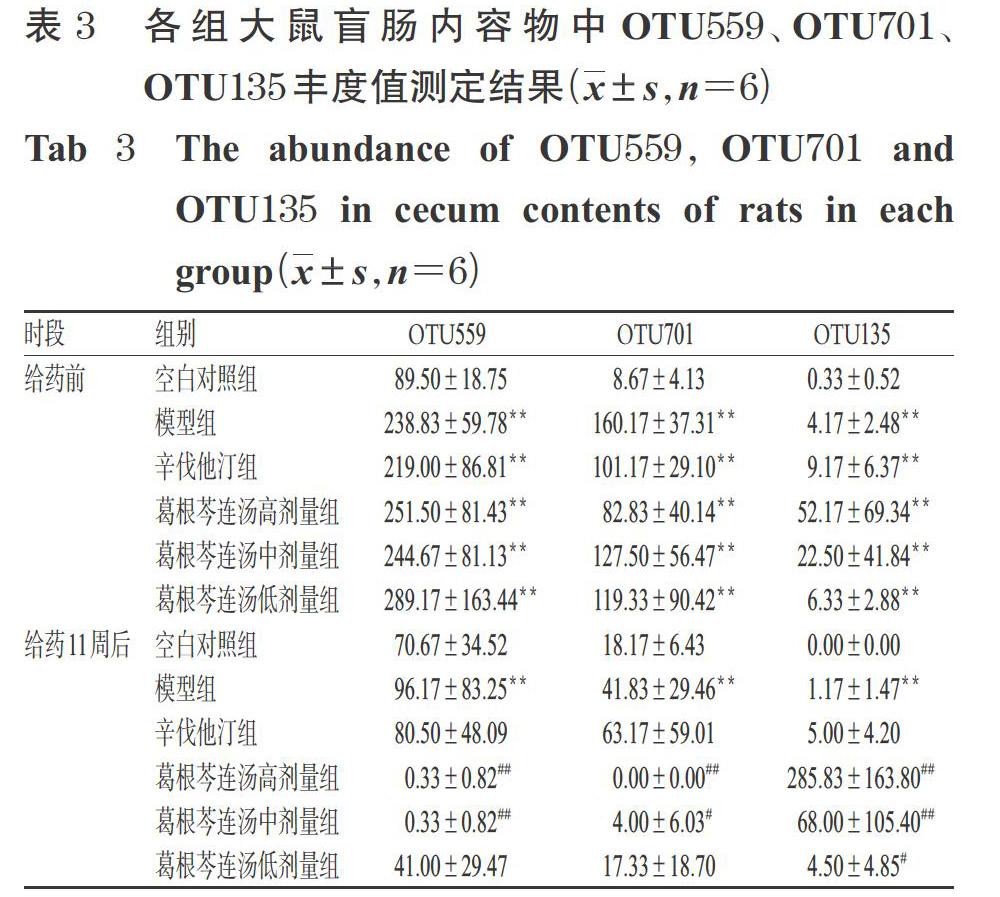
3.4.4 共享OTU的丰度分析结果 TC、TG共享的OTU有3个(OTU559、OTU701和OTU135),都显示出强的正相关性,分别注释到毛螺菌科Tyzzerella属、疣微菌科Anaerotruncus属和肽链球菌科Peptoclostridium属,其中OTU135也与FBG呈强的正相关性。
给药前,与空白对照组比较,其余各组大鼠盲肠内容物中OTU559、OTU701、OTU135丰度值均显著升高(P<0.01)。给药11周后,与空白对照组比较,模型组大鼠盲肠内容物中OTU559、OTU701、OTU135丰度值仍显著升高(P<0.01);与模型组比较,葛根芩连汤高、中剂量组大鼠盲肠内容物中OTU559、OTU701丰度值均显著降低(P<0.05或P<0.01),但葛根芩连汤各剂量组大鼠盲肠内容物中OTU135丰度值均显著升高(P<0.05或P<0.01)。各组大鼠盲肠内容物中OTU559、OTU701、OTU135丰度值测定结果见表3。
4 讨论
糖代谢紊乱前期往往伴随脂代谢的紊乱,他汀类药物是治疗HLP的首选药物,在临床应用广泛[16],故本研究选择辛伐他汀作为阳性药物。然而,近期一些临床数据显示,长期服用他汀类药物会增加胰岛素抵抗和2型糖尿病发生的风险[17],故寻求安全、有效、副作用小的中药复方来治疗HLP并同时预防血糖升高,对于糖尿病前期临床给药具有重要意义。
HLP主要表现为TC、TG、LDL-C等血脂水平异常升高,并且当血糖水平升高时会加剧血脂水平的异常[18]。在本研究中,本课题组在成功建立大鼠HLP模型后,为了探讨葛根芩连汤在降脂的同时是否具有预防血糖异常升高的作用,每2周检测1次血脂、血糖的变化。结果发现,在给药11周时,与空白对照组比较,模型组大鼠不仅血脂水平保持了显著升高,同时血糖水平也开始显著升高;而葛根芩连汤药物组血脂水平显著降低,并且血糖水平显著下调,因此本课题组将此视为给药终点,并停止给药。本研究结果显示,高剂量葛根芩连汤可显著降低HLP模型大鼠体质量,中剂量葛根芩连汤可显著降低其血清中TC水平,高、中、低剂量葛根芩连汤均可显著降低其血清中TG水平,这说明葛根芩连汤具有调节HLP大鼠血脂紊乱的作用。此外,阳性对照药辛伐他汀对于TC、LDL-C等指标的降低作用不明显,这可能与悬浮液灌胃给药或者应用的高脂饲料影响了其吸收等原因有关,具体原因尚不清楚。但从本研究结果来看,葛根芩连汤降脂作用优于辛伐他汀。但葛根芩连汤对于HDL-C、LDL-C的作用效果不明显。给药11周后,与空白对照组比较,模型组大鼠FBG水平显著升高,而葛根芩连汤高剂量组大鼠FBG水平显著降低,这表明葛根芩连汤对糖代谢紊乱确实有一定的预防作用。
肠道微生物可能通过参与宿主代谢的方式参与血糖、血脂调节。本研究采用Two-part模型筛选与血脂、血糖显著相关的OTU,该模型可以解释二元(即检测到/未检测到)和定量特征,这种方法克服了OTU的丰度分布明显偏离正态分布的特征。通过该模型的分析,可以检测到微生物(以OTU表示)的存在与否,以及其丰度高低对表型指标的影响。本研究共发现3个对TC、TG均有显著影响的OTU(OTU559、OTU701和OTU135),并且OTU135也对FBG也有显著影响。其中,OTU701注释到疣微菌科Anaerotruncus属,该属微生物可产生短链脂肪酸,而短链脂肪酸与能量代谢、糖脂代谢有密切关系[19],例如Song X等[20]研究发现,糖尿病大鼠粪便中富集了Anaerotruncus。OTU559注释到毛螺菌科Tyzzerella属,该属微生物易受饮食影响[21],例如Kelly TN等[22]研究發现,粪便中富集了Tyzzerella的群体患心血管疾病的风险增高,这表明Tyzzerella含量升高时血糖、血脂可能随之升高。OTU135注释到链球菌科Peptoclostridium属,该属微生物是一种人畜共患病原体,也是导致腹泻和结肠炎的重要病原体[23-24],为条件致病菌。本研究结果显示,高、中剂量葛根芩连汤给药11周后,可显著下调大鼠盲肠内容物中与血脂(TC、TG)呈正相关的肠道菌群OTU559、OTU701的丰度。但葛根芩连汤各剂量组大鼠盲肠内容物中OTU135丰度较模型组均显著升高,这可能是因为葛根芩连汤中黄芩和黄连皆为苦寒药,长期给药后易损伤脾胃,造成脾虚后导致腹泻,进而造成Peptoclostridium属微生物含量升高。
综上所述,高剂量(14.85 g/kg)葛根芩连汤可降低HLP模型大鼠的体质量和血脂水平,并可预防其血糖异常升高,其中以葛根芩连汤高剂量的作用最明显;其作用机制可能与降低肠道菌(Tyzzerella、Anaerotruncus属)的含量有关。本研究结果为葛根芩连汤应用于临床降脂和预防血糖升高提供了一定的实验基础。但对于阳性对照药的给药方式和剂量应该加以优化,并需扩大动物样本量。后续工作中拟对关联性分析所确定的重要OTU进行体外分离培养,然后移植无菌小鼠进行验证,以进一步确定目标菌是否具有影响血脂和血糖的功能。
参考文献
[ 1 ] 诸骏仁,高润霖,赵水平,等.中国成人血脂异常防治指南:2016年修订版[J].中国循环杂志,2016,31(10):937-953.
[ 2 ] CHEN YL,XIAO CH,HU ZX,et al. Dynamic lipid profile of hyperlipidemia mice[J]. J Chromator B,2017.DOI:10.1016/j.jchromb.2017.04.017.
[ 3 ] LEROITH D,FONSECA V,VINIK A,et al. Metabolic memory in diabetes-focus on insulin[J]. Diabetes Metab Res Rev,2005,21(2):85-90.
[ 4 ] REDDY M,ZHANG E,NATARAJAN R,et al. Epigenetic mechanisms in diabetic complications and metabolic memory[J]. Diabetologia,2014,58(3):443-455.
[ 5 ] GAO ZZ,LI QW,WU XM,et al. New insights into the mechanisms of Chinese herbal products on diabetes:a focus on the “bacteria-mucosal immunity-inflammation-diabetes” axis[J]. J Immunol Res,2017. DOI:10.1155/2017/1813086.
[ 6 ] 万正兰,肖佩玉,齐同珍.葛根芩连汤对2型糖尿病模型大鼠的降糖作用[J].中国药房,2014,25(23):2131-2133.
[ 7 ] 涂珺,朱水兰,周小妹.黄芩苷、小檗碱和葛根素体外胰岛素抵抗细胞差异化降糖作用研究[J].中国中药杂志,2018,43(20):4097-4103.
[ 8 ] 余学钊,杨伟峰,刘合刚,等.葛根芩连汤对高血脂模型大鼠降脂作用研究[J].亚太传统医药,2012,8(11):12-14.
[ 9 ] PAREKH PJ,BALART LA,JOHNSON DA. The influence of the gut microbiome on obesity,metabolic syndrome and gastrointestinal disease[J]. Clin Transl Gastroenterol,2015. DOI:10.1002/2211-5463.12635.
[10] ZHAO L,ZHANG F,DING X,et al. Gut bacteria selectively promoted by dietary fibers alleviate type 2 diabetes[J]. Science,2018,359(6380):1151-1156.
[11] MENNI C,JACKSON MA,PALLISTER T,et al. Gut microbiome diversity and high-fibre intake are related to lower long-term weight gain[J]. Int J Obes:Lond,2017,41(7):1099-1105.
[12] 遲家敏.实用血脂学[M].北京:人民卫生出版社,2010:81-96.
[13] 刘玉晖,王跃生,王颖怡,等.葛根芩连汤整方剂量变化治疗糖尿病大鼠的量效关系研究[J].中国实验方剂学杂志,2013,19(12):258-261.
[14] WEI N,LIU R,OU Y,et al. Effects of octreotide on glucose transporter type 2 expression in obese rat small intestine[J]. World J Gastro,2011,17(39):4434-4439.
[15] FU J,BONDER MJ,CENIT MC,et al. The gut micro- biome contributes to a substantial proportion of the variation in blood lipids[J]. Circ Res,2015,117(9):817-824.
[16] FENG R,SUN G,ZHANG Y,et al. Short-term high-fat diet exacerbates insulin resistance and glycolipid metabolism disorders in young obese men with hyperlipemia by metabolomics analysis using UPLC-Q-TOF MS[J]. Diabetes,2018,11(2):148-160.
[17] CORRAO G,IBRAHIM B,NICOTRA F,et al. Statins and the risk of diabetes:evidence from a large population-based cohort study[J]. Diabetes Care,2014,37(8):2225-2232.
[18] MAQBOOL M,COOPER ME,KAM JD,et al. Cardiovascular disease and diabetic kidney disease[J]. Saudi J Biol Sci,2018,38(3):217-232.
[19] KAPLAN RC,WANG Z,USYK M,et al. Gut micro- biome composition in the hispanic community health study/study of latinos is shaped by geographic relocation,environmental factors, and obesity[J]. Genome Bio,2019. DOI:10.1186/s13059-019-1831-2.
[20] SONG X,ZHONG L,LYU N,et al. Inulin can alleviate metabolism disorders in ob/ob mice by partially restoring leptin-related pathways mediated by gut microbiota[J]. Genom Proteom Bioinf,2019,17(1):64-75.
[21] LIU YH,NJ AJAMI ,El-SERAG HB ,et al. Dietary quality and the colonic mucosa-associated gut microbiome in humans[J]. Am J Clin Nutr ,2019,3(3):1-12.
[22] KELLY TN,BAZZANO LA,AJAMI NJ,et al. Gut microbiome associates with lifetime cardiovascular disease risk profile among bogalusa heart study participants[J]. Circ Res,2016,119(8):956-964.
[23] FELIPE P,CARLOS O,RODRIGO OSS,et al. Peptoclostridium difficile complete genome sequence of strain Z31[J]. Gut Pathog,2016,8(11):1-7.
[24] GU WJ,HUANG C,LUO Y ,et al. Genome sequence and analysis of peptoclostridium difficile strain ZJCDC-S82[J]. Evol Bioinform,2016. DOI:10.4137/EB.S32476.
(收稿日期:2020-04-23 修回日期:2020-06-24)
(編辑:林 静)
