美洲大蠊提取物逆转人肝癌细胞HepG2/ADM多药耐药的机制研究
2020-08-16李彩琳吴定宇吕鸿张鸿翰王彦权NajibMohammerd彭芳
李彩琳 吴定宇 吕鸿 张鸿翰 王彦权 Najib Mohammerd 彭芳

摘 要 目的:研究美洲大蠊提取物脫脂膏及CⅡ-3(分别简称“脱脂膏”“CⅡ-3”)逆转耐阿霉素(ADM)人肝癌细胞HepG2/ADM多药耐药的作用机制。方法:采用MTT法考察不同质量浓度索拉非尼(阳性对照)、脱脂膏和CⅡ-3对HepG2/ADM细胞的毒性作用,并计算20%抑制浓度(IC20)。试验设置敏感组、耐药组、索拉非尼组、脱脂膏组和CⅡ-3组,敏感组使用HepG2细胞,后4组均使用HepG2/ADM细胞。敏感组和耐药组细胞给予常规培养基,其余3组细胞给予相应药物(浓度均为IC20)。采用激光扫描共聚焦显微技术测定细胞中ADM含量;采用Western blotting法测定细胞中凋亡相关蛋白[B细胞淋巴瘤2(Bcl-2)、剪切型胱天蛋白酶9 p37 (Cleaved-Caspase-9 p37)]的表达水平;分别采用实时荧光定量-聚合酶链式反应法和免疫细胞化学染色法检测细胞中多药耐药相关基因mRNA及蛋白[P-糖蛋白(P-gp)(MDR1基因表达产物)、肺耐药蛋白(LRP)、乳腺癌耐药相关蛋白(BCRP)]和酶介导多药耐药途径中相关基因mRNA及蛋白[谷胱甘肽转移酶(GST-π)、DNA拓扑异构酶Ⅱ(Topo Ⅱ)]的表达水平。结果:索拉非尼、脱脂膏、CⅡ-3对HepG2/ADM细胞的IC20分别为(2.40±0.16)、(200.44±27.52)、(18.00±1.82) μg/mL。与敏感组比较,耐药组细胞中Bcl-2、P-gp、LRP、BCRP、Topo Ⅱ蛋白表达水平以及MDR1、LRP、BCRP、GST-π mRNA表达水平均显著升高(P<0.05或P<0.01)。与耐药组比较,脱脂膏组和 CⅡ-3组细胞中ADM含量显著增加(P<0.05或P<0.01),MDR1 mRNA表达水平和LRP、BCRP、GST-π mRNA及其蛋白表达水平均显著降低(P<0.05或P<0.01);CⅡ-3组细胞中Bcl-2蛋白表达水平、Topo Ⅱ mRNA表达水平均显著降低(P<0.01),Cleaved-Caspase-9 p37蛋白表达水平显著升高(P<0.05)。结论:脱脂膏、CⅡ-3可通过减少药物外排、促进细胞凋亡、减少多药耐药相关基因和酶介导多药耐药途径中相关基因的mRNA及其蛋白的表达等方式,逆转HepG2/ADM细胞的多药耐药性,且CⅡ-3的效果优于脱脂膏。
关键词 美洲大蠊;脱脂膏;CⅡ-3;肝癌;多药耐药;HepG2/ADM细胞;机制
ABSTRACT OBJECTIVE: To study the mechanism of Periplaneta americana extract degreasing cream and CⅡ-3 (shorted for “degreasing cream” and “CⅡ-3”) reversing the multi-drug resistance of human HepG2/ADM cells. METHODS: MTT assay was used to investigate the toxicity effects of different concentrations of sorafenib (positive control), degreasing cream and CⅡ-3 on HepG2/ADM cells, then IC20 was calculated. The experiment was divided into sensitivity drug, drug-resistance group, sorafenib group, degreasing cream group and CⅡ-3 group. HepG2 cells were included in sensitivity group, and HepG2/ADM cells were included in the latter 4 groups. Sensitivity group and drug-resistance group were treated with routine medium, and other 3 groups were treated with relevant medicine (IC20 as drug concentration). The content of ADM in HepG2/ADM cells was determined by Laser scanning confocal microscopy. The expression of apoptosis-related protein as Bcl-2 and Cleaved-Caspase-9 p37 were detected by Western blotting assay. RT-qPCR and immunocytochemistry were adopted to detect mRNA and protein expressions that related to multidrug resistance [P-gp (expression produce of MDR1 gene), LRP, BCRP] and that related to enzyme-mediated multidrug resistance pathway (GST-π and Topo Ⅱ). RESULTS: The IC20 of degreasing cream, CⅡ-3 and sorafenib were (2.40±0.16), (200.44±27.52), (18.00±1.82) μg/mL, respectively. Compared with sensitivity group, the protein expressions of Bcl-2, P-gp, LRP, BCRP and Topo Ⅱ, the mRNA expressions of MDR1, LRP, BCRP and GST-π were increased significantly in drug resistance group (P<0.05 or P<0.01). Compared with drug-resistance group, the mRNA and protein expression of MDR1 mRNA and LRP,BCRP,GST-π were significantly decreased in degreasing cream group and CⅡ-3 group (P<0.05 or P<0.01); the protein expression of Bcl-2 and the mRNA expression of Topo Ⅱ were significantly decreased (P<0.01), while the protein expression level of Cleaved-Caspase-9 p37 was significantly increased in CⅡ-3 group (P<0.05). CONCLUSIONS: Degreasing cream and CⅡ-3 can reverse multidrug resistance of HepG2/ADM cells by reducing drug efflux,promoting cell apoptosis,reducing the mRNA and protein expression of multi-drug resistance gene as well as gene in enzyme-mediated multi-drug resistance pathway. The effect of CⅡ-3 is better than that of degreasing cream.
KEYWORDS Periplaneta americana; Degreasing cream; CⅡ-3; Hepatocellular carcinoma; Multi-drug resistance; HepG2/ADM cells; Mechanism
肝癌是世界上最常见的恶性肿瘤之一,其病死率居全球癌症中的第3位,具有“癌中之癌”之称[1-2]。目前,临床除化疗外,常采用手术治疗、放疗、生物治疗等多种方法联合治疗肝癌,但治疗效果仍不显著,这主要是由于肿瘤细胞容易对化疗药物产生多药耐药(MDR),使药物疗效降低[3]。药物产生MDR的机制复杂,现已明确的主要包括影响凋亡相关蛋白、耐药相关蛋白的表达以及产生MDR相关蛋白促进药物外排等[4-5]。临床上常通过使用P-糖蛋白(P-gp,基因MDR1的表达产物)抑制剂来减少化疗药物的MDR,但由于药物的毒性、相互作用及作用机制单一等多种因素使其效果并不显著。中药逆转肿瘤耐药性具有多途径、多环节、多靶点的独特优势,具有較好的开发潜力[6]。
美洲大蠊(Periplaneta americana L.)又称“蟑螂”,具有极强的生命力,并具有抗炎、镇痛、抗氧化、减轻肝损伤、抗肿瘤等多种药理作用[7-8]。本课题组前期研究表明,美洲大蠊提取物脱脂膏(美洲大蠊干燥虫体经70%乙醇冷浸提取3次,合并、浓缩提取液后得浸膏,再将浸膏去除油脂后得到的褐色黏稠亮状物称为“脱脂膏”)和CⅡ-3(浸膏经聚酰胺柱洗脱浓缩,冷冻干燥后得到的黄褐色冻干粉末称为“CⅡ-3”)均具有抑制肿瘤生长、逆转肝癌细胞MDR等作用[9-11],但其作用机制尚未明确。因此,本研究拟采用人肝癌细胞株HepG2和耐阿霉素(ADM)人肝癌细胞株HepG2/ADM为试验对象,以索拉非尼作为阳性对照,分别从细胞内药物累积和细胞凋亡、耐药相关蛋白表达及酶介导MDR途径中相关基因和蛋白表达等方面深入探讨脱脂膏和CⅡ-3逆转HepG2/ADM细胞MDR的机制,旨在为美洲大蠊相关产品进一步研发提供参考。
1 材料
1.1 仪器
TCS SP8型激光共聚焦显微镜(德国Leica公司);BB16UV/BB5060UV型垂直流超净工作台、BSC- 1000ⅡA2型二级生物安全柜(苏州安泰空气技术有限公司);DSR-22型数控摇床振荡器(江苏康健医疗用品有限公司);SN255939型全自动酶标仪、3111型CO2培养箱(美国Thermo Fisher Scientific公司);785BR15145型聚合酶链式反应(PCR)仪(美国Bio-Rad公司);BSA24S型电子分析天平(德国Sartorius公司);TD3型台式低速离心机(湖南湘仪实验仪器开发有限公司);CKX31型倒置光学显微镜(日本Olympus公司)。
1.2 药品与试剂
脱脂膏(褐色黏稠膏状,批号:P14805-20171023,得率:约75.18%)和CⅡ-3(黄褐色冻干粉末,批号:17102125,得率:约0.2%)均由云南省昆虫生物医药研发重点实验室制备[12-13];ADM(含量:98.0%~102.0%)、BeyoRTTMⅡ cDNA第一链合成试剂盒、二喹啉甲酸(BCA)蛋白测定试剂盒、4,6-联脒-2-苯基吲哚(DAPI)染色液均购自碧云天生物技术有限公司;胎牛血清(FBS,美国Gibco公司,批号:2166446);青链霉素双抗(批号:20190909)、索拉非尼原料药(批号:28154,纯度:≥99.0%)均购自北京索莱宝科技有限公司;DMEM培养基(上海生工生物工程股份有限公司,批号:F909FA0001);兔源B细胞淋巴瘤2(Bcl-2)、胱天蛋白酶9(Caspase-9)、P-gp、肺耐药蛋白(LRP)、乳腺癌耐药相关蛋白(BCRP)、谷胱甘肽转移酶(GST-π)、DNA拓扑异构酶Ⅱ(Topo Ⅱ)多克隆抗体(美国Proteintech公司);辣根过氧化物酶标记山羊抗兔免疫球蛋白G二抗(美国Abcam公司,批号:ab6721);其余试剂均为分析纯或实验室常用试剂,水为双蒸水。PCR试验中mRNA引物均由上海生工生物工程股份有限公司合成。
1.3 细胞
人肝癌细胞株HepG2和人肝癌耐药细胞株HepG2/ADM均由江苏齐氏生物科技有限公司提供。
2 方法
2.1 细胞培养
分别将HepG2、HepG2/ADM细胞接种于含10%FBS和1%青链霉素双抗的DMEM培养基中,在37 ℃、5%CO2培养箱中培养(下同)。其中,HepG2/ADM细胞的培养基中加入0.5 μg/L的ADM,以维持细胞的耐药性。两种细胞均每1~2天更换1次培养基,待细胞长满培养瓶80%以上时进行传代,采用对数生长期(第3~5代)的细胞进行试验。
2.2 药液的制备
将脱脂膏、CⅡ-3分别用生理盐水制备成20 mg/mL(均按生药量计,下同)的母液,以微孔滤膜滤过除菌后,于4 ℃保存,备用。试验时再用生理盐水稀释到所需质量浓度。
2.3 细胞毒性考察
采用MTT法测定索拉非尼、脱脂膏和CⅡ-3对HepG2/ADM细胞的毒性。取对数生长期的HepG2/ADM细胞,以0.25%胰酶消化后,用常规培养基重悬制成细胞密度为2×105个/mL的细胞悬液,按100 μL/孔接种到96孔板中,培养24 h。然后将细胞分为索拉非尼组(2、4、8、16、32 μg/mL)、脱脂膏组(80、160、320、640、1 280 μg/mL)、CⅡ-3组(10、20、40、80、160 μg/mL),每个质量浓度均设置6个复孔。另设空白对照组(含细胞但不含药物)和试剂对照组(不含细胞和药物)。加药培养48 h后,弃去培养基,加入含10%MTT(100 μL/孔)的培养基,继续培养4 h;再加入DMSO(100 μL/孔),振荡30 min,待紫色结晶完全溶解后,用全自动酶标仪在570 nm波长处测定各孔的吸光度(OD)值,计算细胞存活率[细胞存活率(%)=(给药组OD值-试剂对照组OD值)/(空白对照组OD值-试剂对照组OD值)×100%],并采用SPSS 17.0软件计算药物的20%抑制浓度(IC20)。
2.4 细胞分组与给药
试验共设置5个组,分别为敏感组、耐药组、索拉非尼组(阳性对照)、脱脂膏组和CⅡ-3组。敏感组加入HepG2细胞,其余4组均加入HepG2/ADM细胞。给药时,敏感组和耐药组细胞加入常规培养基,其余3组分别加入含相应药物的培养基(终质量浓度均为各自的IC20)。
2.5 美洲大蠊提取物对HepG2/ADM细胞中药物累积的影响考察
采用激光扫描共聚焦显微技术进行测定。取对数生长期的两种细胞,分别以0.25%胰酶消化后,用常规培养基制成单细胞悬液,按8×106个/皿的细胞密度接种于放有爬片的小皿中(直径3 cm),摇匀,于培养箱中培养24 h。细胞培养完毕后,用磷酸盐缓冲液(PBS)清洗,然后按“2.4”项下方法进行分组、给药,每组设置10个复孔。各组细胞培养48 h后,以PBS清洗,再加入含5 μg/mL ADM的培养基,继续培养2 h;取出后用冷PBS清洗5 min×3次,加入4%多聚甲醛避光固定30 min;再用冷PBS清洗5 min×2次,加入DAPI核染5 min;然后用冷PBS清洗5 min×3次;最后,用抗熒光淬灭封片剂封片,避光保存,次日于激光共聚焦显微镜下拍照观察。镜下ADM阳性表达为红色荧光,细胞核呈蓝色荧光。采用Image J 6.0软件计算阳性细胞荧光强度值(荧光强度值越大表明药物含量越高)。
2.6 美洲大蠊提取物对HepG2/ADM细胞中凋亡相关蛋白的影响考察
采用Western blotting法测定细胞中Bcl-2、剪切型Caspase-9 p37(Cleaved-Caspase-9 p37)蛋白表达水平。取对数生长期的两种细胞,分别以0.25%胰酶消化后,用常规培养基制成细胞密度为5×105个/mL的单细胞悬液,按7.5×105 个/孔的细胞密度接种于24孔板中,培养24 h后,按“2.4”项下方法分组、给药,每组设置3个复孔,培养48 h。细胞培养完毕后,用PBS清洗3 min×2~3次,然后转移至1.5 mL离心管中,加入RIPA裂解液50 μL(含蛋白酶抑制剂、磷酸化抑制剂),冰上孵育30 min,用移液器反复吹打,确保细胞完全裂解;然后在4 ℃下以20 000 r/min离心5 min,收集上清,即为总蛋白溶液。采用BCA法进行蛋白定量后,变性处理,再经十二烷基硫酸钠-聚丙烯酰胺(SDS-PAGE)电泳分离,然后转入醋酸纤维素印迹膜上;以5%脱脂奶粉封闭2 h后,加入Bcl-2(1 ∶ 1 500)、Caspase-9/(1 ∶ 800)、GAPDH(1 ∶ 5 000)一抗,4 ℃下孵育过夜;以TBST洗膜10 min×3次,加入二抗(1 ∶ 500),室温下孵育2 h;以TBST洗膜6 min×3次,然后置于凝胶成像仪中,以电化学法(ECL)显影。采用Image J 6.0软件分析蛋白条带灰度值,以目的蛋白条带与内参(GAPDH)蛋白条带灰度值的比值表示目的蛋白的表达水平。
2.7 美洲大蠊提取物对HepG2/ADM细胞中MDR相关基因mRNA及其蛋白的影响考察
2.7.1 MDR相关基因mRNA表达 采用实时荧光定量-PCR法测定细胞中MDR1、LRP、BCRP的mRNA表达水平。取对数生长期细胞,0.25%胰酶消化后制成单细胞悬液,按2.4×105个/孔的细胞密度接种于6孔板中,培养24 h后,按“2.4”项下方法分组、给药,每组设置3个复孔,培养48 h。细胞培养完毕后,用Trizol 试剂提取总RNA,验证其浓度和纯度,然后取总RNA 2 μg,按BeyoRTTM Ⅱ cDNA第一链合成试剂盒说明书操作合成cDNA,并以cDNA为模板采用两步法进行PCR扩增。反应体系(20 ?L):Beyo FastTM SYBR Green qPCR Mix (2×)10 ?L,上、下游引物各2 ?L,Template 2 ?L、去核酸酶水4 ?L。反应程序:95 ℃预变性2 min;95 ℃变性15 s,60 ℃退火30 s,40个循环。引物序列:MDR1上游引物序列为5′-GAAGGTGAAGGTCGGAGTC-3′,下游引物序列为5′-GAAGATGGTGATGGGATTTC-3′,扩增产物大小为226 bp;LRP 上游引物序列为5′-GCTCATAGGATATGGGACACACT-3′,下游引物序列为5′-CCAGGAAATCAGTTGGTGAGAAT-3′,扩增产物大小为121 bp;BCRP上游引物序列为5′-GTTCTCAGCAGCTCTT- CGGCTT-3′,下游引物序列为5′-TCCTCCAGACACA- CCACGGATA-3′,扩增产物大小为268 bp;GAPDH上游引物序列为5′-GGAGCGAGATCCCTCCAAAAT-3′,下游引物序列为5′-GGCTGTTGTCATACTTCTCATGG- 3′,扩增产物大小为197 bp。以GAPDH为内参,采用2-ΔΔCt法计算各目的基因的mRNA表达水平(式中Ct表示荧光信号强度达到设定阈值时经历的循环次数)。
2.7.2 MDR相关蛋白表达 采用免疫细胞化学染色法检测细胞中P-gp、LRP、BCRP蛋白表达水平。取对数生长期细胞,以0.25%胰酶消化后,按2.4×106个/孔的细胞密度接种于预置有爬片的12孔板中,待细胞贴壁生长良好后,按“2.4”项下方法分组、给药,培养48 h。取出各组长有细胞的爬片,以PBS漂洗2 min×3次;以4%多聚甲醛固定30 min后,将3% H2O2-甲醇混合液(1 ∶ 4,V/V)滴在各组爬片上,室温孵育30 min;以水洗5 min×2次,加入5%牛血清白蛋白(BSA)室温封闭10 min;加入P-gp(1 ∶ 500)、LRP(1 ∶ 400)、BCRP(1 ∶ 400)一抗,4 ℃下孵育过夜;以PBS清洗2 min×3次,滴加二抗(1 ∶ 1 000),37 ℃下孵育30 min;以PBS清洗2 min×3次,用DAB显色试剂盒显色(棕色)后加入水终止反应;用水清洗5 min×3次,加入苏木素复染40 s;将标本放入饱和Na2HPO4溶液中浸泡2 min,取出后立即用水清洗5 min×3次;用乙醇梯度(50%、75%、85%、95%、100%)脱水,甘油封片。光镜下观察各组细胞中P-gp、LRP、BCRP蛋白表达情况,以细胞核有明显棕色或棕黄色颗粒为阳性表达。采用Image J 6.0软件计算阳性细胞的平均光密度值。
2.8 美洲大蠊提取物对HepG2/ADM细胞中酶介导MDR途径中相关基因mRNA及其蛋白的影响考察
2.8.1 对酶介导MDR途径中相关基因mRNA表达的影响 参照“2.7.1”项下方法测定细胞中TopoⅡ、GST-π mRNA表达水平。其中,GST-π上游引物序列为5′- AGTCTCCTCGGTTCCCAAGCAA-3′,下游引物序列为5′-GGTGCTGGTTAAAGAGTTCGCC-3′,扩增产物大小为132 bp;TopoⅡ上游引物序列为5′-TTAATGCTGCGGACAACAAACA-3′,下游引物序列为5′-CGACCACCTGTCACTTTCTTTT-3′,扩增产物大小为217 bp;其余试验条件均与“2.7.1”项下相同。
2.8.2 对酶介导MDR途径中相关蛋白表达的影响 参照“2.7.2”项下方法检测细胞中Topo Ⅱ、GST-π蛋白表达水平。其中,一抗的稀释比例均为1 ∶ 200;其余试验条件均与“2.7.2”项下相同。
2.9 统计学方法
采用SPSS 19.0统计学软件进行数据分析。计量资料以x±s表示,多组间比较采用单因素方差分析,两组间比较采用t检验。P<0.05表示差异具有统计学意义。
3 结果
3.1 细胞毒性考察结果
3种药物分别作用48 h后,均对HepG2/ADM细胞生长有抑制作用,且均呈一定的浓度依赖性趋势。索拉非尼、脱脂膏、CⅡ-3的IC20分别为(2.40±0.16)、(200.44±27.52)、(18.00±1.82) μg/mL,三者间差异均具有统计学意义(P<0.01)。各组细胞的存活率测定结果见图1。
3.2 美洲大蠊提取物对细胞药物累积的影响
给药48 h后,与敏感组比较,耐药组细胞中ADM含量差异无统计学意义(P>0.05)。与耐药组比较,索拉非尼组、脱脂膏组、CⅡ-3组细胞中ADM含量均显著增加(P<0.05)。3个给药组间比较,细胞中ADM含量差异均无统计学意义(P>0.05)。各組细胞的共聚焦激光扫描显微图见图2(其中,Merge图为融合荧光叠加图),细胞中ADM含量测定结果见表1。
3.3 美洲大蠊提取物对耐药细胞HepG2/ADM中凋亡相关蛋白表达的影响
与敏感组比较,耐药组细胞中Bcl-2蛋白表达水平显著升高(P<0.05),Cleaved-Caspase-9 p37蛋白表达水平差异无统计学意义(P>0.05)。与耐药组比较,CⅡ-3组细胞中Bcl-2蛋白表达水平显著降低(P<0.01),索拉非尼组、CⅡ-3组细胞中Cleaved-Caspase-9 p37蛋白表达水平均显著升高(P<0.05或P<0.01)。与索拉非尼组比较,CⅡ-3组细胞中Bcl-2蛋白表达水平差异无统计学意义(P>0.05)。各组细胞中Bcl-2、Cleaved-Caspase-9 p37蛋白表达电泳图见图3,蛋白表达水平测定结果见表2。
3.4 美洲大蠊提取物对HepG2/ADM细胞中MDR相关基因mRNA及其蛋白表达的影响
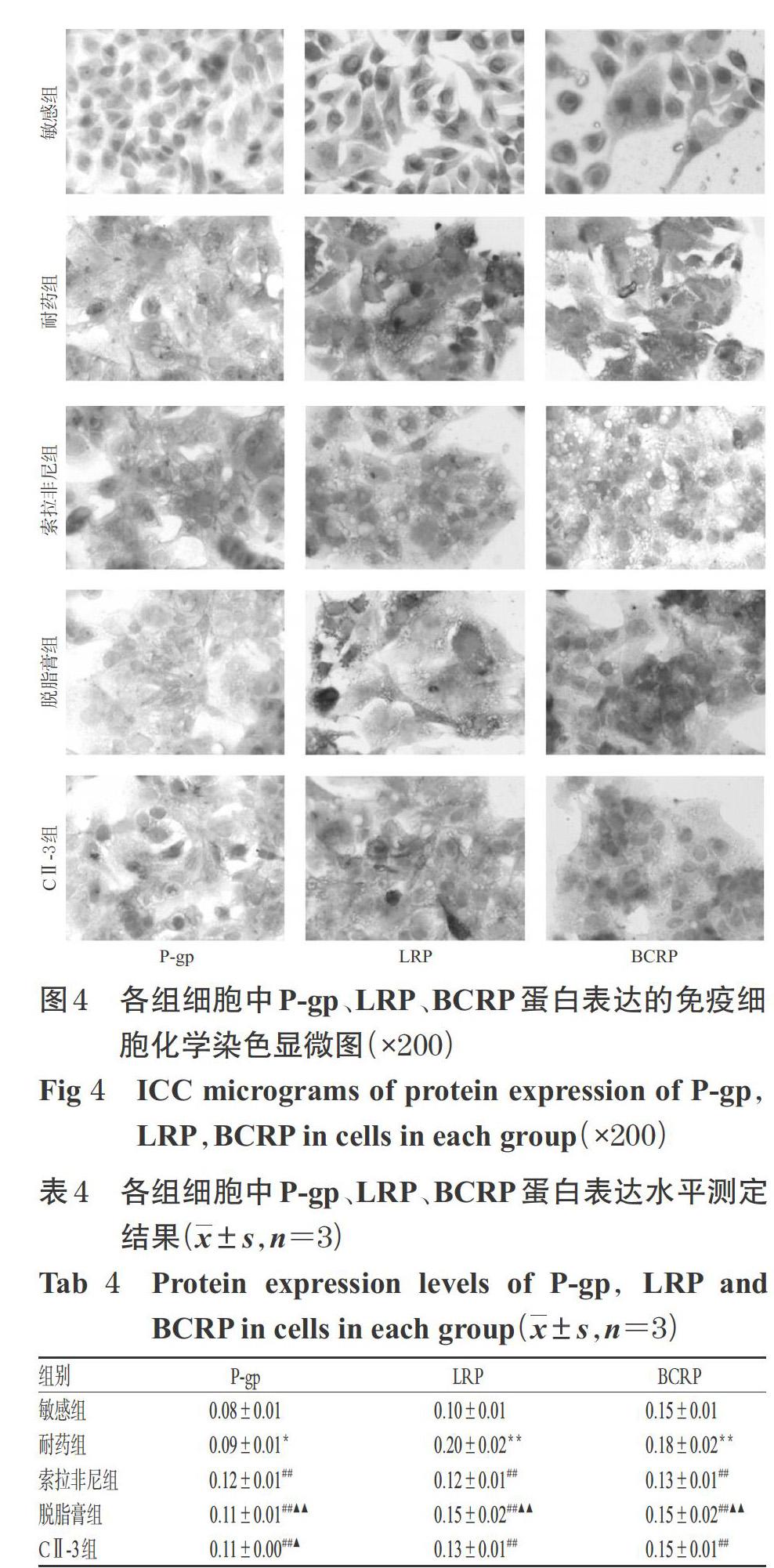
3.4.1 MDR相关基因mRNA表达 与敏感组比较,耐药组细胞中MDR1、LRP、BCRP mRNA表达水平均显著升高(P<0.01)。与耐药组比较,索拉非尼组细胞中LRP、BCRP mRNA表达水平均显著降低(P<0.01),但MDR1 mRNA表达水平显著升高(P<0.01);脱脂膏组细胞中MDR1、BCRP mRNA表达水平均显著降低(P<0.05或P<0.01),但LRP mRNA表达水平显著升高(P<0.05);CⅡ-3组细胞中MDR1、LRP、BCRP mRNA表达水平均显著降低(P<0.01)。与索拉非尼组比较,脱脂膏组、CⅡ-3组细胞中MDR1 mRNA表达水平均显著降低(P<0.01),CⅡ-3组细胞中LRP mRNA表达水平差异无统计学意义(P>0.05)。各组细胞中MDR1、LRP、BCRP mRNA表达水平测定结果见表3。
3.4.2 MDR相关蛋白表达 与敏感组比较,耐药组细胞中P-gp、LRP、BCRP蛋白表达水平显著升高(P<0.05或P<0.01)。与耐药组比较,各给药组细胞中LRP、BCRP蛋白表达水平均显著降低(P<0.01),但细胞中P-gp蛋白表达水平均显著升高(P<0.01)。与索拉非尼组比较,脱脂膏组、CⅡ-3组细胞中P-gp蛋白表达水平均显著降低(P<0.05或P<0.01),CⅡ-3组细胞中LRP、BCRP蛋白表达水平差异无统计学意义(P>0.05)。各组细胞中P-gp、LRP、BCRP蛋白表达的免疫细胞化学染色显微图见图4,蛋白表达水平测定结果见表4。
3.5 美洲大蠊提取物对HepG2/ADM细胞中酶介导MDR途径中相关基因mRNA及其蛋白表达的影响
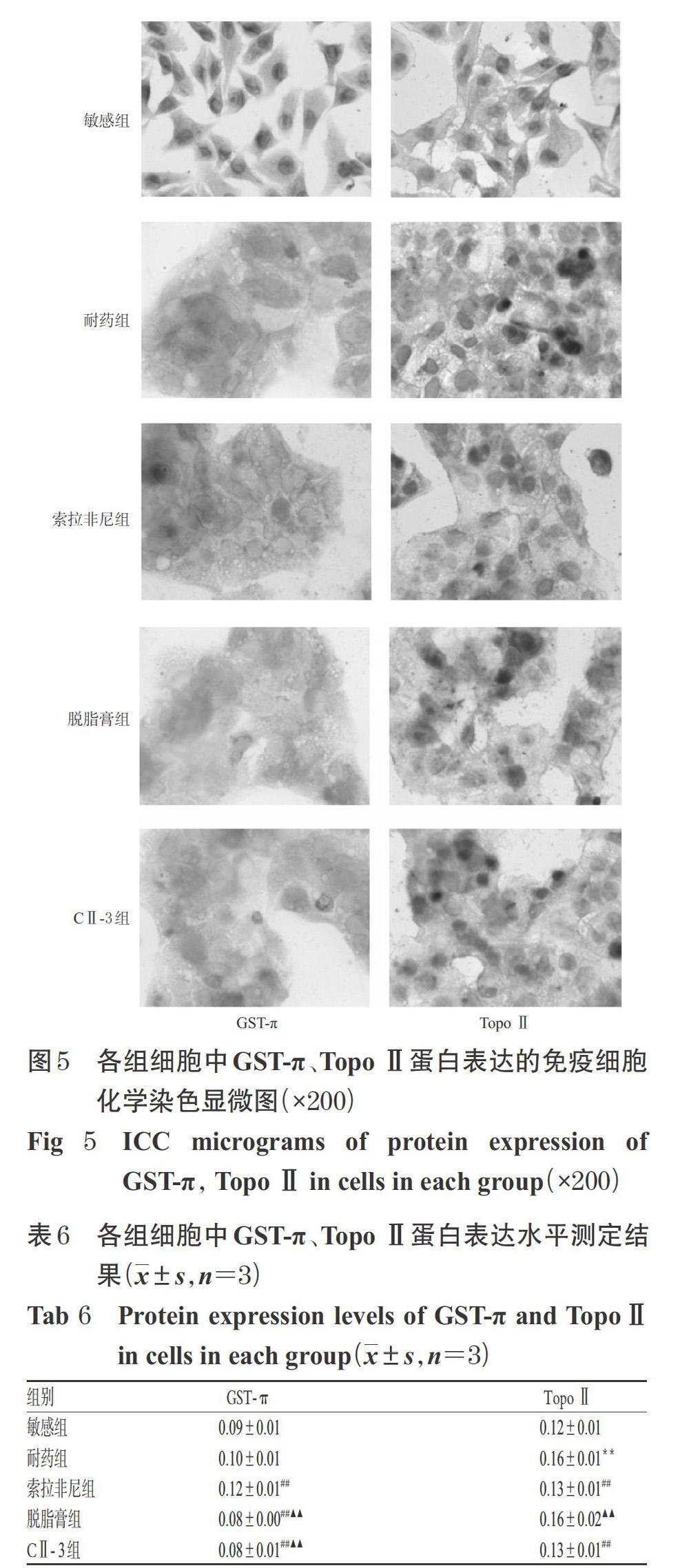
3.5.1 酶介导MDR途径中相关基因mRNA表达 与敏感组比较,耐药组细胞中GST-π mRNA表达水平显著升高(P<0.01),但Topo Ⅱ mRNA表达水平差异无统计学意义(P>0.05)。与耐药组比较,索拉非尼组细胞中Topo Ⅱ mRNA表达水平和脱脂膏组、CⅡ-3组细胞中GST-π mRNA表达水平均显著降低(P<0.01)。与索拉非尼组比较,脱脂膏组、CⅡ-3组细胞中GST-π mRNA表达水平均显著降低(P<0.05或P<0.01)。各组细胞中GST-π、Topo Ⅱ mRNA表达水平测定结果见表5。
3.5.2 酶介导MDR途径中相关蛋白表达 与敏感组比较,耐药组细胞中TopoⅡ蛋白表达水平显著升高(P<0.01),但GST-π蛋白表达水平差异无统计学意义(P>0.05)。与耐药组比较,索拉非尼组细胞中GST-π蛋白表达水平显著升高(P<0.01),但脱脂膏组、CⅡ-3组细胞中GST-π蛋白表达水平和索拉非尼组、CⅡ- 3组细胞中Topo Ⅱ蛋白表达水平均显著降低(P<0.01)。与索拉非尼组比较,脱脂膏组、CⅡ- 3组细胞中GST-π蛋白表达水平均显著降低(P<0.01),CⅡ- 3组Topo Ⅱ蛋白表达水平差异无统计学意义(P>0.05)。各组细胞中GST-π、Topo Ⅱ蛋白表达的免疫细胞化学染色显微图见图5,蛋白表达水平测定结果见表6。
4 讨论
本研究利用ADM自发荧光的特点,通过激光扫描共聚焦显微技术观察其在细胞中的累积情况。结果发现经脱脂膏、CⅡ-3处理后,细胞中ADM含量明显增加,即药物的外排减少。常规情况下,耐药细胞通过使药物外排产生耐药性,故细胞内药物含量应减少,但由于本研究中采用耐ADM的细胞系,培养时为了维持细胞耐药性,加入了含ADM的培养基培养,所以在本研究耐药组细胞中ADM含量较敏感组反而增加。化学治疗仍然为目前临床上治疗肿瘤的主要手段,索拉非尼为临床常用且是第一个被美国食品药品监督管理局(FDA)批准用于治疗晚期肝癌的分子抑制剂,故本研究以其作为阳性对照药[14]。
细胞凋亡是多基因严格控制的细胞自主死亡过程,这些基因包括抑癌基因p53、Caspase家族、Bcl-2家族等。Bcl-2作为重要的抗凋亡因子,通过和特定的蛋白[如B细胞淋巴瘤xL(Bcl-xL)、Bcl-2相关X蛋白(Bax)等]形成二聚体后,作为在细胞死亡信号通路上的分子开关,调控细胞凋亡。Bcl-2表达增加时,可阻止细胞凋亡而产生耐药性[15]。Caspase-9位于凋亡级联反应上游,当凋亡起始信号作用于线粒体后,引起线粒体释放细胞色素C(Cyt-C);Cyt-C与凋亡蛋白酶活化因子1(Apaf-1)结合并使Apaf-1构象改变形成八聚体,后者与Caspase-9 p37结合并诱导其发生自我催化;活化的Cleaved-Caspase-9 p37亚基使级联反应进一步放大,从而促进细胞凋亡[16]。本研究结果显示,CⅡ-3作用后,耐药细胞中抗凋亡蛋白Bcl-2表达显著下调,促凋亡蛋白Cleaved-Caspase-9 p37表达显著上调,表明CⅡ-3可促进细胞凋亡。
P-gp和BCRP均可与三磷酸腺苷(ATP)结合,通过ATP供能,使细胞内药物泵出,减少细胞内药物含量,从而使细胞产生耐药性[17-18]。LRP在MDR肿瘤细胞中过度表达,阻滞作用于细胞核的化疗药物进入細胞核,或将细胞内药物泵出核外,从而引起肿瘤MDR[19]。本研究结果显示,脱脂膏、CⅡ-3作用后,耐药细胞中MDR1 、BCRP mRNA表达以及LRP、BCRP蛋白表达均显著下调,并且CⅡ-3作用后耐药细胞中LRP mRNA表达也显著下调。但本试验中出现MDR1 mRNA表达下调而其对应的表达产物P-gp蛋白表达却上调的情况,具体原因有待进一步分析。
GST-π是一种多功能药物代谢酶,其不仅具有解毒功能,而且可以通过催化谷胱甘肽与进入胞内的化疗药物结合,快速降低药物有效浓度,对降低化疗药物的耐药性发挥了重要作用;TopoⅡ是体内重要的核酸酶,其与有丝分裂、染色体配对、基因重组和转录及DNA损伤修复有密切关系,参与DNA的转录、翻译、复制分离等过程,其活性增强,可增强DNA修复能力,降低化疗药物的细胞毒性,从而产生耐药性[20]。本研究结果显示,脱脂膏、CⅡ-3作用后,耐药细胞中GST-π mRNA及其蛋白的表达均显著下调,并且CⅡ-3作用后耐药细胞中Topo Ⅱ蛋白表达亦显著下调。
综上,脱脂膏、CⅡ-3可通过减少药物外排、促进细胞凋亡、减少MDR和酶介导MDR途径中相关基因的mRNA及其蛋白的表达等方式,逆转HepG2/ADM细胞的MDR,且CⅡ-3的效果优于脱脂膏。在后续研究中,本实验室将对脱脂膏和CⅡ-3联合化疗药物逆转MDR进行进一步的体内研究,为美洲大蠊提取物联合化疗药物提高临床肝癌治疗效果提供实验基础。
参考文献
[ 1 ] LI S,LIU XY,PAN Q,et al. Hepatitis C virus-induced FUT8 causes 5-FU drug resistance in human hepatoma Huh7.5.1 cells[J]. Viruses,2019,11(4):378-395.
[ 2 ] OLUFEMII JO. Hepatocellular carcinoma in the develo- ping world[J]. Semin Oncol,2001,28(2):179-187.
[ 3 ] LING SB,LI J,SHAN QN,et al. USP22 mediates the multidrug resistance of hepatocellular carcinoma via the SIRT1/AKT/MRP1 signaling pathway[J]. Mol Oncol,2017,11(6):682-695.
[ 4 ] JESSICA SC,LETICOA GMA,RODRIGO SRH,et al.Achillin increases chemosensitivity to paclitaxel,overcoming resistance and enhancing apoptosis in human hepatocellular carcinoma cell line resistant to paclitaxel (Hep3B/PTX)[J]. Pharmaceutics,2019,11(1):512-537.
[ 5 ] MENG QL,HE XQ,XIE GW,et al. MEK inhibitor enhances sensitivity to chemotherapeutic drugs in multidrug resistant hepatocellular carcinoma cells[J]. Oncol Lett,2017,14(3):3089-3095.
[ 6 ] 刘海晔.中药逆转肿瘤多药耐药性的研究进展[J].中草药,2015,46(7):1096-1102.
[ 7 ] 欧红利.美洲大蠊多肽抗肿瘤及免疫调节作用研究[D].大理:大理大学,2017.
[ 8 ] 高洁,沈咏梅,岳碧松,等.美洲大蠊药理作用及其临床疗效的研究进展[J].中药药理与临床,2018,34(4):203-208.
[ 9 ] 吕鸿,王瑶,张蕊,等.美洲大蠊多肽PAP-2对H22荷瘤小鼠的抑瘤作用研究[J].中国药房,2019,30(7):927-931.
[10] 王瑶,李婷,乔婷婷,等.美洲大蠊提取物逆转BEL-7402/5-Fu多药耐药性的作用及机制研究[J].药学研究,2017,36(6):315-318.
[11] 刘俊勇,夏盟恺,彭芳,等.美洲大蠊提取物逆转肝癌耐药性的实验研究[J].中国生化药物杂志,2015,35(4):19-23.
[12] 普小菲,罗亦佳,彭芳,等.美洲大蠊提取物CⅡ-3体内外抗HSV-2实验研究[J].大理学院学报,2014,13(10):5-9.
[13] 李洪文,耿玲,刘光明,等.美洲大蠊脱脂膏及其活性炭脱色物体外抗菌活性研究[J].中国实验方剂学杂志,2012,18(11):159-161.
[14] 慕升君.刺激响应型MSNs异靶点共递送SF和Tim-3单抗用于肝细胞癌化学免疫联合治疗[D].济南:山东大学,2018.
[15] 李元滨,林丽珠,王超,等.益气除痰方联合顺铂对肺癌耐药皮下移植瘤生长及Bax、Bcl-2表达的影响[J].中华中医药杂志,2019,34(2):755-758.
[16] 潘科. Caspase-9和Bax在胃癌中表达以及和凋亡的关系[D].大连:大连医科大学,2007.
[17] 李峥. P-糖蛋白与药物相互作用模型的建立及其在药物评价中的应用[D].北京:中国人民解放军军事医学科学院,2009.
[18] 马海琳,车少敏,王晓丽,等.沉默BCRP表达抑制乳腺癌细胞对阿霉素耐药的机制研究[J].山西医科大学学报,2019,50(10):1357-1363
[19] 刘津,唐安洲,何光耀,等.人鼻咽癌耐药细胞株的建立及其与LRP的关系[J].中国肿瘤临床,2011,38(16):938- 942.
[20] 王亚琪,曾普华,郜文辉,等.益气化瘀解毒方对MRP、GST-π和Topo Ⅱ基因在Sorafenib获得性耐药人肝癌QGY7702细胞表达的干预研究[J].吉林中医药,2020,40(4):505-509.
(收稿日期:2020-02-27 修回日期:2020-06-28)
(編辑:林 静)
