沙苑子总黄酮对雄性生殖功能障碍模型大鼠的改善作用及机制研究
2020-08-16刘雯侯晨辉李江
刘雯 侯晨辉 李江

摘 要 目的:研究沙苑子總黄酮(TFA)对腺嘌呤诱导的雄性生殖功能障碍模型大鼠的改善作用及机制。方法:将雄性SD大鼠分为空白组、模型组、阳性组(五子衍宗丸,2 g/kg)和TFA低、中、高剂量组(0.05、0.1、0.2 g/kg),每组12只。各组雄性大鼠每日早上9:00灌胃相应药物,并于同日下午3:00灌胃腺嘌呤混悬液以复制生殖功能障碍模型(空白组除外),连续给药35 d。给药结束后,将各组雄性大鼠与雌性大鼠按1 ∶ 1合笼交配7 d后取出,检测致雌鼠受孕率;采用酶联免疫吸附法检测雄性大鼠血清中睾酮(T)、雌二醇(E2)、促卵泡激素(FSH)、促黄体激素(LH)、谷胱甘肽过氧化物酶(GSH-Px)、超氧化物歧化酶(SOD)、丙二醛(MDA)、肌酐(Scr)、尿素氮(BUN)水平;摘取雄性大鼠睾丸、附睾、精囊腺、胸腺、肾,并计算其脏器指数;采用苏木精-伊红(HE)染色法观察雄性大鼠睾丸、附睾及肾组织的病理学变化;采用免疫组织化学染色检测雄性大鼠肾组织中B细胞淋巴瘤/白血病2(Bcl-2)、Bcl-2相关X蛋白(Bax)、胱天蛋白酶3(Caspase-3)、Caspase-9的蛋白表达水平。结果:与空白组比较,模型组雄性大鼠致雌鼠受孕率,睾丸、附睾、精囊腺、胸腺指数,血清中T、E2、SOD、GSH-Px水平,肾组织中Bcl-2蛋白表达水平均显著降低(P<0.01);肾指数和血清中FSH、LH、MDA、Scr、 BUN水平,肾组织中 Bax、Caspase-3、Caspase-9蛋白表达水平均显著升高(P<0.01);睾丸组织中生精小管直径变细、间距较宽,生精细胞排列紊乱;附睾管管壁增厚、排列疏松、间质增大,管腔增生萎缩、腔内精子聚集成团;肾组织中肾间质纤维增生,肾小管内可见大量黄色结晶。与模型组比较,阳性组和TFA中、高剂量组雄性大鼠致雌鼠受孕率,睾丸、附睾、精囊腺、胸腺指数,血清中T、E2、SOD、GSH-Px水平,肾组织中Bcl-2蛋白表达水平均显著升高(P<0.05或P<0.01),肾指数和血清中FSH、LH、MDA、Scr、 BUN水平,肾组织中 Bax、Caspase-3、Caspase-9蛋白表达水平均显著降低(P<0.05或P<0.01);TFA低剂量组上述指标变化趋势相同,且大部分有显著性差异(P<0.05或P<0.01);各给药组雄性大鼠睾丸、附睾、肾组织病理学变化均明显减轻。结论:TFA对腺嘌呤诱导的雄性大鼠的生殖障碍具有显著改善作用,其机制可能与降低性激素FSH、LH水平和下调肾组织中凋亡相关蛋白表达,升高性激素T、E2水平和改善机体氧化应激水平有关。
关键词 沙苑子总黄酮;生殖功能障碍;性激素;氧化应激;机制;大鼠
ABSTRACT OBJECTIVE: To study the improvement effects of Astragalus complanatus total flavonoids (TFA) on adenine-induced reproductive dysfunction model male rats and its mechanism. METHODS: Male SD rats were divided into blank group, model group, positive group (Wuzhi yanzong pill, 2 g/kg), TFA high-dose, medium-dose and low-dose groups (0.05, 0.1, 0.2 g/kg), with 12 rats in each group. Male rats in each group were given the corresponding drugs intragastrically at 9:00 a.m. every day, while the model of reproductive dysfunction was reproduced by intragastric administration of adenine suspension (except for blank group) at 3:00 p.m. on the same day, for consecutive 35 days. After medication, male rats in each group were mated with female rats by ratio of 1 ∶ 1 in cages; 7 days later, inducing-pregnancy rate of male rats were measured. ELISA assay was used to detect the serum levels of T, E2, FSH, LH, GSH-Px, SOD, MDA, Scr and BUN in male rats; the testis, epididymis, seminal vesicle, thymus and kidney of male rats were extracted and the organ index was calculated; HE staining was used to observe the pathological changes of testis, epididymis and kidney; the protein expression of Bcl-2, Bax, Caspase-3 and Caspase-9 in the renal tissue of male rats were detected by immunohistochemistry. RESULTS: Compared with blank group, the inducing-pregnancy rate of male rats, the testis, epididymis, seminal vesicle gland, thymus indexes, the serum levels of T, E2, SOD and GSH-Px, the protein expression levels of Bcl-2 in renal tissue were reduced significantly in model group (P<0.01); the renal index, the serum levels of FSH, LH, MDA, Scr and BUN, the protein expression levels of Bax, Caspase-3 and Caspase-9 in renal tissue were increased significantly (P<0.01); the diameter of seminiferous tubules in testis became thinner, the spacing was wider, and the arrangement of seminiferous cells was disordered; the wall of epididymis was thickened, the arrangement was loose, the stroma was enlarged, the lumen was proliferated and atrophied, and the sperm in the lumen wass aggregated; in renal tissue, interstitial fibers was proliferated, and a large number of yellow crystals were seen in renal tubules. Compared with model group, the inducing-pregnancy rate, the testis, epididymis, seminal vesicle gland, thymus indexes, the serum levels of T, E2, SOD and GSH-Px, the protein expression levels of Bcl-2 in renal tissue of male rats were increased significantly in the positive group, TFA medium-dose and high-dose groups (P<0.05 or P<0.01), while the renal index, the serum levels of FSH, LH, MDA, Scr and BUN, the protein expression levels of Bax, Caspase-3 and Caspase-9 in renal tissue were decreased significantly (P<0.05 or P<0.01); there was the same chage trend and most with significant difference in above indexes of TFA low-dose group (P<0.05 or P<0.01); the pathalogic changes of testis, epididymis and renal tissue were improved significantly. CONCLUSIONS: TFA can significantly improve adenine-induced reproductive dysfunction model male rats. The mechanism may be associated with reducing hormone FSH and LH level, the expression of apoptosis-related proteins in renal tissue, while increasing the level of hormone T and E2 and improving oxidant stress level.
KEYWORDS Astragalus complanatus total flavonoids; Reproductive dysfunction; Horone; Oxidant stress; Mechanism; Rat
近年来,随着环境污染加剧、生活节奏加快及生育年龄延迟,不育症患者数量急剧增加,发病率逐年上升,对人类生殖繁衍造成巨大影响[1]。据统计,男性不育症占所有不孕不育症的35%~50%,其中弱精子症是导致男性不育症的重要因素,其病因机制尚未完全明确,且治疗手段与可选择的药物较少[2],因此,研发防治男性生殖功能障碍的新型药物是目前的热点之一。
目前,西医在治疗弱精子症方面虽有一定成果,但仍有部分患者的治疗效果不尽人意,尚缺乏特效药物[3]。中医理论认为,肾藏精而主生殖,当肾精肾气充足、精室充盈,方能孕育生命,因此在治疗男性不育时,当先从肾着手[4-5]。沙苑子为豆科植物扁茎黄芪(Astragalus complanatus R. Brown.)的干燥成熟种子,性味甘、温,归肝、肾经;具有温补肝肾、固精、缩尿、明目之功效,其肾助阳之功效颇为显著;主要用于治疗肾虚腰痛、遗精早泄、遗尿尿频、白浊带下、眩晕、目暗昏花等[6]。现代药学研究发现,其化学成分主要有黄酮类、三萜皂苷类、脂肪酸、氨基酸、挥发油、甾醇类等,对血压、脑血流量、免疫功能和血液流变均有影响,且具有解热镇痛、镇静、耐寒、抗疲劳、抗炎和降脂保肝的作用[7]。陈勤[8]研究发现,沙苑子总黄酮(TFA)能显著升高酗酒模型小鼠睾丸、附睾指数,并增加其精子数量和活力,降低精子的畸变率,这提示TFA对酗酒模型小鼠的生精功能和精子细胞损伤有一定的改善效果。本研究采用腺嘌呤灌胃雄性大鼠复制生殖功能障碍模型,探讨TFA对雄性生殖障碍模型大鼠精子质量、生育能力的影响,并通过检测大鼠血清中性激素雌二醇(E2)、睾酮(T)、促卵泡激素(FSH)、促黄体激素(LH)水平,氧化应激相关指标谷胱甘肽过氧化物酶(GSH-Px)、超氧化物歧化酶(SOD)、丙二醛(MDA)水平,肾功能指标肌酐(Scr)、尿素氮(BUN)水平,肾组织中凋亡蛋白B细胞淋巴瘤/白血病2(Bcl-2)、Bcl-2相关X蛋白(Bax)、胱天蛋白酶3(Caspase-3)、Caspase-9蛋白表达水平等指标变化,以期为治疗男性生殖功能障碍的新药研发及临床应用提供参考。
1 材料
1.1 仪器
BS-490型全自动生化分析仪(深圳迈瑞生物医疗电子股份有限公司);H1850R型高速冷冻离心机(湖南湘仪实验室仪器开发有限公司);JJ-12J型脱水机(武汉俊杰电子有限公司);RM2016型病理切片机(上海徕卡仪器有限公司);Eclipse E100型正置光学显微镜(日本Nikon公司);BSA2245型电子天平(德国Sartorius公司);HM-SY96A型全自动酶标仪(山东食安生物科技有限公司);Aperio A72数字病理系统[徕卡显微系统(上海)贸易有限公司]。
1.2 药品与试剂
TFA[南京泽郎生物科技有限公司,含量:47.28%(即每100 g沙苑子提取物含总黄酮47.28 g)];五子衍宗丸(江西药都樟树制药有限公司,批号:20180415,规格:6 g/袋);E2、T、FSH、LH、GSH-Px、SOD、MDA、Scr、BUN酶联免疫吸附法(ELISA)试剂盒(苏州卡尔文生物科技有限公司,批号分别为:E20181012A、E20181017A、E20181003A、E20181019A、E20181024A、E20181028A、E20180922A、E20181018A、E20181016A);兔抗大鼠 Bcl-2多克隆抗体、兔抗大鼠Bax单克隆抗体、兔抗大鼠Caspase-3单克隆抗体、兔抗大鼠Caspase-9多克隆抗体(美国Abcam公司,批号分别为:ab32124、ab32503、ab13847、ab32539);辣根过氧化物酶标记的羊抗兔免疫球蛋白G二抗(北京力高泰科技有限公司,批号:ab205718);其余试剂均为分析纯或实验室常用试剂,水为纯净水。
1.3 动物
清洁级雄性、雌性SD大鼠各72只,体质量180~220 g,购于济南朋悦实验动物繁育有限公司,动物生产许可证號:SCXK(鲁)20190003。
2 方法
2.1 分组、造模与给药
取雄性大鼠适应性喂养7 d后,分为空白组(生理盐水)、模型组(生理盐水)、阳性组(五子衍宗丸,2 g/kg,按人与大鼠体表面积折算,相当于人临床用药剂量的10倍)和TFA低、中、高剂量组(0.05、0.10、0.20 g/kg,给药剂量参考文献方法[9]设置),每组12只。采用边给药边造模的方式,各组大鼠于每日上午9:00灌胃相应药物(生理盐水配制);于同日下午3:00,除空白组不作处理外,其余各组大鼠灌胃腺嘌呤混悬液(200 mg/kg,以0.5%羧甲基纤维素钠配制,临用现配)复制雄性大鼠生殖功能障碍模型,连续给药35 d[10-11]。大约第30天时模型组大鼠出现反应迟钝、弓背、畏冷竖毛、尿量增加等情况时,表明模型建立成功。
2.2 各组大鼠精子质量评价
末次给药后,取雌性大鼠按1 ∶ 1比例与各组雄性大鼠合笼交配,7 d后取出雄性大鼠。雌性大鼠继续饲养14 d,并检测受孕率(受孕率=受孕雌鼠数量/雌鼠总数量),以评价雄性大鼠的精子质量。
2.3 各组大鼠血清中性激素、氧化应激、肾功能相关指标检测
各组雄性大鼠交配完毕取出后,腹腔注射10%水合氯醛麻醉,腹主动脉取血3 mL,于4 ℃条件下以3 000 r/min离心15 min。取上清液,按ELISA试剂盒说明书方法操作,检测各组大鼠血清中E2、T、FSH、LH、GSH-Px、SOD、MDA、Scr、BUN水平。
2.4 各组大鼠脏器指数的检测
各组雄性大鼠取血后,摘取其胸腺、睾丸、附睾、精囊腺、肾并称定质量,计算各脏器指数(脏器指数=脏器湿质量/体质量)。
2.5 各组大鼠睾丸、附睾、肾组织病理学观察
取“2.4”项下各组雄性大鼠的睾丸、附睾、肾组织适量,置于10%甲醛溶液中固定,脱水,石蜡包埋,切片(3~5 ?m),然后进行苏木精-伊红(HE)染色,在显微镜下观察上述组织的病理学变化。
2.6 各组大鼠肾组织中凋亡相关蛋白表达水平的检测
采用免疫组织化学法检测。取“2.5”项下各组雄性大鼠的肾组织切片,进行脱蜡,水化,抗原修复,以10%山羊血清封闭抗原,加入Bax、Caspase-3单克隆抗体和Bcl-2、Caspase-9多克隆抗体(稀释比例分别为1 ∶ 250、 1 ∶ 250、1 ∶ 500、1 ∶ 250),置于4 ℃条件下孵育18~24 h;以PBS洗涤2 min×3次,加入二抗(稀释比例为1 ∶ 2 000),室温孵育10 min;以PBS洗涤10 min×2次,二氨基联苯胺(DAB)显色,在显微镜下观察显色程度;以PBS洗涤5 min×3次,苏木精复染,1%盐酸中分化,自来水冲洗,乙醇梯度脱水,干燥,中性树脂封片。Aperio数字病理系统扫描切片并拍照,利用Image-Pro Plus 6.0软件分析阳性染色部分的光密度值,用来表示Bax、Bcl-2、Caspase-3、Caspase-9蛋白表达水平。
2.7 统计学方法
采用SPSS 17.0软件对数据进行统计分析。计量资料以x±s表示,多组间比较采用单因素方差分析,组间两两比较采用LSD检验。P<0.05表示差异有统计学意义。
3 结果
3.1 各组大鼠精子质量评价结果
与空白组比较,模型组雄性大鼠致雌鼠受孕率显著降低(P<0.01);与模型组比较,阳性组和TFA低、中、高剂量组雄性大鼠致雌鼠受孕率均显著升高(P<0.05或P<0.01)。各组大鼠精子质量评价结果见表1。
3.2 各組大鼠血清中性激素、氧化应激、肾功能相关指标检测结果
与空白组比较,模型组大鼠血清中E2、T、SOD、GSH-Px水平均显著降低(P<0.01),FSH、LH、MDA、Scr、 BUN水平均显著升高(P<0.01)。与模型组比较,阳性组和TFA中、高剂量组大鼠血清中E2、T、SOD、GSH-Px水平均显著升高(P<0.05或P<0.01),FSH、LH、MDA、Scr、BUN水平均显著降低(P<0.05或P<0.01);TFA低剂量组上述指标呈同样变化趋势,且大部分差异有统计学意义(P<0.05或P<0.01)。各组大鼠血清中相关指标检测结果见表2。
3.3 各组大鼠脏器指数的检测结果
与空白组比较,模型组大鼠肾指数显著升高(P<0.01),睾丸、附睾、精囊腺、胸腺指数均显著降低(P<0.01)。与模型组比较,阳性组和TFA低、中、高剂量组肾指数均显著降低(P<0.05或P<0.01),睾丸、附睾、精囊腺、胸腺指数均显著升高(P<0.05或P<0.01)。各组大鼠脏器指数的检测结果见表3。
3.4 各组大鼠睾丸、附睾、肾组织病理学观察结果
空白组大鼠睾丸组织生精小管基膜完整,生精细胞排列规则,血管丰富,间质细胞发育良好,近管腔处可见大量精子;附睾组织中附睾管排列紧密规则,管腔内精子含量丰富、分布均匀;肾组织中肾小管内无异物,肾单位清晰 。模型组大鼠睾丸组织生精小管直径变细,间距较宽,生精细胞排列紊乱,生精上皮变薄且层次和数量均减少;附睾组织中附睾管管壁增厚、排列疏松、间质增大,管腔增生萎缩、腔内精子聚集成团;肾组织中肾间质纤维增生,肾小管内可见大量黄色结晶,肾小管上皮细胞变性、坏死、呈灶状萎缩。阳性组和TFA低、中、高剂量组睾丸组织生精小管基膜和生精上皮变薄,生精细胞排列规则,少数生精上皮与基底部分离;附睾组织中附睾管管壁变薄、排列紧密,管腔内精子数量增多、分布均匀;肾组织中肾小管内结晶减少,上皮细胞萎缩、间质纤维化情况明显减少。各组大鼠睾丸、附睾、肾组织病理学观察结果见图1~图3。
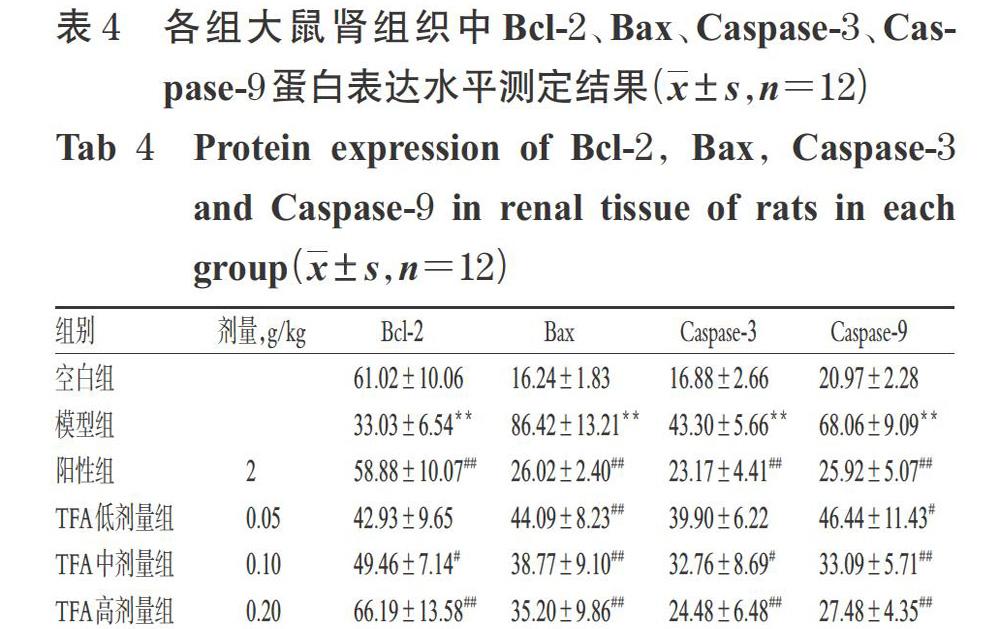
3.5 各组大鼠肾组织中Bcl-2、Bax、Caspase-3、Caspase-9蛋白表达水平测定结果
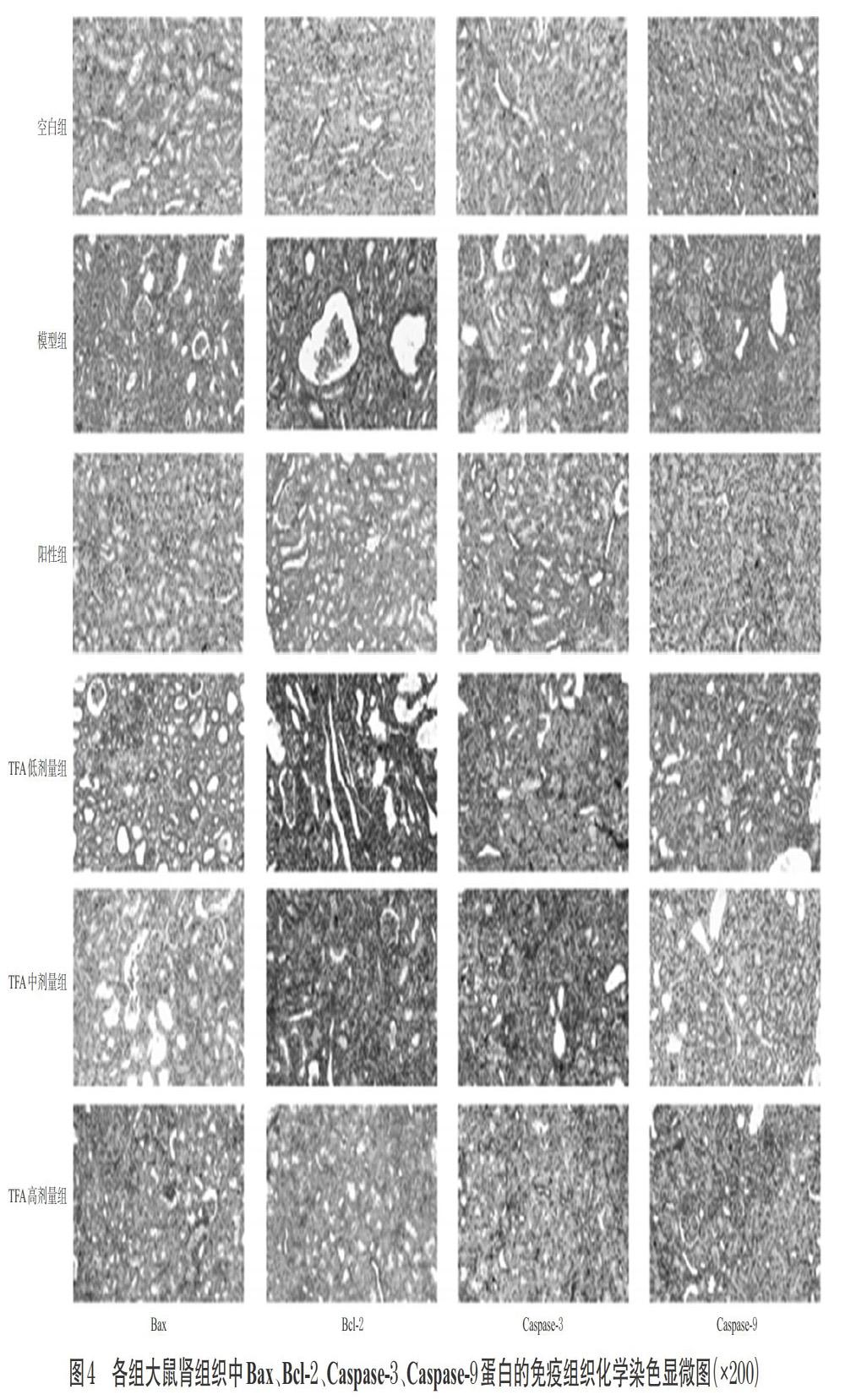
与空白组比较,模型组大鼠肾组织中Bcl-2蛋白表达水平显著降低(P<0.01),Bax、Caspase-3、Caspase-9蛋白表达水平均显著升高(P<0.01)。与模型组比较,阳性组和TFA中、高剂量组大鼠肾组织中Bcl-2蛋白表达水均显著升高(P<0.05或P<0.01),Bax、Caspase-3、Caspase-9蛋白表达水平均显著降低(P<0.05或P<0.01);TFA低剂量组上述指标呈同样变化趋势,且大部分差异有统计学意义(P<0.05或P<0.01)。各组大鼠肾组织中Bcl-2、Bax、Caspase-3、Caspase-9蛋白表达免疫组织化学染色显微图见图4,蛋白水平检测结果见表4。
4 讨论
目前对男性生殖功能障碍的治疗主要是通过药物进行干预,包括抗雌激素药物、抗氧化剂、左旋肉毒碱等,虽取得了一定疗效,但也存在一定副作用[12]。弱精子症属于中医“精少”“精薄”“精冷”等范畴,中药治疗多以补肾阳为主,如五子衍宗丸[由枸杞子、菟丝子(炒)、覆盆子、五味子(蒸)、车前子(盐炒)等5味中药组成]具有补肾益精的功效,临床主要用于男性肾虚精亏所致不育症[13],基于此,本研究选择其作为阳性药物。
相关研究发现,TFA对大鼠生殖功能障碍具有一定的改善作用[8],基于此,本研究通过灌胃腺嘌呤复制雄性大鼠生殖功能障碍模型,探讨TFA对其生殖功能障碍的改善作用及可能机制。
精子的发生、成熟及睾丸的生精功能均受到下丘脑-垂体-性腺轴的调节和控制,性腺轴分泌的 FSH、LH和T直接调节人体性功能与生殖功能,以维持整个生育期的动态平衡[14]。FSH是由垂体分泌并唯一作用于睾丸支持细胞的生殖激素,在男性成年期,FSH和抑制素B的分泌形成负反馈调节机制[15]。因此,血清中FSH水平高低可反映睾丸内支持细胞的成熟状态及其功能,当FSH水平高于正常机体水平时,提示睾丸支持细胞功能异常。睾丸细胞受损首先会导致睾丸支持细胞-生精小管小管嵌合体受损,从而介导血清FSH水平升高,使血清中LH水平随之代偿性升高,影响精子密度[16]。本研究结果显示,与空白组大鼠比较,模型组大鼠血清中FSH、LH水平升高,T水平降低,表明模型大鼠睾丸细胞受损;当给予五子衍宗丸和TFA后发现,大鼠血清中FSH、LH水平降低,T水平升高,提示TFA对生殖障碍模型大鼠睾丸受损及性激素紊乱具有一定干预作用。
氧化还原系统动态平衡调控对精子的产生和男性生育力维持具有重要的调控作用,精原干细胞的自我更新需要活性氧(ROS)来维持,二倍体的精原细胞分化为单倍体精子细胞的过程也需要一定浓度的ROS[17]。当机体内ROS堆积时,会增加氧自由基含量,产生各种毒性作用,从而损害精子质膜,导致精子质量下降[18]。SOD水平的高低可反映机体清除氧自由基的能力,而MDA水平的高低又反映了机体细胞受氧自由基攻击的严重程度;GSH-Px是抗氧化酶类,为ROS的清除提供还原力,保护细胞免受伤害[19-20]。因此,检测生殖障碍模型大鼠血清中SOD、GSH-Px及MDA水平具有一定的意义。本研究结果显示,与空白组比较,模型组大鼠血清中SOD、GSH-Px水平均显著降低,MDA水平显著升高,表明模型组大鼠抗氧化能力下降;当给予五子衍宗丸和TFA后发现,大鼠血清中SOD、GSH-Px水平显著升高,MDA水平显著降低,提示TFA可能通过增加机体抗氧化能力,改善生殖障碍模型大鼠的生精功能。
ROS大量产生还会增加正常组织细胞损伤及细胞凋亡的风险[21]。本研究通过检测细胞凋亡相关蛋白,探讨TFA对生殖障碍模型大鼠肾组织的改善作用。Bcl-2與Bax是最早被发现参与细胞凋亡的正负调节因子,Bcl-2是抑制细胞凋亡因子,Bax是促进细胞凋亡因子[22]。Caspase是细胞凋亡的核心,在死亡受体(Fas、DR4和DR5等) 介导的细胞凋亡途径即外源性激活途径中,其效应物Caspase-3被激活后将产生生物效应。目前普遍认为Caspase-9是凋亡的启动子,是线粒体凋亡途径的关键蛋白酶,处于Caspase“瀑布式”激活链的顶端,而Caspase-3是凋亡的主要执行者[23]。本研究结果显示,TFA中、高剂量组大鼠Bax、Caspase-3、Caspase-9蛋白表达水平显著降低,Bcl-2蛋白表达水平显著升高,表明TFA可能通过调节凋亡蛋白表达,从而改善肾损伤。
睾丸是产生精子和分泌生殖激素的重要器官,附睾的主要功能是存储精子并促进其功能成熟。本研究通过病理学观察发现,模型组大鼠睾丸生精上皮变薄,生精细胞排列紊乱、层次和数量均减少; 附睾管管壁增厚、排列疏松,管腔增生萎缩,管腔内精子聚集成团,由此推测雄性大鼠性激素的紊乱可能与睾丸、附睾病变有关。经TFA干预后,以上病理变化均有所改善,表明TFA可减轻雄性大鼠生殖功能损伤。相关研究发现,生殖障碍患者多伴随肾组织病理损伤,表现出肾功能不全[24]。本研究也发现,模型组雄性大鼠肾组织出现大量棕黄色结晶;同时,肾功能指标检测结果显示,模型组大鼠血清中Scr、BUN水平也显著升高。经TFA干预后,大鼠肾组织病理损伤有所改善,血清中Scr、BUN水平显著降低,表明TFA可明显减轻大鼠肾组织病理学变化。
综上所述,TFA对雄性大鼠生殖功能障碍具有一定的改善作用,其机制可能与降低性激素FSH、LH水平和下调肾组织中凋亡相关蛋白表达,升高性激素T、E2水平和改善机体氧化应激水平有关。
参考文献
[ 1 ] ESTEVES SC,HAMADA A,KONDRAY V,et al. What every gynecologist should know about male infertility:an update[J]. Arch Gynecol Obstet,2012,286(1):217-229.
[ 2 ] 吴艳婷,刘敏,金志春,等.中医药治疗少弱精子症研究进展[J].中西医结合研究,2017,9(4):213-216、218.
[ 3 ] 郭雪华,郑连文.弱精子症的研究进展[J].中国男科学杂志,2008,22(6):54-56.
[ 4 ] 张艳,沈楠,齐玲,等.五味子多糖对环磷酰胺致生精障碍大鼠的治疗作用及对生殖激素的影响[J].中国中西医结合杂志,2013,33(3):361-364.
[ 5 ] 毕焕洲,徐世杰.微波辐射性雄小鼠生殖功能障碍的中医证候研究[J].中国性科学,2015,24(5):68-74.
[ 6 ] 国家药典委员会.中华人民共和国药典:一部[S]. 2015年版.北京:中国医药科技出版社,2015:183.
[ 7 ] 许梦莹,郭日新,张晓,等.沙苑子化学成分研究[J].中国中药杂志,2018,43(7):1459-1466.
[ 8 ] 陈勤.沙苑子总黄酮对酗酒模型小鼠生精功能和DNA损伤的影响[C]//中国药理学会第八届全国生殖药理学术研讨会论文汇编.北京:中国药理学会生殖药理学专业委员会,2013:27.
[ 9 ] 李程锦,李明鹏,张东阳,等.沙苑子总黄酮对去势大鼠骨质疏松模型血清钙、血清磷、骨代谢及生物力学特征的影响[J].中医学报,2020,35(2):1-5.
[10] 黄丽辉,黄日荷,鄧丽萍,等.金匮肾气丸对比生精胶囊治疗行为干预下少弱精子症的临床观察[J].中国药房,2016,27(30):4230-4232.
[11] 童骏峰,徐志伟,杨元宵,等.腺嘌呤与氢化可的松所致大鼠肾阳虚证模型比较研究[J].中华中医药杂志,2015,30(11):3901-3904.
[12] 刘绍明,张岳阳,郭军,等.现代医学对弱精子症的研究概况[J].中国性科学,2018,27(11):5-8.
[13] 王慧慧,张莉,徐瑞豪,等.杜仲补天素胶囊对白消安诱导的生精障碍小鼠的影响[J].中药新药与临床药理,2020,31(2):169-178.
[14] 张盼盼,刘凤霞,阿地力江·伊明,等.少弱精症动物模型建立的研究进展[J].新疆医科大学学报,2014,37(8):974-976、980.
[15] 王彬,马健雄,马凰富,等.左归丸对少弱精子症大鼠模型生殖内分泌激素的作用研究[J].中国性科学,2017,26(11):78-81.
[16] 丁劲,张耀圣,商建伟,等.益肾健脾方对少弱精子症小鼠模型睾丸生精功能和血清性激素水平的影响[J].环球中医药,2016,9(11):1310-1314.
[17] CONRAD M,INGOLD I,BUDAY K,et al. ROS,thiols and thiol-regulating systems in male gametogenesis[J]. Biochim Biophys Acta,2015,1850(8):1566-1574.
[18] 张开舒,周芳,安琪,等.麒麟丸对少弱精子症模型雄性大鼠生殖功能的保护作用研究[J].中华男科学杂志,2017,23(9):821-827.
[19] 耿强,欧阳斌,郭军,等.加味天雄散对少弱精子症模型大鼠附睾氧化损伤的保护作用[J].中国中医基础医学杂志,2016,22(1):122-124.
[20] 林俊卿,黄蔷如,王弼思,等.槲皮素对HaCat细胞增殖及β-防御素和谷胱甘肽过氧化物酶表达的影响[J].中国病原生物学杂志,2017,12(12) :1161-1164.
[21] 周茜,杨林,张文静,等.薯蓣皂苷元对少弱精子症小鼠精子质量和生殖系统氧化应激损伤的影响[J].湖北文理学院学报,2017,38(5):85-88.
[22] 董雅洁,高维娟. Bcl-2、Bax、Caspase-3在细胞凋亡中的作用及其关系[J].中国老年学杂志,2012,32(21):4828- 4830.
[23] 范春玲,胡丹,兰明慧,等.牛化脓隐秘杆菌病肾脏Caspase-3、Caspase-8、Caspase-9、Bax和Bcl-2的表达[J].中国兽医学报,2017,37(12):2266-2269、2274.
[24] 刘芳.真武汤对肾阳虚肾衰模型大鼠肾组织AQP1表达影响研究[D].沈阳:辽宁中医药大学,2010.
(收稿日期:2020-04-07 修回日期:2020-05-13)
(编辑:唐晓莲)
