稀释液和稀释比例对番鸭精子活率、质膜完整率和受精率的影响
2020-08-16段元彬刘小林江中良张慧林
段元彬,刘小林*,江中良,张慧林,陈 强
(1.西北农林科技大学动物科技学院,陕西咸阳 712100;2.陕西安大农业发展有限公司,陕西渭南 714300)
在人工授精前,通常需要用不同稀释液对精液进行一定比例的稀释。Lake等[1]通过对鸡精液的成分分析,首次配制了一种鸡的精液稀释液(Lake氏液)。谷氨酸钠对精子的保护作用也被证实,柠檬酸钠和柠檬酸钾同样能够延长精子保存时间[2]。杨保田等[3]研究发现柠檬酸钠溶液能有效提高鸡精子的生存指数。糖(葡萄糖、果糖)等能源物质是精子在体外保存不可缺少的部分。苏东顿等[4]研究证明果糖能提高精液的受精力。黄仁术[5]试验证明果糖保存精液的效果优于葡糖糖和蔗糖。
番鸭作为优良的瘦肉型鸭,具有生长迅速、耐粗饲、产肝性能好等特点[6-7]。现代化番鸭养殖基地普遍采用人工授精结合笼养的饲养管理方式。人工授精在鸡上的研究比较成熟,但在番鸭精液稀释液配方上的进展较少[8],生理盐水仍然是许多番鸭养殖企业的常用稀释液,但其受精率低下;同时生产实践中也常出现因精液采集过量而造成浪费。本实验旨在研究常温下不同稀释液和稀释比例对番鸭精子活率的影响,确定最佳稀释液和稀释比例,从而为番鸭人工授精技术提供指导,为番鸭人工授精前精液稀释提供参考依据。
1 材料与方法
1.1 实验动物 实验选择陕西省渭南市潼关县留果安大番鸭养殖基地的40周龄黑羽公番鸭8羽和1 080羽产蛋期黑羽母番鸭。实验公鸭按饲养管理规程自由采食饮水,实验前进行为期1周的采精训练,每隔1 d采精1次。
1.2 试剂和仪器 葡萄糖、果糖、超纯水、青霉素、链霉素等所有化学药品均来自Solarbio。实验仪器包括显微镜、恒温箱、水浴锅、移液枪、采精杯、集精杯、1 mL注射器、容量瓶、计数器以及血细胞计数板等。
1.3 稀释液配制 按配方配制NO-1稀释液、NO-2稀释液和BJJX稀释液作为精液稀释液,以生理盐水作为对照,灭菌冷却4℃冷藏备用。稀释液成分见表1。
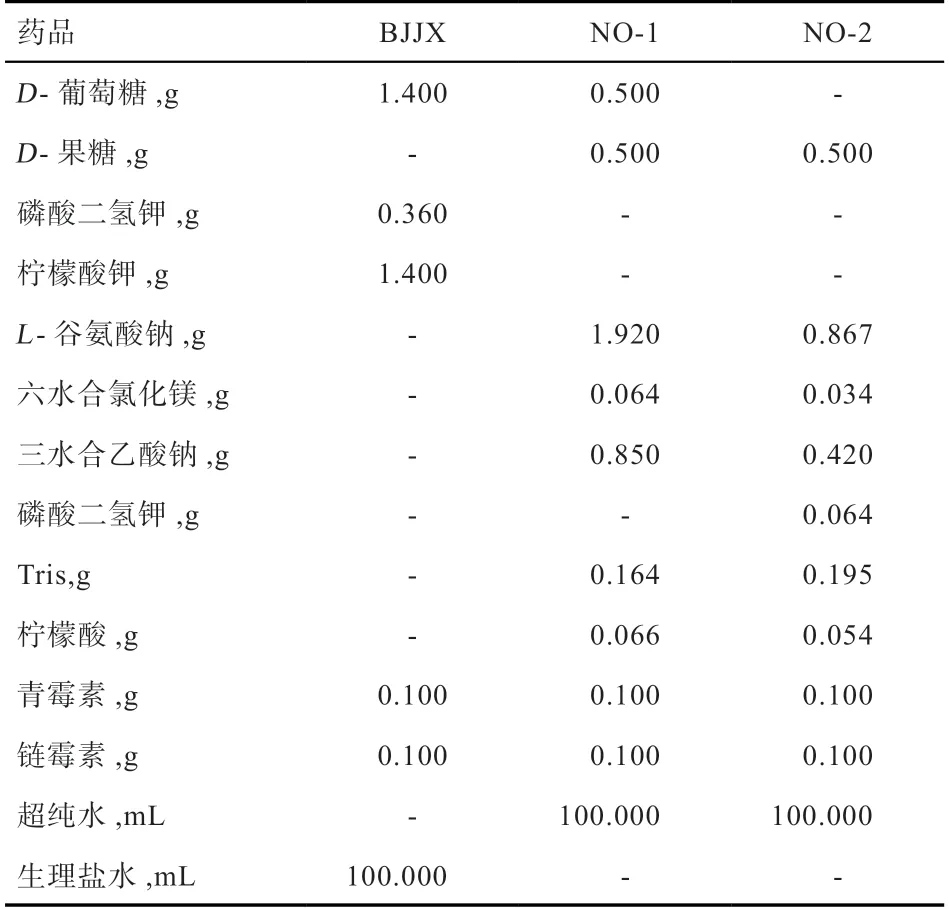
表1 稀释液主要成分
1.4 精液采集 用于实验的种公番鸭在采精前剪掉泄殖腔周围的羽毛,以免影响采精,于早09:30左右采精。采用按摩和母鸭诱情结合法采集8羽40周龄的黑羽公番鸭精液,待种公番鸭勃起有射精反应时,左手持采精杯,用右手按压种公番鸭生殖器外的泄殖腔收集精液,同时注意防止血液、羽毛或粪便混入精液,隔天采集1次。
1.5 精液鉴定与处理 用标准方法测定每次采集精液的精子浓度和运动能力。选用优质精液(珍珠白,无泄殖腔产物污染,体积大于0.2 mL,精子活率大于0.7,精子浓度大于1×109精子/mL)。将精液分成4等份,用NO-1稀释液、NO-2稀释液、BJJX稀释液和生理盐水按精液∶稀释液体积比1:1、1:2、2:1(v/v)分别稀释于2 mL无菌离心管中,17℃恒温箱恒温保存。每隔8 h对各组精子活率进行测定,直至精子全部死亡为止。本实验共持续2个月。
1.6 精子活率的评估 采用标准主观评分法评估精子运动能力。将稀释至2×108/mL精子浓度的1滴精液,滴加在预热至37℃的载玻片和盖玻片之间,并在400×显微镜下观察。计量视野中前进运动精子的比例,至少统计200个精子。所有的观察分析都由同一个人完成。
1.7 精子质膜完整性的评估 采用低渗肿胀试验评估质膜完整性,质膜完整精子表现为尾部弯曲或肿胀。低渗溶液为柠檬酸钠0.735 g、果糖1.35 g、蒸馏水100 mL[9]。取10 μL稀释精液和1 mL低渗溶液于离心管中,37℃孵育30 min,并在400×显微镜下观察。每个载玻片至少观察到200个精子,计数尾部弯曲肿胀精子数比例。实验重复3次。
1.8 人工授精 将采集自经过选育的8羽优良黑羽公番鸭的新鲜精液混合,分成4个等份;以NO-1、N0-2、BJJX、生理盐水分别以精液:稀释液体积比1:1稀释,以生理盐水为对照组,稀释后马上输精。对同一批1 080只40周龄黑羽产蛋母番鸭进行人工授精,于捡蛋后10:00左右输精,每5 d输精1次,每次输精0.1 mL,单次采精输精在1 h内完成。授精后第2天收集合格种蛋。统计4组受精率并分析其差异,人工授精实验共持续3月左右。
1.9 统计分析 用Excel 2019软件对试验数据进行处理,采用SPSS 20.0软件进行统计分析。用ANOVA和Tukey's进行差异显著性检验。所得结果以平均值±标准差表示,所有试验重复3次。
2 结果
2.1 不同稀释比例的稀释液对精子活率的影响 经测定,新鲜精液精子活率0.91。如表2所示,所有稀释液组的精子活率都随着保存时间的延长而明显下降。稀释比例为1:1时,NO-1、NO-2、BJJX组精子活率于24 h出现明显下降,对照组于16 h后出现显著下降;稀释比例为1:2时,NO-1、BJJX组精子活率于24 h出现明显下降,2组在8 h,对照组于16 h后出现显著下降;稀释比例为2:1时,NO-1、NO-2、BJJX、对照组精子活率于16 h明显下降。3种稀释比例下精液以NO-1稀释液稀释保存24 h,精子活率过低,不适于输精;精液以NO-2稀释液在1:1和2:1比例下稀释保存16 h后不适于输精,1:2比例下8 h不适用输精;BJJX在16 h不适于受精;生理盐水在1:1~1:2比例下保存16 h,在2:1比例保存8 h后不适用于输精。
结果显示,保存后期,实验组精子活率高于生理盐水组,精子受精能力的维持时间更长。

表2 稀释液类型和稀释比例对精子活率的影响
2.2 不同稀释比例的稀释液对精子质膜完整率的影响经测定,新鲜精液质膜完整率0.92。由表3可见,在3个稀释比例下,各组质膜完整率都随保存时间的延长而不断下降。各组的精子质膜完整率差异不显著。
2.3 NO-1、NO-2和BJJX 3种稀释液对受精率的影响由表4可见,与生理盐水相比,3种稀释液受精率均极显著提高。NO-1稀释液的受精率最高,极显著高于NO-2稀释液,同时NO-1和BJJX组种蛋合格率显著高于生理盐水对照组。
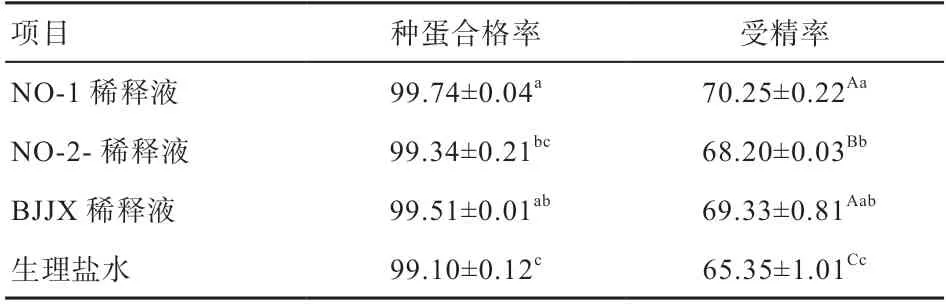
表4 稀释液对受精率的影响 %
3 讨论
3.1 稀释比例对精子活率的影响 精子活率是评价精子授精潜力的重要指标。精液稀释比例对保存期间的精子活率具有很大影响。精液稀释可以大幅提高番鸭精液利用率,充分发挥公鸭的繁殖潜力,降低精浆中精子的粘滞性,防止精子的提前活化。本实验中相比于1:1和1:2比例,稀释比例为2:1时,保存后期精子活率更低。这主要是由于较低的稀释比例往往造成精浆-稀释液中精子密度过大,精子代谢产物积累过快[10],同时会造成精浆-稀释液中能源物质如糖的快速消耗,造成精子保存时间短,不利于精子运动能力的长久保持。本实验中,NO-2组精液随稀释比例的增大而表现出保存质量的下降,随精子稀释比例的增大,精浆中糖类等营养物质及缓冲物质浓度会随之下降[11-12],对精子的保护缓冲作用降低。稀释液添加会通过改变精子密度从而明显影响精液保存质量,包括精子活率和质膜完整率[13-14]。因此,具体稀释比例需要根据鲜精精子活率和精子密度而决定。
本实验中,在各个稀释比例下,NO-1与BJJX稀释液的精子活率高于NO-2和生理盐水,这与NO-1与BJJX中高含量的单糖有关,较高含量的糖保证保存期间精子的代谢消耗,延长精子保存时间。
3.2 稀释液对精子活率和受精率的影响 稀释液的稀释效果与稀释液组分密切相关[15]。合理的稀释液配方对精浆-稀释液中精子运动能力的维持、形态稳定以及精子代谢的正常进行具有非常重要的作用[16-17]。本研究中,在相同稀释比例下,NO-1稀释液较其余3组精子活率更高,这与NO-1稀释液组分有关。有研究表明,相同稀释介质下果糖的稀释效果要优于葡萄糖[18];高含量的谷氨酸钠则为精子膜的完整性提供保障,延缓精子膜的损伤性变化,降低精子畸形的发生[19];同时Tris的添加有效缓冲了因精子代谢造成的精浆-稀释液理化性的恶化(如pH下降)[20],对精液保存起到有效的缓冲作用。NO-2稀释液的精子活率低于BJJX稀释液,可能是由于NO-2稀释液组分中单糖含量过低,单糖作为能源物质是稀释液的重要组分,单糖含量太少,不足以支撑精子细胞长期代谢的能量消耗。
保证单位体积精浆-稀释液中含有足够的活性精子数可获得更高的受精率,因此在相同比例下,更高精子活率、更长保存时间的NO-1稀释液表现为更高的受精率。
3.3 稀释液和稀释比例对质膜完整性的影响 精子质膜作为精子细胞与外界环境的屏障,控制精子与外界环境的物质交换,也是保存期间精子细胞最容易遭受损伤的部位。因此,检测评估保存期间的精子膜完整性具有非常重要的意义。本实验中,各组精子质膜完整率均随保存时间的延长而降低。精液保存过程中,精浆中精子代谢产物不断积累,使精子保存环境的理化性质恶化,以及精浆中活性氧的积累均会对精子膜造成损伤,从而最终导致实验组与对照组精子质膜完整性的不断下降。此外,糖尤其是果糖作为能量和必需氨基酸的重要来源,在精子细胞膜破裂损伤过程中起着重要的作用[21]。而随着稀释液中单糖不断消耗,导致保存后期稀释液的保护作用降低,精子膜损伤增加。各实验组之间质膜完整性差异不显著,可能是由于实验组和对照组渗透压与精子细胞接近等渗。
4 结论
稀释液的稀释效果与稀释比例以及稀释液本身的组分有很大关系。番鸭精液在保存或授精前应选用恰当配方的稀释液适当稀释,精液与稀释比例适宜在1:1~1:2。本实验中NO-1稀释液是番鸭精液人工授精稀释和在17℃下短期保存的最佳稀释液,通过提供精子外源能量和保证精子能量代谢所必需的适宜环境,延长精子保存时间。
