医用口罩质量控制与应急管理
2020-08-15李宝林
李宝林
河北省药品医疗器械检验研究院,河北石家庄 050200
当前市场上的口罩种类繁多,随着不同形式的民用、医用以及进口口罩的供应,在适用范围方面也出现了一些偏离。不规范的产品名称、规格表述,也给使用者带来识别、选择的困惑,在当前防疫中也出现了不合理的推介、使用现象。货源紧缺也使新制造商建线投产的积极性得到鼓励。认识医疗器械管理的医用口罩的种类、适用范围、性能指标以及生产监管基本要求,了解目前生产与需求面临的实际情况,以加强医用口罩的质量管理,促进其有序发展、保障市场供应。
1 口罩和医用口罩
1.1 口罩类型
1.1.1 按原理分类 面罩/口罩按工作原理可分为供气式、空气过滤式。供气式是指将气源通过(如空压机、压缩气瓶)动力装置,经管路、面罩送到面部供呼吸,通常加工为面罩的形式,可用于低氧环境下。空气过滤式是指气体通过滤料过滤后再被吸入/呼出,通常可以面罩、口罩的形式提供,只适用于供氧充足的环境中(如氧气浓度大于18%)佩戴。
1.1.2 按结构分类 根据覆盖面部的范围,面罩分为如半面型(覆盖口鼻)、全面型(覆盖口、鼻和眼睛);根据结构半面型面罩又分为免保养型(滤材不可更换)、保养型(部件可换,须保养)。
1.1.3 自吸过滤式口罩 在日常环境中使用的口罩和医用口罩为自吸过滤式半面型口罩,即利用自主呼吸克服过滤材料两侧压力差的口罩。
1.2 结构形式
1.2.1 佩戴方式 口罩按照佩戴方式可分为耳挂式、绑带式或头带式。
1.2.2 外形 常用过滤式口罩按照口罩体形状可分为平面式、平面折叠式、折叠式、有腔式(杯罩式、鸭嘴式、猪拱式)等。医用口罩多采用平面折叠式、折叠式。
1.2.3 结构组成 医用口罩通常由口罩带、鼻夹、口罩体组成;口罩带常采用绑带或弹性耳挂带;鼻夹位于口罩上部夹层中;口罩体采用多层非织造布组合的形式,从结构设计上能够覆盖口、鼻、下颌部位,并保证与佩戴者面部良好贴合。
1.3 医用口罩材料要求
1.3.1 耳带 口罩带通常采用弹性耳带、非织造布绑带等,要求有一定的固定强度和牢固度,以便于摘戴并保障与佩戴者面部具有良好的密合性能。
1.3.2 鼻夹 鼻夹可采用金属条、复合材料制成,如铝塑条。要求既具有一定的可塑性又有一定的强度,起定形作用以保证密合性能。
1.3.3 口罩体 口罩体通常使用不同性能的非织造布(也称无纺布)加工,如聚丙烯非制造布、熔喷聚丙烯非制造布。医用口罩既要有一定的阻隔性能、密合性能,又要保障通气顺畅,对口罩体加工材料的选择应重点考虑材料的阻隔、过滤性能以及工艺要求。外层通常要求具有一定的阻水或阻隔液体的性能,主要阻隔外来的颗粒、液滴、飞沫、血液、飞溅物等,如抗液体穿透能力。内层贴合佩戴者面部(口、鼻、下颌),用于过滤佩戴者呼出的气体及其携带物;为了便于识别和区分内层、外层,外层通常采用有色材料,如蓝色、绿色。中间层为过滤层,是基本性能的保障层,通常采用一层或多层不同材质、不同性能的组合材料和(或)复合非织造布,如熔喷非制造布,要求应具有一定阻隔能力和过滤性能,如颗粒过滤效率、细菌过滤效率、通气阻力等。
1.3.4 关键材料与性能 口罩体中层材料是发挥过滤效率的关键,主要通过碰撞沉积、筛滤截留、静电吸附等原理起作用。若仅依靠机械作用无法兼顾过滤效率和通气性能,静电效应可显著增强材料的过滤效率,如经驻极化工艺处理过的熔喷聚丙烯驻极体非织造材料。医用口罩所用材料除应满足其物理强度、过滤性能、通气性能等基本要求外,还必须经生物相容性评价,选用对人体无刺激性、无致敏性的材料。此外,医用口罩材料的选择应满足加工工艺的要求,而对材料固有性能不能有显著影响,如对灭菌加工的耐受性能,以保证医用口罩的有效性。
2 质量要求
2.1 防颗粒物呼吸面罩/口罩
2.1.1 适用范围 在市场上常出现被多种修饰词命名的口罩。执行标准为《呼吸防护自吸过滤式防颗粒物呼吸器》GB 2626-2006[1],适用于阻隔颗粒物的呼吸防护;不适用于有害气体、蒸汽、缺氧环境、水下作业、逃生、消防的呼吸防护。
2.1.2 分类 按过滤类别分为KN和KP两类,KN类适用于过滤非油性颗粒物,KP类适用于过滤油性和非油性颗粒物,按过滤级别又分为90、95、100;如随弃式面罩、可调换式半面罩分为KN90、KN95、KN100,KP90、KP95、KP100;全面罩 KN95、KN100,KP95、KP100;其标记方式如:GB 2626-2006KN95。
2.1.3 主要技术指标 过滤效率KN90/KP90≥90.0%,KN95/KP95≥ 95.0%,KN100/KP100≥ 99.97%;总吸气阻力≤350Pa,总呼气阻力≤250Pa;气密性≤100Pa;此外规定了死腔、清洗消毒、镜片、视野、泄漏率、连接件等要求。
2.1.4 新标准要求 其修订版GB 2626-2019[2]将于2020-07-01实施。按类别调整了呼吸阻力等技术要求,如随弃式无呼吸阀面罩的吸气、呼气阻力:KN90/KP90 ≤ 170Pa,KN95/KP95≤ 210Pa,KN100/KP100≤250Pa;增加了适用性指标,即在模拟条件下检验口罩的基本要求和镜片的要求。
2.2 日常用口罩/普通口罩
2.2.1 适用范围 为日常生活用口罩,能安全牢固地护住口鼻,便于摘戴。执行标准《日常防护型口罩技术规范》GB/T 32610-2016[3],适用于日常生活中空气污染环境下滤除颗粒物,不适用于缺氧环境、水下作业、逃生、消防、医用、工业防尘,不适用于婴幼儿、儿童呼吸防护。
2.2.2 分类 按防护效果由高至低的次序分为A级、B级、C级、D级,各级别口罩在相对应的空气污染环境下应能使可吸入的颗粒物(PM2.5)浓度降低至≤75μg/m3。
2.2.3 主要技术指标 吸气阻力≤175Pa,呼气阻力≤145Pa;(盐性介质)过滤效率Ⅰ级≥99%,Ⅱ级≥95%,Ⅲ级≥90%,(油性介质)过滤效率Ⅰ级≥99%,Ⅱ级≥95%,Ⅲ级≥80%;防护效果A级≥90%,B级≥85%,C级≥75%,D级≥65%;A级口罩过滤效率应达到Ⅱ级及以上,B级、C级、D级口罩过滤效率应达到Ⅲ级及以上。此外,口罩下方视野等指标。
2.3 一次性使用医用口罩
2.3.1 适用范围 佩戴好后应能罩住佩戴者的鼻、口至下颌,一次性使用。执行标准《一次性使用医用口罩》YY 0969-2013[4],用于普通医疗环境中佩戴、阻隔口腔和鼻腔呼出或喷出污染物,不适用于医用防护口罩、医用外科口罩。
2.3.2 主要性能指标 细菌过滤效率≥95%;两侧面气体交换的通气阻力≤49Pa/cm2;控制微生物限度或无菌要求。
2.4 医用外科口罩
2.4.1 适用范围 佩戴好后能罩住佩戴者的鼻、口至下颌,一次性使用。执行标准《医用外科口罩》YY 0469-2011[5],适用于临床医务人员在有创操作过程中佩戴。
2.4.2 主要性能指标 口罩两侧面气体交换压力差≤49Pa;微生物限度或无菌要求;阻燃性能5s;细菌过滤效率≥95%,颗粒过滤效率(对非油性颗粒)≥30%;合成血液穿透:不应出现渗透。
2.5 医用防护口罩
2.5.1 适用范围 我国医用防护口罩标准于2003-04-29首次发布并实施,现行标准为《医用防护口罩技术要求》GB 19083-2010[6],适用于在医疗工作环境下佩戴,过滤空气中颗粒物,阻隔飞沫、血液、体液、分泌物等自吸过滤式医用防护口罩。
2.5.2 结构分类 佩戴好后覆盖佩戴者的口鼻部,应有良好的面部密合性,不应有呼吸阀。按过滤效率分为 1、2、3 级。
2.5.3 主要技术指标 过滤效率(对非油性颗粒):1级≥95%,2级≥99%,3级≥99.97%;吸气阻力≤343.2Pa;表面抗湿性3级;微生物限度或无菌要求;合成血液穿透:不应出现渗透;适合因数≥100。
2.6 其他医用口罩
2.6.1 国外口罩标准 欧盟《医用口罩要求和试验方法》EN 14683:2014[7],适用于在手术室和其他医疗机构的手术过程中,主要用于保护患者不受感染,保护佩戴者免受潜在污染液体侵害。
2.6.2 分类及性能指标 按细菌过滤效率分为Ⅰ、Ⅱ型,Ⅱ型又按阻隔飞溅能力分ⅡR型。主要性能指标:细菌过滤效率Ⅰ型≥95%,Ⅱ型≥98%,ⅡR型≥98%;压力差Ⅰ型/Ⅱ型<29.4Pa/cm2,ⅡR型<49.0Pa/cm2;穿透阻力Ⅰ型/Ⅱ型/ⅡR型≥16.0kPa;微生物限度≤30cfu/g。修订版EN 14683:2019+AC:2019[8]标准按不同类型修订了压力差指标,Ⅰ型/Ⅱ型<40Pa/cm2,ⅡR型<60Pa/cm2。
2.6.3 其他说明 不同国家和地区根据各自的实情进行管理,从适用范围、使用要求、性能控制、生产承诺方面可能多有不同,此处不作对比。
2.7 医用口罩主要性能异同
2.7.1 通气阻力 一次性使用医用口罩两侧面气体交换的通气阻力≤49Pa/cm2,医用外科口罩两侧面气体交换的压力差≤49Pa;采用的测试方法相同,取样面积均为直径25mm,二者控制要求相同,表述不同。医用防护口罩由于使用环境广,阻隔、密合性要求较高,考虑所用过滤材料的特性,气流阻力在气流流量(85±2)L/min条件下测试,吸气阻力≤343.2Pa。
2.7.2 过滤效率 一次性使用医用口罩、医用外科口罩的细菌过滤效率相同,医用口罩可能接触的颗粒物多为中性,过滤效率仅针对非油性颗粒(盐性介质,如NaCl);医用外科口罩在手术室中使用,操作空间有一定的洁净度要求,颗粒过滤效率在气流流量(30±2)L/min条件下测试,≥30%;医用防护口罩应用范围较广,过滤效率采用在气流流量(85±2)L/min条件下测试,按级别要求1级≥95%,2级≥99%,3级≥99.97%。
2.7.3 合成血液穿透 用于评价当医护人员脸部暴露于可传播疾病的血液或体液情况下的阻隔能力。医用防护口罩在测试中采用10.7kPa的喷射压力,医用外科口罩采用16.0kPa的喷射压力,显然医用外科口罩用于有创操作,选择了正常血压的高值压力进行测试。医用防护口罩要求与面部较好地密合,适合因数≥100。
2.7.4 微生物指标 我国3种医用口罩均控制微生物限度,标识“无菌”的产品需要无菌检验,此前上市供应的医用口罩极少没有“无菌”标识的。EN 14683标准中不同型号的口罩只规定了微生物限度,没有提出无菌检验要求。不同类别口罩技术指标的比较见表1 ~ 2。
3 医用口罩的管理要求
3.1 分类管理
3.1.1 非医用管理 在我国,日常防护型口罩、防颗粒物口罩为非医用防护用品,不作为医疗器械管理。市场上常用的棉布口罩、脱脂棉纱布口罩也未列入医疗器械管理范畴。
3.1.2 医疗器械管理 目前,我国按医疗器械管理的口罩有一次性使用医用口罩、医用外科口罩、医用防护口罩3种,均按第二类医疗器械管理。
3.1.2.1 医用口罩/一次性使用医用口罩 由口罩体、鼻夹和口罩带组成。产品经灭菌,以无菌形式提供,一次性使用。适用于患者及医务人员,阻隔血液、体液和飞溅物。归属类别14-13-04,即注输、护理和防护器械中的手术室感染控制用品。
3.1.2.2 医用外科口罩/一次性使用医用外科口罩 由口罩体、鼻夹和口罩带组成。以无菌形式提供,一次性使用。供临床医务人员在有创操作过程中佩戴,为防止体液、颗粒物、微生物等的直接透过提供物理屏障。产品性能指标可采用YY 0469标准。归属类别14-13-04,即注输、护理和防护器械中的手术室感染控制用品。
3.1.2.3 医用防护口罩 由口罩体、鼻夹、口罩带组成。供在医疗工作环境下,过滤空气中的颗粒物、阻隔飞沫、血液、体液、分泌物等。产品性能指标可采用GB 19083标准。归属类别14-14-01,即注输、护理和防护器械中的医护人员防护用品。
3.2 医用口罩注册要求
3.2.1 注册查询 作为医疗器械管理的医用口罩,须按照《医疗器械监督管理条例》[9]《医疗器械注册管理办法》[10]规定经药品监管部门注册,须取得医疗器械注册证和医疗器械生产许可证方可生产、销售。已注册的医用口罩可于国家药品监督管理局网站(http://www.nmpa.gov.cn)查询相关注册人、注册证编号、型号规格、组成、适用范围等信息。
3.2.2 注册证号 医用口罩注册证编号方式为:(省市简称)+械注准+年号(4位)+管理类别(2)+分类编码(“64”或“14”)+序号(4位);当前的分类编码为14(手术室感染控制用品),例如:京械注准2019214****。2017-08-31,原食品药品监管总局发布医疗器械新分类目录[11],自2018-08-01实施,此前批准的医用口罩注册证上的分类编码为64(手术用品),例如:沪械注准2017264****。
3.2.3 执行标准 在我国上市的医疗器械应符合经注册核准的产品技术要求(其编号与产品注册证编号相同)。申请上述医用口罩注册应提交医疗器械产品技术要求,主要包括医用口罩的性能指标和检验方法。
3.3 生产管理要求
3.3.1 管理体系 生产医用口罩应当建立与研制、生产有关的医疗器械生产质量管理体系,保持有效运行,以保证医用口罩符合强制性标准和经注册的医疗器械产品技术要求。
3.3.2 工艺控制 制造商应按注册管理办法和《医疗器械生产质量管理规范》[12]要求明确生产工艺的关键工序、特殊过程,特殊过程须进行确认,并保存确认方案、确认方法、操作人员、结果评价、再确认等实施记录;对设计和开发的更改应进行识别,必要时进行评审、验证和确认。灭菌工艺属于特殊过程,《医疗器械生产质量管理规范附录无菌医疗器械》[13]要求评价灭菌工艺与所生产产品的适宜性,明确灭菌方法、工艺参数和无菌保证水平,提供灭菌确认报告。产品、灭菌设备、工艺参数等发生变化应对灭菌过程进行再确认。
3.3.2.1 工艺与生产环境 医用口罩生产工艺通常包括裁切、折叠、缝制、装鼻夹、上耳带、内包装、外包装、灭菌/解析。医用口罩通常在洁净室内生产,如裁切、折叠、缝制、装鼻夹、上耳带、内包装等工序。
3.3.2.2 工艺特点 缝制、装鼻夹、上耳带等工艺常采用超声波热合、缝纫等方式。其中超声波热合工艺易于机械化,可达到较高自动化水平,实现一体化生产。
3.3.2.3 灭菌控制 灭菌工艺需根据是否提供无菌上市产品而定,标识无菌的医用口罩需采用经过确认的灭菌工艺加工。目前绝大多数采用环氧乙烷熏蒸法灭菌,此工艺中环氧乙烷剂量、温度、湿度、真空度、作用时间、样品量和装载方式是影响灭菌效果的主要因素[14],需要对这些工艺参数进行验证、确认并按确认结果进行日常控制。需要对环氧乙烷的解析进行验证,控制其残留量。其解析时间因初始污染菌、所用设备、工艺控制以及包装材料不同而不同。
3.4 产品放行
3.4.1 放行审核 医用口罩应按文件化的成品放行程序[15]批准放行,如对工艺流程、生产记录、质量控制(原料、过程、成品检验)、产品实现全过程、法规要求等方面的审核。
3.4.2 禁止放行 不得出现不满足质量控制要求的放行,如关键工序的中间品、成品质量未控制而转入下一流程;未对特殊过程参数确认或未按确认结果实施控制;成品检验未覆盖经注册的产品技术要求规定等。
4 生产现状与应急困难
4.1 需求剧增与工艺控制
4.1.1 灭菌/解析周期 医疗中使用的医用口罩日常需求量相对稳定,供需基本平衡,企业自主生产,原料和成品库存量小。我国已取得产品注册的生产企业,多数采用环氧乙烷灭菌工艺,经注册批准以无菌形式供应。由于环氧乙烷众所周知的毒性,灭菌后须进行有效地解析至残留量控制限度以下。各制造商灭菌设备和控制参数不同,解析时间长短不一,如有的长达2周。虽然灭菌、真空、充氮循环操作一体的设备操作周期短,但价格不菲,多数企业规模小,配备者少。而且变更工艺会影响产品质量,须进行验证/确认,影响环氧乙烷灭菌效果的因素也有相关报道[16]。显然,医用口罩本身的吸附性能也是其不易灭菌、难解析、周期长的原因,在实践中绝大多数制造商采用了这种工艺,也有其现实的考虑,比如可自行控制。
4.1.2 灭菌放行 标识“无菌”的医用口罩,无菌检验周期也较长。目前,无菌检验通常列入出厂检验项目,产品放行条件包括完成出厂检验项目且符合规范的要求。对于灭菌这一特殊过程,虽然经过有效的确认,但采用参数放行的情况也极少,制造商往往会在各项稽查活动中需要提供无菌检验合格报告书。制造商选择检验合格再出厂,也是周期长的原因之一。
4.1.3 适用范围与应用 使用医用口罩前首先应查看说明书。有的产品名称为医用口罩,适用范围指明“供医疗单位非有创操作时防护用”“用于佩戴者在不存在体液和喷溅风险的普通医疗环境下的卫生护理”;另有一次性使用口罩帽、医用口罩帽子,其适用范围为“在不存在体液和喷溅风险的普通医疗环境下的卫生护理”“适用于非传染病房的医护人员在医疗过程中使用”等,使用中应加以区分,在给定的适用范围内使用。另一种超范围使用的现象是基于医用外科口罩、医用防护口罩等低呼吸阻力和高阻隔性能的优点而用于非医用需求的场合,以及在没有无菌要求的操作中广泛使用标识“无菌”的医用口罩,也造成不必要的浪费。
4.1.4 增产受制约 医用口罩生产具有对原材料性能要求高、可选面小,实际加工控制严、周期长(灭菌、解析)的特点。面对医用口罩乃至各类口罩用量的突然剧增,受到原料供应、生产控制的明显制约。若为了加速生产而改变灭菌工艺,存在诸如材料选择、工艺改造、操作控制上的难点。
4.2 更换原料与风险评估
4.2.1 原料变更的评估 《医疗器械生产质量管理规范》规定“当选用的材料、零件或者产品功能的改变可能影响到医疗器械产品安全性、有效性时,应当评价因改动可能带来的风险,必要时采取措施将风险降低到可接受水平,同时应当符合相关法规的要求”。
4.2.2 变更的风险控制 经注册批准的医用口罩从设计开发到投产上市,完成了对原材料选择、工艺验证、性能评价、工艺控制等一系列工作,确保最终满足性能要求。不仅是法规要求,原材料的改变会导致对产品性能、工艺控制参数的影响,必须进行系统地验证来重新评价产品质量。医用口罩的原材料应有一定的特性(本文1.3),在加工、使用中保护原材料固有、预期的性能是不可忽略的,原料变更带来的风险不容忽视。
4.3 基本性能与灭菌工艺
4.3.1 工艺变更的验证 为缩短灭菌解析周期,加速解析是一种方式,但多次加热、施压对医用口罩性能的影响程度也需重新验证。此外,可能会考虑到放射源(60Co-γ)、电子束等辐射灭菌方式的优点。GB 18280.1-2015[17]标准陈述了正确执行辐射灭菌的相关过程,但不能成为“产品无菌及符合预定用途的可靠保证”,就灭菌而言,须考虑诸如口罩材质、包装方式、包装材料、初始污染菌、生产环境、人员及卫生、设备和过程控制等因素的影响。GB 16352-1996[18]规定必须对辐射灭菌工艺加以确认,确定材料的适用性、最低灭菌剂量(微生物数量、抗辐射性、无菌保证水平)、装载模式、剂量分布图等。
4.3.2 对材料性能的影响 辐射中高能量射线对高分子材料性能的影响已得到了广泛共识,已有文献报道[19]。有关辐射灭菌的国家标准、行业标准均不同程度地强调应将所灭菌材料对辐射灭菌剂量影响的研究应用于产品的设计开发。如GB 16352-1996明确规定“用于辐射灭菌的医疗用品和包装材料必须以常规辐射灭菌期间预期最大剂量照射进行测试,以评价材料的辐射物理和辐射化学稳定性和生物适用性,尤其要重视辐射产生的高分子解聚效应”。而辐射对聚丙烯材料的影响较明显,会导致降解。
4.3.3 过滤层的性能和确认 医用口罩的过滤层既保持口罩良好的通气性又要保持其高阻隔性能,过滤材料的结构以及驻极化工艺处理后的静电效应是发挥其过滤效率的关键所在[20],而任何对材料性质、结构和电荷分布的影响必然导致过滤性能的下降。60Co-γ、电子束、X射线在对细菌进行杀灭的过程中对材料固有特性也发挥着同样的损伤作用,如辐射的高能射线会破坏聚合物的分子键,其作用的大小与材料性质有关。应对辐射灭菌材料原有性能特性进行确认,作为医疗器械必须保证有效、安全。
4.3.4 确保性能有效与应急管理 从医用口罩加工材料的结构、过滤机制以及工艺控制对基本性能的影响可知,在使用前查看制造商提供的标识、标签、说明书,了解其推荐的供应状态、适用范围、注意事项是极其重要的。从另一角度看,可以说国外口罩不采用标识“sterile”供应的方式是出于对其固有特性的保护和质量的保证。医用口罩用于防护目的,首先应当保证有效,即阻隔、过滤性能。有的使用者或建议性文字,采用购买某些进口产品,临用前自行灭菌的做法或说法,是与制造商的预期相违背的。无论何种灭菌方式,无论是借鉴已有灭菌控制的经验,还是依照医疗机构规范的操作规程,对医用口罩的灭菌加工必须考虑其材料的耐受性。也正如由卫生部门提出的GB 16383-2014[21]标准所强调的“所用包装采料应是耐辐射灭菌剂量的材料”,也必然应考虑所灭菌产品的材料对辐射灭菌剂量的阻抗能力。至于扩产能,对没有生产医疗器械经历、应时组建改建的生产线,且不论其生产环境和质量管理体系,如果没有对原材料、加工工艺进行有效的验证/确认,而评价其风险控制确实有极大的困难。这是基于产品有效性方面的考虑。从产品应用方面讲,毕竟不同行业的使用目的不同,防护目标不同,技术要求也就不尽相同。须以口罩的使用目的为主,满足临床使用性能要求,一次性使用医用防护服亦是如此。
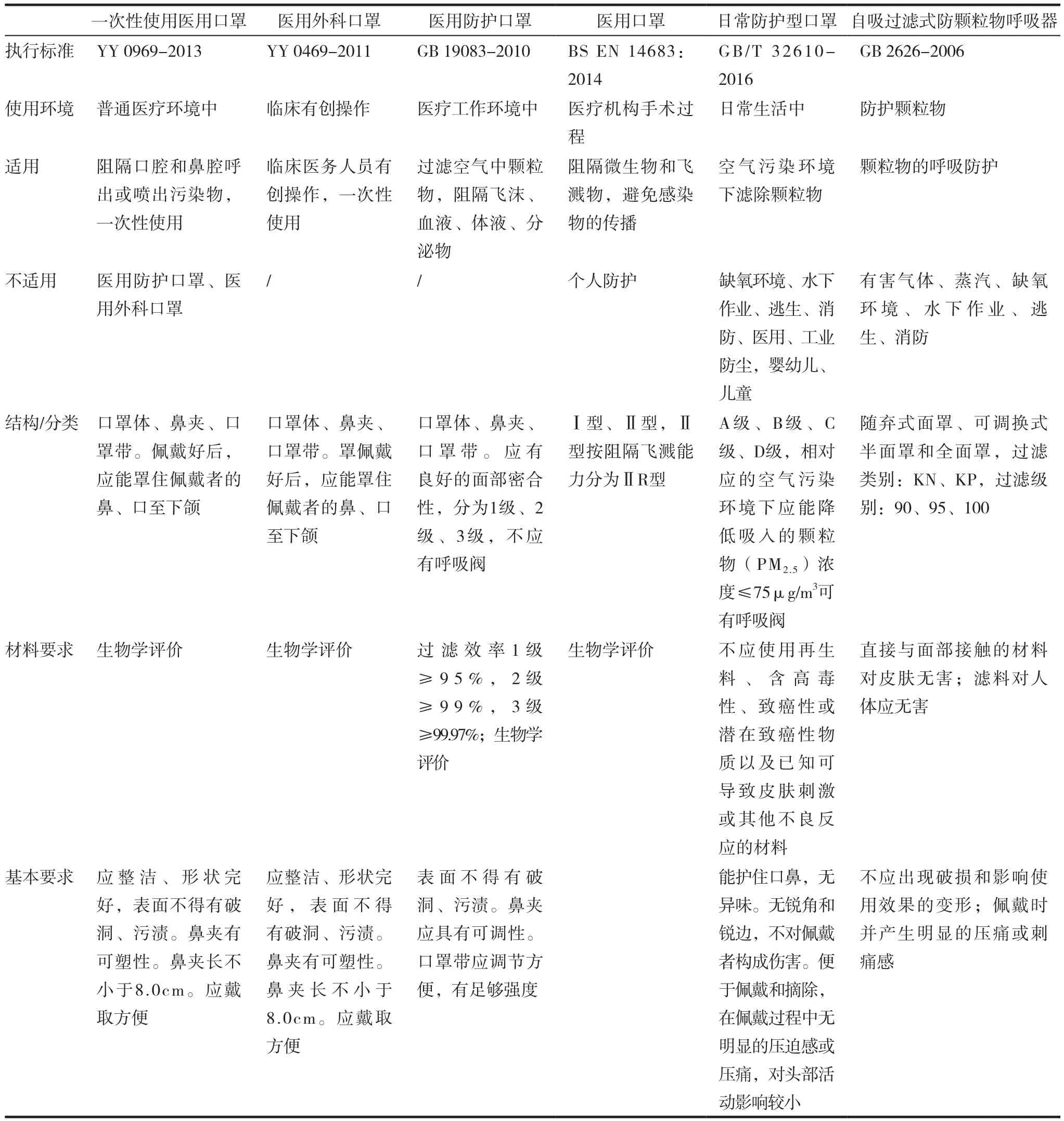
表1 适应范围、结构比较
4.3.5 使用说明与固有性能 由于口罩供应的紧缺,出现了考虑使用时效、节省而自行消毒处理后继续使用的现象或所谓的应急经验,如喷洒、晒照、加热、紫外,是不可取的。对于医用口罩,所用材料会受环境温湿度、紫外线、所经加工工艺等影响,未按照说明书要求的使用或再处理,均会影响医用口罩的固有性能。

表2 主要性能指标比较
4.4 临床需求与微生物指标
4.4.1 环氧乙烷残留量控制 在我国,医疗器械尤其是高分子产品,选择环氧乙烷灭菌的很多,量也比较大。回顾各类产品的国家标准、行业标准,其中不同材质、结构、用途的医疗器械环氧乙烷残留量均限定为不得大于“10μg/g”。而依据GB 16886系列标准进行生物学评价后,若能按照不同接触方式和使用时间合理选择、分类制定限量指标,在满足使用要求的同时可节约资源,应将成为医疗器械标准制修订工作者努力的方向。
4.4.2 灭菌控制与无菌需求 制造商为了满足不同的应用场合或需求,往往设计为功能多、指标严、范围广的产品;对“无菌”的选择似乎成为了一种追求或同类产品之间的攀比,而不明了临床对“无菌”要求的必要性。采购者也借以方便、安全、价格等因素崇尚“无菌”产品。但究其原因,多数情况下,对在哪些场合必须使用“无菌”的,哪些场合也可使用未标识“无菌”医疗器械的规定并不是十分确切,而由使用习惯自行决定或由可得产品的推荐为主。也导致标准制定时无由名状地首选“无菌”。YY/T 0615.1-2007[22]规定“无菌”医疗器械存在微生物的理论概率应不超过1×10-6,即无菌保证水平10-6。使用此类医疗器械的主管部门应当明确规定必须使用无菌器械的操作或场合,尤其对于医用防护口罩、医用防护服一类的防护器械,从应用场所、基本性能等方面不得不将可能会出现应急的因素预先考虑在内。为节约资源保障供应,依据实际应用要求,提出合理的控制指标。医用防护服亦是如此。
4.4.3 注册核查与生产能力 在对医疗器械产品技术要求的注册核准中,也应充分了解医用口罩的不同应用场合,分类制定技术参数和指标。像医用防护口罩、医用防护服等防护器械日常用量较小,而在应用中不可避免会出现某些应急场景,应注重生产周期,以保障快速批量生产的控制。在此前的产品生产审批实践中,忽视了对生产效率和应急质量控制能力的考核。
5 结果与建议
5.1 储能备物
医用口罩、医用防护服等属于防护性医疗器械,自主生产,市场调节的模式,即使能满足临时征用需求,但不利于应急管理。应建立国家储备为主的保障机制,一旦急需,统一调度。
5.2 鉴途致用
性能指标的确立必须保障临床使用有效和安全,以临床使用目的、实际要求为基点,甄别防护用医疗器械预期用途,按性能要求规范分类、适用范围和控制指标,如无菌。
5.3 完工善控
医用口罩、医用防护服等防护用医疗器械用于日常和应急,质量控制和快速生产能力是必要的,建议从生产、审批方面考核应急情况下的工艺控制、质量保证能力,有效发挥生产效能。
